Περίληψη
Η βεδολιζουμάμπη είναι ένας α4β7 ανταγωνιστής της ιντεγκρίνης, ένα ανθρώπινο μονοκλωνικό αντίσωμα το οποίο ελαττώνει την ανταλλαγή των λεμφοκυττάρων στο έντερο. Αυτός ο εκλεκτικός εντερικός μηχανισμός δράσεως την καθιστά ασφαλή εναλλακτική θεραπεία έναντι των άλλων βιολογικών παραγόντων που χρησιμοποιούνται στη θεραπεία της ελκώδους κολίτιδας. Από την ανασκόπηση των διαφόρων μελετών προκύπτει ότι η βεδολιζουμάμπη είναι αποτελεσματική για την επαγωγή και διατήρηση της υφέσεως σε ασθενείς με ελκώδη κολίτιδα είτε ως θεραπεία πρώτης εκλογής ή μετά αποτυχία των άλλων παραγόντων. Η θεραπεία με βεδολιζουμάμπη είναι αποτελεσματική καθόσον επιτυγχάνεται μακράς διαρκείας κλινική απάντηση, κλινική ύφεση, κλινική ύφεση ελευθέρας κορτικοστεροειδών και επούλωση του βλεννογόνου σε ασθενείς με μέτρια έως σοβαρή ελκώδη κολίτιδα. Τα υπάρχοντα δεδομένα υποστηρίζουν το θετικό μακράς διαρκείας οφέλους – κινδύνου προφίλ της βεδολιζουμάμπης για τη θεραπεία της ελκώδους κολίτιδας.
Treatment of Ulcerative Colitis with Vedolizumab
Abstract
Vedolizumab, a human monoclonal antibody to the a4b7 integrin, reduces the exchange of lymphocytes trafficking to the intestine. This gut-selective mechanism of action offers a safer alternative to other biological agents used in the treatment of ulcerative colitis. A review of the various studies shows that vedolizumab is effective in inducing and maintaining recurrence in patients with ulcerative colitis either as a treatment of first choice or after failure of other factors. Vedolizumab treatment is effective as long-term clinical response, clinical remission, corticosteroid-free clinical remission, and mucosal healing in patients with moderate-to-severe ulcerative colitis. The available data support the positive long-term benefit-risk profile of vedolizumab in the treatment of ulcerative colitis.
Εισαγωγή
Η φλεγμονώδης νόσος του εντέρου, η οποία περιλαμβάνει αμφότερες την ελκώδη κολίτιδα και νόσο του Crohn, είναι μη ιάσιμη χρόνια φλεγμονώδης διαταραχή πρωτοπαθώς επηρεάζουσα τον γαστρεντερικό σωλήνα. Αυτή αποτελεί ένα σημαντικό πρόβλημα και η επίπτωση και συχνότητά της έχουν αυξηθεί παγκοσμίως με υψηλότερη συχνότητα στην Ευρώπη και ΗΠΑ. Η ελκώδης κολίτις παραμένει ο συνηθέστερος τύπος της φλεγμονώδους νόσου του εντέρου με ετήσια συχνότητα κυμαινόμενη από 0 έως 24 ανά 100.000 άτομα ετησίως και η επίπτωση μεταξύ 4,9 και 505 περιπτώσεις ανά 100.000 παγκοσμίως.1 Η ελκώδης κολλητής είναι χρόνια υφέσιμη/υποτροπιάζουσα κατάσταση, η οποία είναι το αποτέλεσμα της μη ελεγχόμενης φλεγμονής του εντερικού βλεννογόνου.2 Η ελκώδης κολίτις (ΕΚ) είναι διάχυτη, μη ειδική φλεγμονώδης νόσος άγνωστου αιτιολογίας. Αυτή χαρακτηρίζεται από παρατεταμένο ερεθισμό του βλεννογόνου του κόλου και ορθού, αποτέλεσμα του οποίου είναι ο σχηματισμός διαβρώσεων και/ή ελκών που μπορεί να προκαλέσουν διάφορα κλινικά συμπτώματα. Όσον η ΕΚ συχνότερα παρατηρείται στην νεαρά ηλικία, η ποιότητα Ζωής των ασθενών συχνά επηρεάζεται και παρουσιάζεται με συμπτώματα όπως κοιλιακό άλγος, διάρροια και αιματηρά κόπρανα. Η ΕΚ χρονικώς εξελίσσεται με επαναλαμβανόμενους κύκλους υποτροπής και υφέσεως. Εξωεντερικές εκδηλώσεις μπορεί να αναπτυχθούν σε διάφορα όργανα, όπως το δέρμα, αρθρώσεις και άλλα. Αν και η αιτία της νόσου είναι άγνωστη, υπάρχει διεθνής ομοφωνία ότι η φλεγμονή συνδυάζεται με γενετική προδιάθεση ως αποτέλεσμα της διαταραχής των ρυθμιστικών μηχανισμών μέσω των οποίων διάφοροι περιβαντολλογικοί παράγοντες εμπλέκονται στο ανοσολογικό σύστημα του εντερικού βλεννογόνου.
Επειδή η παθοφυσιολογία της φλεγμονώδους νόσου του εντέρου είναι περιπλεγμένη, ο ακριβής καθορισμός της καταστάσεως της νόσου είναι ουσιώδης για τον σχεδιασμό της κατάλληλου θεραπείας, η οποία για την ΕΚ κυμαίνεται εξαρτώμενη από το στάδιο, έκταση και βαρύτητα της νόσου. Το παθολογοανατομικό στάδιο της ΕΚ συχνά ταξινομείται ως είτε ενεργό στάδιο, κατά το οποίο οι ασθενείς παραπονιούνται για αιματηρά κόπρανα και ενδοσκοπικώς εμφανίζουν απώλεια του αγγειακού χαρακτήρος με ευρήματα εύθρυπτου βλεννογόνου, διαβρώσεων και/ή ελκών – ή υφέσεως – κατά την οποία οι αιματηρές κενώσεις έχουν υποχωρήσει και ενδοσκοπικώς παρατηρείται επανεμφάνιση του χαρακτήρος του βλεννογόνου και της απώλειας του εύθρυπτου βλεννογόνου, διαβρώσεων και/ή ελκών. Επιπλέον, η ΕΚ μπορεί να διαιρεθεί στους ακόλουθους τύπους γεγονός που εξαρτάται από την έκταση των βλαβών: πρωκτίτις, περιφερική κολίτις, κολίτις της αριστεράς πλευράς και πανκολίτις. Χρησιμοποιώντας την Trulove-Witts βαθμολογία, η βαρύτητα της ΕΚ σε βαθμούς είναι: Ήπια, μέτρια ή σοβαρά σύμφωνα με τη συχνότητα των αφοδεύσεων και αιμορραγικών κοπράνων και των συστηματικών συμπτωμάτων όπως είναι ο πυρετός, σφυγμοί και αναιμία.5
Η ενδοσκοπική εκτίμηση της βαρύτητας της εταιρικής βλάβης είναι ουσιώδης για τον καθορισμό της θεραπείας της ΕΚ. Μεταξύ των ενδοσκοπικών δεικτών για την ΕΚ ευρέως χρησιμοποιείται στις κλινικές μελέτες η Mayo ενδοσκοπική βαθμολογια.6 Η επούλωση του βλεννογόνου αναφέρεται με τη βαθμολογία 0 (φυσιολογική ή μη ενεργός νόσος) ή 1 (ήπια νόσος: ερύθημα, ελαττωμένο αγγειακό χαρακτηριστικό και ήπια ευθρυπτότητα). Η ενδοσκοπική επούλωση του βλεννογόνου είναι χρήσιμη εξέταση η οποία επιτρέπει τον καθορισμό της καταλλήλου θεραπείας για τη διατήρηση της υφέσεως και προβλέψεως της υποτροπής της ΕΚ, αν και αμφιβολίες παραμένουν σχετικά με τον ακριβή ορισμό της επούλωσης του βλεννογόνου, περιλαμβανομένων των ιστολογικών ευρημάτων.
Σύγχρονη Θεραπεία της Ελκώδους Κολίτιδας
Οι συμβατικές θεραπείες είναι οι ακόλουθες: Το 5-αμινοσαλικυλικό οξύ είναι αποτελεσματικό στην επαγωγή και διατήρηση της υφέσεως της ΕΚ. Τα κορτικοστεροειδή παραμένουν η δεσπόζουσα θεραπεία για την πρόκληση της υφέσεως της μέτριας έως σοβαράς παροξύνσεως της ΕΚ. Οι ανοσοκατασταλτικοί παράγοντες, όπως η αζαθειοπρίνη και 6-μερκαπτοπουρίνη χρησιμοποιούνται στην πρόληψη των συχνών υποτροπών σε ασθενείς με ΕΚ σε ύφεση, ειδικότερα σε αυτούς με εξάρτηση στα κορτικοστεροειδή ή αυτούς που η ύφεση δεν μπορεί να διατηρηθεί με το 5-αμινοσαλικυλικό οξύ.2-4 Κατά τις τελευταίες δύο δεκαετίες, η εκτεταμένη έρευνα εστιάστηκε στην κατανόηση των ανοσολογικών εξεργασιών στην παθογένεση των φλεγμονωδών νόσο του εντέρου.7 Πλέον στοχευμένες θεραπείες έχουν αναπτυχθεί οι οποίες ειδικώτερα αναστέλλουν τους μεσολαβητές της φλεγμονής του εντέρου, όπως είναι τα μονοκλωνικά αντισώματα, οι οποίες είναι επαναστατικές στη θεραπεία για τις φλεγμονώδεις νόσους του εντέρου. Οι μετα-αναλύσεις και οι διασταυρούμενες ελεγχόμενες μελέτες έδειξαν ότι η χρήση της ινφλιξιμάμπης8 και αδαλιμουμάμπης9 διαδραματίζουν σημαντικό ρόλο στην επαγωγή της εφέσεως σε ασθενείς με ανθεκτικότητα στα κορτικοστεροειδή ή στην μέτρια έως σοβαρά ΕΚ εξαρτώμενη από τα κορτικοστεροειδή. Εντούτοις, μια αναλογία των ασθενών δεν αποκρίνεται σε αυτά τα φάρμακα, χάνει την απάντηση με την πάροδο του χρόνου ή αυτές οι θεραπείες δεν γίνονται ανεκτές.10 Ατυχώς, οι ασθενείς με φλεγμονώδη νόσο του εντέρου που έχουν προηγουμένως θεραπευθεί με αντι-TNF-α παράγοντες είναι προδιατεθειμένοι είτε σε πρωτοπαθή μη απάντηση ή δευτεροπαθή απώλεια απαντήσεως.10 Επιπλέον, λαμβανομένων υπόψη ότι αυτά τα φάρμακα έχουν βρεθεί ότι συνοδεύονται με αυξημένο κίνδυνο αναπτύξεως σοβαρών ανεπιθύμητων αντιδράσεων, συμπεριλαμβανομένων των λοιμώξεων, η έλευση νεότερης κατηγορίας φαρμάκων χαρακτηριζόμενη από διαφορετικό τρόπο δράσεως, είναι μία ελκυστική εκλογή για ασθενείς με ΕΚ. Σε αυτή την κατηγορία ανήκει και η βεδολιζουμάμπη όπως αναλύετε κατωτέρω.
Βεδολιζουμάμπη: Μηχανισμός Δράσεως, Φαρμακοκινητική και Φαρμακοδυναμική
Πρόσφατες ερευνητικές πρόοδοι έχουν επιτευχθεί στην ανάπτυξη φαρμάκων που στοχεύουν στις εναλλακτικές οδούς της φλεγμονής στη φλεγμονώδη νόσο του εντέρου. Μια σημαντική οδός κατά την οποία αναπαράγεται η φλεγμονή του εντέρου στη φλεγμονώδη νόσο του εντέρου συμπεριλαμβάνει την συνάθροιση των κυκλοφορούντων Τ λεμφοκυττάρων εντός των εντερικών αγγειακών επιθηλιακών κυττάρων.11 Η ανταλλαγή των λεμφοκυττάρων συμπεριλαμβάνει την σύμπλοκη πρόσδεση του καταρράκτου με αποτέλεσμα το δέσιμο, κύλιση, στερεά πρόσδεση και τελικώς μετανάστευση των λεμφοκυττάρων από τον αγγειακό χώρο εντός του φλεγμονώδους ιστού.11 Οι ιντεγκρίνες παίζουν κριτικό ρόλο στην πρόσδεση του καταρράκτη. Υπάρχουν ετεροδιμετρικοί υποδοχείς αποτελούμενοι από μια α και β υποομάδα, η οποία εκφράζεται στην επιφάνεια των κυκλοφορούντων λεμφοκυττάρων όπου αυτές ενεργοποιούνται και συνδέονται με το μείζον μόριο, Mucosal addressin-cell adhesion molecule -1 (Μόριο προσκόλλησης βλεννογόνου-κυττάρου-1) (συνήθως εν συντομία, MedCAΜ-1), που εκλεκτικώς εκφράζεται στο εντερικό ενδοθήλιο. Αυτή η βοήθεια της συνδέσεως των κυκλοφορούντων λεμφοκυττάρων επί του ενδοθηλίου και η μετανάστευση εντός της λεπτής στιβάδας και ιστού, συμβάλλουν στη φλεγμονώδη εξεργασία της φλεγμονώδους νόσου του εντέρου. 12
Οι ανταγωνιστές της ιντεγκρίνης είναι μονοκλωνικά αντισώματα τα οποία αποκλείουν την ανταλλαγή των λεμφοκυττάρων στο εντερικό ενδοθήλιο. Ο πρώτος ανταγωνιστής ήταν η ναταλιζουμάμπη, ένα ανθρώπινο IgG4 μονοκλωνικό αντίσωμα που ενδεχομένως προκαλεί την αναστολή της α4 ιντεγκρίνης. Αυτή εγκρίθηκε το 2008 για τη θεραπεία της ΕΚ. Εντούτοις η ευρεία χρήση της ναταλιζουμάμπης περιορίστηκε επειδή αυτή συνοδευόταν με αυξημένη συχνότητα προοδευτικής πολυεστιακής λευκοεγκεφαλοπάθειας, μια σπάνια αλλά θανατηφόρο απομυελυνωτική νόσο του κεντρικού νευρικού συστήματος προκαλούμενη από το ευκαιριακό ανθρώπινο John Cunnigham ιό.13 Η ναταλιζουμάμπη αναστέλλει όχι μόνο την α4β7, η οποία είναι η έκφραση της συνδεδεμένης με Τ λεμφοκύτταρα επί των φλεγμονωδών κυττάρων, αλλά επίσης την α4β1, η οποία μεσολαβεί στη διαβίωση των λεμφοκυττάρων στο κεντρικό νευρικό σύστημα.
Η βεδολιζουμάμπη είναι ένα πλήρες μονοκλωνικό IgG-1 αντίσωμα το οποίο εκλεκτικώς αναστέλλει την αλληλεπίδραση μεταξύ α4β7 ιντεγκρίνης και την σύνδεση της MADCAM-1 και όθεν ελαττώνει την διήθηση αυτών των φλεγμονωδών κυττάρων εντός του εντερικού βλεννογόνου ιστού και καταστέλλει την εντερική φλεγμονή.14
Η βεδολιζουμάμπη υφίσταται ταχεία, κορεσμένη, μη γραμμική, στοχευμένη διάμεση εξεργασία απεκκρίσεως στις χαμηλές συγκεντρώσεις και βραδεία, γραμμική, μη ειδική εξεργασία απεκκρίσεως στις υψηλές συγκεντρώσεις. Στις θεραπευτικές συγκεντρώσεις, η βεδολιζουμάμπη πρωτοπαθώς υπόκειται σε γραμμική απέκκριση. Η γραμμική κάθαρση (C1) της βεδολιζουμάμπης είναι παρόμοια σε ασθενείς με ΕΚ και νόσο του Crohn. Ο χρόνος ημισείας ζωής της βεδολιζουμάμπης είναι 25,5 ημέρες.13
Αποτελεσματικότητα της Βεδολιζουμάμπης
Η αποτελεσματικότητα της βεδολιζουμάμπης σε ασθενείς με ΕΚ έχει κατοχυρωθεί σε σημαντικό αριθμό τυχαιοποιημένων δοκιμασιών.
Φάση I Δοκιμασία: Το 2000, ο Feegan και συνεργάτες πραγματοποίησαν μια διπλή-τυφλή, placebo-ελεγχόμενη μελέτη σε 29 ασθενείς με μέτρια έως σοβαρά ΕΚ και στους οποίους χορηγήθηκε σε απλή δόση το ανθρώπινο α4β7 αντίσωμα (LPD-O2) ή placebo σε απλές δόσεις.14 Τα κριτήρια συμμετοχής περιελάμβαναν την ενδοσκοπική επαλήθευση της ΕΚ από το άκρο του πρωκτού, το ελάχιστον 3 κενώσεις του εντέρου ημερησίως και Mayo βαθμολογία 5 ή περισσότερο. Η μέση Mayo βαθμολογία είναι 10. Οι επιλεγέντες ασθενείς (86%), έλαβαν και συνέχισαν την ίδια δόση της συνακολούθου χορηγήσεως 5-αμινοσαλικυλικό οξύ για 3 εβδομάδες και 34% έλαβαν κάποια δόση πρεδνιζόνης κατά τη διάρκεια της μελέτης. Στους ασθενείς χορηγήθηκε είτε μία απλή δόση του LPD-O2 σε αυξημένη δόση (0,15mg/Kg υποδορίως, 0,15mg/Kg ενδοφλεβίως, 0,5mg/Kg ενδοφλεβίως και 3mg/Kg ενδοφλεβίως) ή placebo σε 5:2 σε εκάστη ομάδα. Οι συγγραφείς βρήκαν ότι 40% των ασθενών της LPD-O2 ομάδας 0,5mg/Kg επέτυχαν μεγάλη ύφεση ενώ ουδείς ασθενείς της placebo ομάδας επέτυχε ύφεση.
Φάση II Δοκιμασία: Το 2005, ο Feagan και συνεργάτες προέβησαν σε μία πολυκεντρική, διπλή-τυφλή, placebo-ελεγχόμενη δοκιμασία του α4β7 αντισώματος MLNO2 σε 181 ασθενείς με ενεργό ΕΚ.16 Η δραστηριότητα της νόσου ορίζετο ως ΕΚ κλινική βαθμολογία 5 έως 9 βαθμούς, με βαθμολογία τουλάχιστον 1 είτε με συχνότητα κοπράνων ή ορθική αιμορραγία με τροποποιημένη Baron βαθμολογία τουλάχιστον 2 στη σιγμοειδοσκόπηση, με τη νόσο εκτεινόμενη τουλάχιστον το ελάχιστον 25εκ. από το άκρο του πρωκτού. Στη μελέτη συμπεριλήφθηκαν ασθενείς με ενεργό ΕΚ και είτε χωρίς θεραπεία ή σταθερές δόσεις μεσαλαζίνης. Από την μελέτη αποκλείστηκαν ασθενείς υποβαλλόμενοι σε θεραπεία με κορτικοστεροειδή από το στόμα εντός 4 εβδομάδων ή ενδοφλεβίως κορτικοστεροειδή εντός 6 εβδομάδων προ της επιλογής, τοπική θεραπεία με μεσαλαζίνη ή κορτικοστεροειδή την προηγούμενη 1 εβδομάδα, ανοσοκατασταλτικές θεραπεία τους προηγούμενους 3 μήνες και σοβαρά ενεργό νόσο. Οι ασθενείς τυχαιοποιήθηκαν προκειμένου να λάβουν είτε 0,5mg/Kg MLNO2 (αριθμός 58), 2mg/Kg MLNO2 (αριθμός 60) ή placebo (αριθμός 63) ενδοφλεβίως την ημέρα 1 και ημέρα 29. Αυτοί βρήκαν ότι 6 εβδομάδες μετά την έναρξη της θεραπείας, η συχνότητα υφέσεως ήταν υψηλότερη στις ομάδες θεραπείας έναντι της placebo ομάδας για αμφότερες την κλινική ύφεση : 0,5mg/Kg 33%, 2mg/Kg 32%, placebo 14% p=0.03 και με ενδοσκοπική ύφεση: 0,5mg/Kg 28%, 2mg/Kg 12%, placebo 8% p=0.007.15
Ο Parikh και συνεργάτες σε μία μελέτη Φάσεως II, προέβησαν σε μία τυχαιοποιημένη ελεγχόμενη δοκιμασία χρησιμοποιώντας μια βελτιωμένη μορφή της βεδολιζουμάμπης με υλικό παραγόμενο από την ωοθήκη τρωκτικού. Στη μελέτη τυχαιοποιήθηκαν 47 ασθενείς από 11 κέντρα στον Καναδά και Ρωσία.16 Κριτήρια για την εισαγωγή στη μελέτη ήταν ασθενείς ηλικίας 18-70 ετών που ήταν διαγνωσμένοι με ΕΚ, κατοχυρωθείσα ιστοπαθολογικώς ή ενδοσκοπικώς με ελάχιστο διάστημα της νόσου 10 έτη. Αυτοί οι ασθενείς τυχαιοποιήθηκαν για να λάβουν είτε βεδολιζουμάμπη (αριθμός 38) [2mg/Kg (αριθμός 113), 6mg/Kg (αριθμός 14) ή 10mg/Kg (αριθμός 11)] ή placebo (αριθμός 09) τις ημέρες 1, 15, 29 και 85 και ήταν υπό συνεχή παρακολούθηση για 253 ημέρες. Η κλινική ύφεση και απάντηση αξιολογείτο με βάση την Mayo βαθμολογία και την καλπροτεκτίνη των κοπράνων. Οι χρησιμοποιηθείσεις δόσεις τις βεδολιζουμάμπης σε αυτήν την μελέτη ήταν υψηλότερες και η συχνότητα μεταξύ των δόσεων ήταν βραχύτερη έναντι των προηγούμενων δοκιμασιών. Η συχνότητα της κλινικής απαντήσεως στις ομάδες με βεδολιζουμάμπη υπερέβαιναν το 50% μεταξύ ημέρας 29 και ημέρας 253 συγκριτικά με 22-33% στην placebo ομάδα. Για τους ασθενείς με οριακή δραστηριότητα της νόσου, η συχνότητα της κλινικής υφέσεως εκυμαίνετο από 53% έως 79% στις ομάδες με βεδολιζουμάμπη συγκριτικά με 25% έως 50% στην placebo ομάδα. Τα επίπεδα της καλπροτεκτίνης επίσης βρέθηκαν ελαττωμένα στις ομάδες με βεδολιζουμάμπη συγκριτικά με αυτούς στην placebo ομάδα.17 Κατά τη διάρκεια της συνεχούς παρακολουθήσεως, βρέθηκε ότι οι ασθενείς θεραπευθέντες με βεδολιζουμάμπη είχαν μεγαλύτερη αναλόγια έναντι αυτών που έλαβαν placebo. 17
Φάση III Δοκιμασία: Η GEMINI 1 δοκιμασία δημοσιεύτηκε το 2013.18 Η φάση III δοκιμασία ήταν μία τυχαιοποιημένη, διπλή-τυφλή, placebo-ελεγχόμενη μελέτη και αφορούσε την αποτελεσματικότητα, ασφάλεια και ανοχή της βεδολιζουμάμπης (MLNO2) σε ασθενείς με μέτρια έως σοβαρά ΕΚ (Mayo βαθμολογία 6 έως 12 βαθμούς με ενδοσκοπική βαθμολογία ≥2 βαθμούς και νόσο ≥15cm από το άκρο του πρωκτού) και προηγούμενη αποτυχία ή ανοχή στα κορτικοστεροειδή, ανοσοκατασταλτικά ή TNF ανταγωνιστές. Για την εφαρμογή της δοκιμασίας, οι ασθενείς τυχαιοποιήθηκαν για να λάβουν είτε βεδολιζουμάμπη 300mg την 0 και 2 εβδομάδες ή placebo με έμφαση στην πρωτοπαθή κλινική απάντηση (ελάττωση της Mayo βαθμολογίας ≥3 βαθμούς και ελάττωση ≥30% από την οριακή βαθμολογία με ελάττωση ≤1 βαθμούς της ορθικής αιμορραγίας ή απόλυτη βαθμολογία της ορθικής αιμορραγίας 1 βαθμό στις 6 εβδομάδες). Οι ασθενείς τυχαιοποιήθηκαν προκειμένου να λάβουν είτε απλή δόση 300mg ενδοφλεβίως βεδολιζουμάμπης ή placebo την ημέρα 1 και 15. Κατά την 6η εβδομάδα, υπήρξαν στατιστικώς σημαντικές διαφορές μεταξύ της βεδολιζουμάμπης και placebo ομάδας σχετικά με την κλινική απάντηση (47,1% έναντι 25,5%, p<0.001), κλινική ύφεση (16,9% έναντι 5,4%, p=0.001) και επούλωση του βλεννογόνου (40,9% έναντι 24,8%, p=0.001). Μετά την ολοκλήρωση οι ασθενείς κατοχυρώθηκαν περαιτέρω σε μία δεύτερη κοχόρτη για να λάβουν open-label 300mg την 0 και 4 εβδομάδα προκειμένου να διευκολυνθεί η δυνατότητα του απλού δείγματος για την διατήρηση της δοκιμασίας. Οι ασθενείς (αριθμός 373), από είτε την εισαγωγή στην θεραπεία ή αυτοί που έλαβαν open-label βεδολιζουμάμπη, που επέτυχαν κλινική απαντήσει κατά τις 6 εβδομάδες 8 τυχαιοποιήθηκαν για να λάβουν 300mg βεδολιζουμάμπης κάθε 4 εβδομάδες, κάθε οκτώ εβδομάδες ή placebo ως τμήμα συντηρήσεως της δοκιμασίας μέχρι 52 εβδομάδες. Η πρωτοπαθής έκβαση όσον αφορά την κλινική ύφεση στις 52 εβδομάδες ήταν επιτυχής στο 41,8% των ασθενών με βεδολιζουμάμπη κάθε 8 εβδομάδες, 44,8% σε ασθενείς με βεδολιζουμάμπη κάθε 4 εβδομάδες και 15,9% σε ασθενείς που έλαβαν placebo (αμφότερες p<0.001) έναντι placebo). Σημαντικές διαφορές στην ευνοϊκή επίδραση της βεδολιζουμάμπης ( είτε κάθε 4 ή 8 εβδομάδες έναντι placebo) επίσης βρέθηκε για την στερεά κλινική απάντηση (κλινική απάντηση κατά τις εβδομάδες 6 και 52), στερεά κλινική ύφεση (κλινική ύφεση κατά τις εβδομάδες 6 και 52), επούλωση του βλεννογόνου και κλινική ύφεση ελεύθερης γλυκοκορτικοειδών. Δεν διαπιστώθηκαν σημαντικές διαφορές όταν έγινε σύγκριση κάθε 8 εβδομάδες έναντι κάθε 4 εβδομάδες θεραπείας με βεδολιζουμάμπη ή μεταξύ αυτών που έλαβαν ταυτόχρονα κορτικοστεροειδή ή ανοσοδιεγερτική θεραπεία. Δεν διαπιστώθηκαν διαφορές, όσον αφορά στα ανεπιθύμητα συμβάματα, συμπεριλαμβανομένων σοβαρών λοιμώξεων. Δεν διαπιστώθηκε προοδευτική πολυεστιακή λευκοεγκεφαλοπάθεια. Η μακράς διαρκείας επέκταση της open-label μελέτης έδειξε υψηλότερη συχνότητα κλινικής απαντήσεως (98%) και υφέσεως (90%) κατά την εβδομάδα 24 μεταξύ των ασθενών που είχαν απαντήσει στην εισαγωγική θεραπεία και περάτωσαν την GEMINI 1 δοκιμασία συντηρήσεως.19
Το 2019, ο Motoya και συνεργάτες πραγματοποίησαν στην Φάση III, μια τυχαιοποιημένη, διπλή-τυφλή, placebo-ελεγχόμενη δοκιμασία με την βεδολιζουμάμπη σε Ιάπωνες ασθενείς με μέτρια έως σοβαρά ΕΚ.20 Η διερευνητική ανάλυση της GEMINI 1 υποδεικνύει ότι μεγαλύτερη αποτελεσματικότητα μπορεί να επιτυγχάνεται με μακρότερη επαγωγική θεραπεία.18 Εντούτοις, η αποτελεσματικότητα της βεδολιζουμάμπης σε διάστημα >6 εβδομάδων δεν διερευνήθηκε ως πρωτοπαθές τελικό σημείο. Στην Ιαπωνική δοκιμασία, το πρωτοπαθές τελικό σημείο ήταν η κλινική απάντηση κατά την εβδομάδα 10, για την επαγωγική φάση, και η κλινική ύφεση κατά την εβδομάδα 60, για τη φάση συντηρήσεως. Στην εισαγωγική φάση συμπεριλήφθηκαν 292 ασθενείς, από τους οποίους, 83 ασθενείς επέτυχαν απάντηση στην βεδολιζουμάμπη και οι οποίοι μεταγενέστερα συμπεριλήφθηκαν στην φάση συντηρήσεως. Οι συχνότητες της κλινικής απαντήσεως κατά την εβδομάδα 10 ήταν 39,6% και 32,9% στις ομάδες με βεδολιζουμάμπη και placebo, αντιστοίχως. Στη φάση συντηρήσεως, η συχνότητα της κλινικής απαντήσεως κατά την εβδομάδα 60 ήταν σημαντικώς υψηλότερη στην ομάδα με βεδολιζουμάμπη στο 56,1% έναντι της placebo ομάδας στο 31%.
Προσφάτως, ο Sands και συνεργάτες21 δημοσίευσαν τα αποτελέσματα μίας συγκριτικής μελέτης της βεδολιζουμάμπης και αδαλιμουμάμπης σε ασθενείς με μέτρια έως σοβαρά ΕΚ. Αυτή η μελέτη ήταν της φάσεως 3b, διπλή-τυφλή, διπλή-εικονική, τυχαιοποιημένη, ενεργή-ελεγχόμενη δοκιμασία σε συνεργασία 245 κέντρων σε 34 κράτη όπου συγκρίθηκε η βεδολιζουμάμπη και η αδαλιμουμάμπη σε ασθενείς με μέτρια έως σοβαρή ΕΚ προκειμένου να καθοριστεί κατά πόσον η ζόμπι ήταν ανώτερη. Προηγούμενη έκθεση σε TNF αναστολέα άλλον εκείνου της αδαλιμουμάμπης βεβαιώθηκε σε πλέον του 25% των ασθενών. Οι ασθενείς προσδιορίστηκαν για να λάβουν ενδοφλέβιες εγχύσεις 300mg βεδολιζουμάμπης την ημέρα 1 και εβδομάδες 2, 6, 14, 22, 30, 38 και 46 (συν ενέσεις placebo) ή υποδόριες ενέσεις 40mg με συνολική δόση 160mg την εβδομάδα 1, 80mg την εβδομάδα 2 και 40mg κάθε 2 εβδομάδες μετά ταύτα μέχρι την εβδομάδα 50 (συν εγχύσεις placebo). Δεν επετράπη η ένταση της δόσεως σε κάθε ομάδα. Η πρωτοπαθής έκβαση ήταν η κλινική ύφεση την εβδομάδα 52 ( ορίστηκε ως τελική βαθμολογία της ≤2 της Mayo κλίμακας). Από τους τυχαιοποιηθέντες 769 ασθενείς που έλαβαν τουλάχιστον μία δόση βεδολιζουμάμπης 383 ασθενείς ή αδαλιμουμάμπη 386 ασθενείς. Την εβδομάδα 52, κλινική ύφεση παρατηρήθηκε σε υψηλότερο ποσοστό επί τοις 100 σε ασθενείς της ομάδας με βεδολιζουμάμπη έναντι της ομάδας με αδαλιμουμάμπη (31,3% έναντι 22,5%), ενώ η ενδοσκοπική βελτίωση ήταν 39,7% έναντι 27,7%, αντιστοίχως. Κλινική ύφεση ελευθέρας κορτικοστεροειδών παρατηρήθηκε στο 12,6% των ασθενών στην ομάδα της βεδολιζουμάμπης και 21,8% στην ομάδα της αδαλιμουμάμπης. Η ανοχή ήταν καλή. Οι συγγραφείς συμπεραίνουν ότι με βάση τα αποτελέσματα της μελέτης η βεδολιζουμάμπης ήταν ανώτερη της αδαλιμουμάμπης όσον αφορά την επίτευξη κλινικής υφέσεως και ενδοσκοπικής βελτιώσεως, αλλά όχι με την κλινική ύφεση ελευθέρας κορτικοστεροειδών σε ασθενείς με μέτρια έως σοβαρά ΕΚ.
Ο Ρόλος της Βεδολιζουμάμπης στη Θεραπεία της Ελκώδους Κολίτιδας
Όπως αναφέρθηκε, η βεδολιζουμάμπη είναι ένα ανθρώπινο μονοκλωνικό αντίσωμα στην α4β7 ιντεγκρίνη, ελαττώνουσα την ανταλλαγή των λεμφοκυττάρων στο έντερο. Αυτός ο εκλεκτικός κεντρικός μηχανισμός της δράσεως αποτελεί μια ασφαλή εναλλακτική οδό έναντι των άλλων βιολογικών παραγόντων που χρησιμοποιούνται στη θεραπεία της ΕΚ. Από της εισαγωγής της στην θεραπευτική το 2014, η βεδολιζουμάμπη χρησιμοποιείται ευρέος στην κλινική πράξη για τη θεραπεία της ΕΚ και της νόσο του Crohn.22,23 Όσον αφορά τον ρόλο της βεδολιζουμάμπης στη θεραπεία των ασθενών με ΕΚ στα τιθέμενα ερωτήματα, οι απαντήσεις βρίσκονται στις αναφερθείσες μελέτες καθώς και σε άλλες μικρότερες στις οποίες αναφέρεται διεξοδικά η υπό τους Schreider και συνεργατών24 δημοσιευθείσα συστηματική ανασκόπηση και μετα-ανάλυση όπου εξετάζεται η αποτελεσματικότητα και ασφάλεια τις βεδολιζουμάμπης. Σύμφωνα με αυτή την εργασία, οι συχνότητες της κλινικής υφέσεως για τη θεραπεία της ΕΚ ήταν 24% την εβδομάδα 6 και 32% την εβδομάδα 14, αυξηθείσα στο 39% στους 6 μήνες και 46% στους 12 μήνες. Οι συχνότητες των κλινικών απαντήσεων για τη θεραπεία της ΕΚ ήταν 43% την εβδομάδα 6, 56% την εβδομάδα 14 και 52% στους 12 μήνες. Σε ασθενείς με ΕΚ, οι συχνότητες της υφέσεως ελευθέρας κορτικοστεροειδών ήταν 14% την εβδομάδα 6, 26% την εβδομάδα 14 και 42% στους 12 μήνες. Τον μήνα 12, η συχνότητα επουλώσεως του βλεννογόνου εκυμαίνετο από 33% έως 77% σε ασθενείς με ΕΚ. Στους βιολογικούς ασθενείς με ΕΚ, η επιτευχθείσα κλινική ύφεση ήταν 51% την εβδομάδα 14 και 61% στους ασθενείς τους 12 μήνες. (Πίνακας 1).
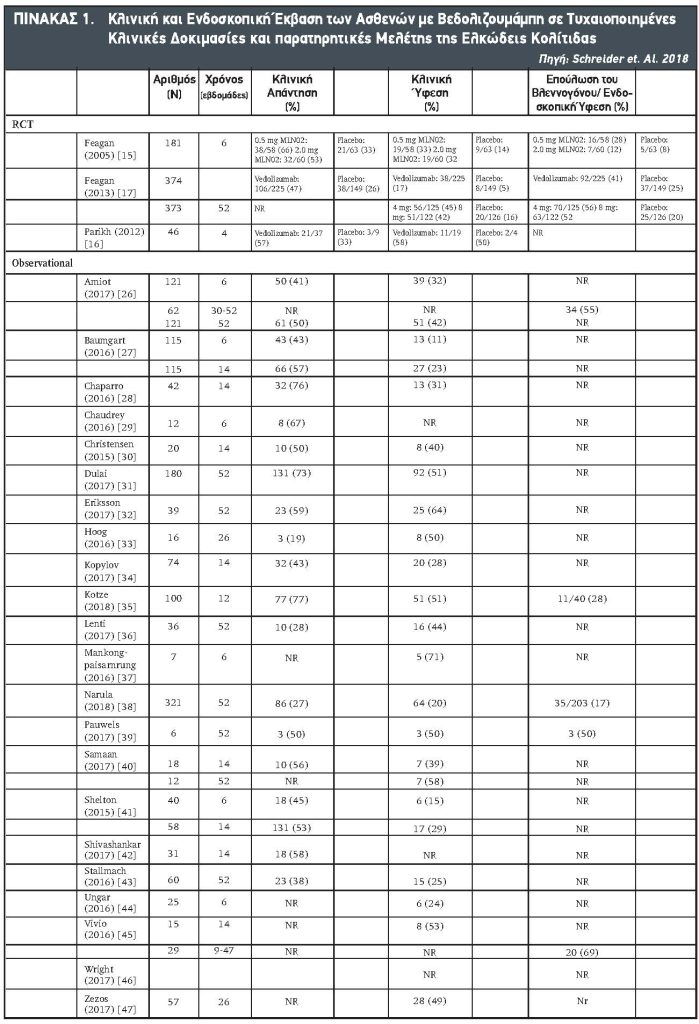
Σε μία άλλη open-label βεδολιζουμάμπη θεραπεία αναφέρθηκαν τα αποτελέσματα μιας πολυκεντρικής μελέτης στις ΗΠΑ (VICTORY: Vedolizumab for Health Outcomes in Inflammatory Bowel Disease) και η οποία περιλαμβάνει 321 ασθενείς με ΕΚ, οι περισσότεροι των οποίων (71%) είχαν λάβει προηγουμένως θεραπεία με TNFα ανταγωνιστή χωρίς επιτυχία. Οι αθροιστικές συχνότητες της κλινικής υφέσεως και ενδοσκοπικής υφέσεως ήταν 51% και 41%, αντιστοίχως. Οι αντίστοιχες συχνότητες για την ύφεση ελεύθερα κορτικοστεροειδών και βαθείας υφέσεως ήταν 37% και 30%, αντιστοίχως.25 Η πολυμεταβλητή ανάλυση, προ της εκθέσεως στον TNF ανταγωνιστή ήταν συνδυασμένη με ελαττωμένη πιθανότητα επιτεύξεως κλινικής υφέσεως και ενδοσκοπικής εφέσεως. Σοβαρά ανεπιθύμητα συμβάματα και σοβαρές λοιμώξεις αναφέρθηκαν στο 6% και 4% των ασθενών, αντιστοίχως. Οι ολικές αθροιστικές συχνότητες της κολεκτομής πέραν των 12 μηνών ήταν 13% με χαμηλότερες συχνότητες παρατηρηθείσες σε απλούς ασθενείς θεραπευθέντες με TNF ανταγωνιστή (2%) έναντι αυτών που έλαβαν TNF ανταγωνιστή (19%). Οι συγγραφείς συμπεραίνουν ότι η βεδολιζουμάμπη είναι καλώς ανεκτή και αποτελεσματική στην επίτευξη των κλινικών εκβάσεων.
Συμπέρασμα
Η βεδολιζουμάμπη είναι αποτελεσματική για την επαγωγή και διατήρηση της υφέσεως σε ασθενείς με ελκώδη κολίτιδα είτε ως θεραπεία πρώτης εκλογής ή μετά αποτυχία των άλλων παραγόντων. Η θεραπεία με βεδολιζουμάμπη είναι αποτελεσματική καθόσον επιτυγχάνεται μακράς διαρκείας κλινική απάντηση, κλινική ύφεση, κλινική ύφεση ελευθέρας κορτικοστεροειδών και επούλωση του βλεννογόνου σε ασθενείς με μέτρια έως σοβαρά ελκώδη κολίτιδα. Επίσης, τα υπάρχοντα δεδομένα υποστηρίζουν το θετικό μακράς διαρκείας οφέλους-κινδύνου προφίλ της βεδολιζουμάμπης για τη θεραπεία της ελκώδης κολίτιδας.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Moledocky NA, Soon IS, Rabi DM, et al. Increasing incidence and prevalence of the inflammatory bowel disease with time based on systematic review. Gastroenterology 2012; 142: e42-quize30.
- Matsuoka K, Kobayashi T, Ueno F, et al. Evidence-based clinical practice guidelines for inflammatory bowel disease. J Gastroenterol 2018; 53: 305-353.
- Ko CW, Singh S, Feuerstein JD, et al. American Gastroenterological Association Institute Clinical Guidelines Committee. AGA clinical practice guidelines of the management of mild-to-moderate ulcerative colitis. Gastroenterology 2019; 156: 748-764.
- Rubin DT, Ananthakrishan AN, Siegel CA, et al. ACG clinical guidelines: ulcerative colitis in adults. Am J Gastroenterol 201; 114: 384-413.
- Trulove SC, Witts LJ. Cortisone in ulcerative colitis; final report on a therapeutic trial. BMJ; 1955: 2: 1041-1048.
- Schroeder KW, Tremaine WJ, Ilstrup DM. Coated oral 5-aminosalycilic acid therapy for mild to moderate active ulcerative colitis. A randomized study. N Engl J Med 1987; 317: 1625-1629.
- Peppercorn MA, Kane SV. Clinical manifestations, diagnosis, and prognosis of ulcerative colitis in adults. UpToDate Jan 2020.
- Ford AC, Sandborn WJ, Khan KJ, et al. Efficacy of biological therapies in inflammatory bowel disease: a systematic review and meta-analysis. Am J Gastroenterol 2011; 106: 644-659.
- Sandborn WJ, vanAssche G, Reinisch W, et al. Adalimumab induces and maintains clinical remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2012; 142: 257-265.
- Scribano ML. Vedolizumab for inflammatory bowel disease: From randomized control trials to real-life evidence. World J Gastroenterol 2018; 24: 2457-2467.
- Cominelli F. Inhibition of leukocyte trafficking in inflammatory bowel disease. N Engl J Med 2013; 369: 775-776.
- Rath T, Billmeier U, Ferrazzi F, et al. Effects of anti-integrin therapy treatment with vedolizumab on immune pathways and cytokines in inflammatory bowel diseases. Front Immunol 2018; 9: doi:10.3389/fimmun.2018.011700.
- Rosario M, Dirks N, Milch C, et al. A review of the clinical pharmacokinetics, pharmacodynamics, and immunogenicity of vedolizumab. Pharmacokinet 2017; 56: 1287-1301.
- Feagan BG, McDonald J, Greenberg G, et al. An ascending dose trial of a humanized A4B7 antibody in ulcerative colitis (UC). Gastroenterolgy 2000; 118(4): A847.
- Feagan BG, Greenberg G, Wild G, et al. Treatment of ulcerative colitis with humanized antibody a4β7 intergrin. N Engl J Med 2005; 352: 2499-2507.
- Parikh A, Leach T, Wyant T, et al. Vedolizumab for the treatment of active ulcerative colitis: a randomized controlled trial Phase 2 dose-ranging study. Inflamm Bowel Dis 2012; 18: 1470-1479.
- Parikh A, Fox I, Leath T, et al. Long-term clinical experience with vedolizumab in patients with inflammatory bowel disease. Inflamm Bowel Dis 2013; 19: 1691-1699.
- Feagan BG, Rutgeerts P, Sands BE, et al. Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2013; 369: 699-710.
- Loftus EV, Colombel JF, Feagan BG, et al. Long-term effectiveness and safety of vedolizumab in patients with ulcerative colitis: 5-year commulative exposure of GEMINI 1 completers rolling into the GEMINI open-label extension study. Gastroenterology 2017; 152(5): S602. Doi:10.1016/s0016-5085(17)32150-9.
- Motoya S, Watanabe K, Ogata H, et al. Vedolizumab in Japanese patients with ulcerative colitis: A phase 3, randomized, double-blind, placebo-controlled study. PlosOne 2019; 11: 14(4): e0215491. doi:10.1371/journal.pone.0215491.
- Sands BE, Peyrin-Biroulet L, Loftus EV, et al. Vedolizumab and adalimumab for moderate-to-severe ulcerative colitis. N Engl J Med 2019; 381: 1215-1226.
- Battat R, Ma O, Jairath V, et al. Benefit-risk assessment of vedolizumab in the treatment of Crohn; s disease and ulcerative colitis. Drug Safety 2019; 4: 617-632.
- Takatsu N, Hisabe T, Higash D, et al. Vedolizumab in the treatment of ulcerative colitis: An evidence-based review of safety, efficacy, and place of therapy. Core Evidence 2020; 15: 7-0.
- Schreider S, Dignass A, Peyrin0Biroulet L, et al. Systematic review and meta-analysis: real world effectiveness and safety of vedolizumab in patients with inflammatory bowel disease. J Gastroenterol 2018; 53: 1048-1064.
- Natura M, Peerani F, Meseve J, et al. Vedolizumab for ulcerative colitis: treatment outcomes from the VICTORY consortium. Am J Gastroenterol 2018; 113: 1345-1354.










Άφησε σχόλιο