Περίληψη
Οι νεφροί έχουν καίριο ρόλο όχι μόνον για τη διήθηση, την αποβολή και τhν κάθαρση του πλάσματος από άχρηστες, βλαβερές ή τοξικές ουσίες, αλλά και με την σημαντική ρυθμιστική δράση επί του όγκου και της συστάσεως των υγρών του οργανισμού, συμβάλλοντας στον ομοιοστατικό έλεγχο του εσωτερικού περιβάλλοντος. Ένας βασικός μηχανισμός επίτευξης αυτού του στόχου είναι και το Σύστημα Ρενίνης – Αγγειοτενσίνης – Αλδοστερόνης (Renin – Angiotensin – Aldosterone System, RAAS), το οποίο είναι ένα βασικότατο σύστημα ορμονικού ελέγχου και ρύθμισης της αρτηριακής πίεσης καθώς και της ομοιόστασης ιόντων και ύδατος στον ανθρώπινο οργανισμό. Συνιστά μια άλυσο διαδοχικής έκκρισης και ενεργοποίησης ενζύμων και ορμονών όπου η καθεμία ουσία προκαλεί την έκκριση ή την ενεργοποίηση του επόμενου κρίκου της αλύσου. Η δυσλειτουργία του συστήματος Ρενίνης – Αγγειοτενσίνης – Αλδοστερόνης παίζει ουσιώδη ρόλο στην παθογένεση της αρτηριακής υπέρτασης αλλά και των σχετιζόμενων καρδιαγγειακών και νεφρικών διαταραχών, γι’ αυτό και έχει αποτελέσει βασικό στόχο φαρμακευτικών θεραπευτικών παρεμβάσεων.
Renin – Angiotensin – Aldosterone System
Bakas Dimitrios
Ophthalmology Clinic, General Hospital of Edessa
Abstract
Kidneys play a key role not only in the filtration, elimination and purification of plasma from wasteful, harmful or toxic substances, but also with the significant regulatory effect on the volume and composition of body fluids, contributing to the homeostatic control of the interior environment. A key mechanism for achieving this goal is the Renin – Angiotensin – Aldosterone System (RAAS), which is a basic hormonal control and regulation system for blood pressure and ion and water homeostasis in the human body. It constitutes a chain of sequential secretion and activation of enzymes and hormones where each substance causes the secretion or activation of the next link in the chain. Dysfunction of the Renin-Angiotensin-Aldosterone system plays an essential role in the pathogenesis of arterial hypertension as well as related cardiovascular and renal disorders, so it has been a key goal of pharmaceutical therapeutic interventions.
Εισαγωγή
Οι νεφροί έχουν καίριο ρόλο όχι μόνον για τη διήθηση, την αποβολή και την κάθαρση του πλάσματος από άχρηστες, βλαβερές ή τοξικές ουσίες, αλλά και με την σημαντική ρυθμιστική δράση επί του όγκου και της συστάσεως των υγρών του οργανισμού, συμβάλλοντας στον ομοιοστατικό έλεγχο του εσωτερικού περιβάλλοντος. Ένας βασικός μηχανισμός επίτευξης αυτού του στόχου είναι και το Σύστημα Ρενίνης – Αγγειοτενσίνης – Αλδοστερόνης (Renin – Angiotensin – Aldosterone System, RAAS), το οποίο είναι ένα βασικότατο σύστημα ορμονικού ελέγχου και ρύθμισης της αρτηριακής πίεσης καθώς και της ομοιόστασης ιόντων και ύδατος στον ανθρώπινο οργανισμό. Συνιστά μια άλυσο διαδοχικής έκκρισης και ενεργοποίησης ενζύμων και ορμονών όπου η καθεμία ουσία προκαλεί την έκκριση ή την ενεργοποίηση του επόμενου κρίκου της αλύσου. Η δυσλειτουργία του συστήματος Ρενίνης – Αγγειοτενσίνης – Αλδοστερόνης παίζει ουσιώδη ρόλο στην παθογένεση της αρτηριακής υπέρτασης αλλά και των σχετιζόμενων καρδιαγγειακών και νεφρικών διαταραχών, γι’ αυτό και έχει αποτελέσει βασικό στόχο φαρμακευτικών θεραπευτικών παρεμβάσεων.
Συστατικά Στοιχεία και Λειτουργία του Συστήματος
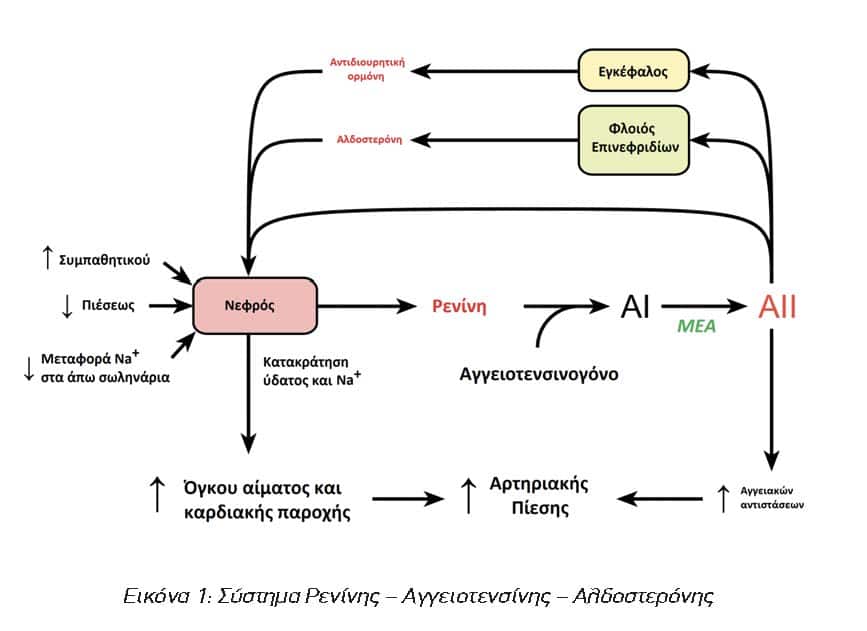
Η διαδικασία άρχεται με την έκκριση της ρενίνης από τους νεφρούς. Η κύρια θέση του σχηματισμού της ρενίνης στους νεφρούς είναι τα κύτταρα της παρασπειραματικής συσκευής στο τοίχωμα των προσαγωγών αρτηριδίων του σπειράματος του νεφρώνα. Η απελευθέρωση ρενίνης διεγείρεται από μειωμένη διήθηση νατρίου (δηλαδή μειωμένη συγκέντρωση του νατρίου του πλάσματος ή μειωμένη πραγματική σπειραματική διήθηση), μειωμένη πίεση στο προσαγωγό αρτηρίδιο (μειωμένο εξωκυττάριο υγρό και όγκο αίματος, μειωμένη αρτηριακή πίεση) και αυξημένη δραστηριότητα του συμπαθητικού νευρικού συστήματος.1,2 Η ρενίνη είναι μία πρωτεάση η οποία καταλύει τη μετατροπή στο πλάσμα του αγγειοτενσινογόνου σε αγγειοτενσίνη Ι. Το αγγειοτενσινογόνο είναι μία α2-σφαιρίνη που παράγεται κατά κύριο λόγο στο ήπαρ. Η αγγειοτενσίνη Ι εν συνεχεία μετατρέπεται με την καταλυτική δράση του μετατρεπτικού ενζύμου της αγγειοτενσίνης στην επιφάνεια του ενδοθηλίου των αγγείων σε αγγειοτενσίνη ΙΙ. Το μετατρεπτικό ένζυμο της αγγειοτενσίνης ευρίσκεται στα ενδοθηλιακά κύτταρα των αιμοφόρων αγγείων, αφθονεί στα αγγεία του πνεύμονα αλλά υπάρχει και σε αγγεία άλλων οργάνων, συμπεριλαμβανομένων και των νεφρών.2 Η αγγειοτενσίνη ΙΙ είναι μια ισχυρά δραστική ουσία που αυξάνει την αρτηριακή πίεση μέσω αγγειοσύσπασης και συνεπώς αύξησης των περιφερικών αντιστάσεων, αύξησης του εξωκυττάριου όγκου μέσω διέγερσης εκκρίσεως της αντιδιουρητικής ορμόνης και ενεργοποίησης της πρόσληψης νερού ενεργοποιώντας το αίσθημα της δίψας, και τέλος ευοδώνει την επαναρρόφηση ιόντων νατρίου μέσω διέγερσης της έκκρισης της αλδοστερόνης.1,2,3 Η αλδοστερόνη είναι μια στεροειδής ορμόνη που παράγεται στη σπειροειδή ζώνη (zona glomerulosa) του φλοιού των επινεφριδίων. Βασικά ερεθίσματα για την έκκρισή της είναι η αγγειοτενσίνη ΙΙ, η εξωκυττάρια συγκέντρωση ιόντων καλίου και η φλοιοτρόπος ορμόνη (Adrenocorticotropic hormone, ACTH.4 Η αλδοστερόνη δρα στα άπω εσπειραμμένα και τα αθροιστικά σωληνάρια των νεφρών προάγοντας την επαναρρόφηση νατρίου, την απέκκριση καλίου και οδηγώντας εν τέλει σε αύξηση του εξωκυττάριου όγκου και επομένως αύξηση της αρτηριακής πίεσης. Στην εικόνα 1 φαίνεται σχηματικά ο κύκλος των αντιδράσεων από την έκκριση της ρενίνης μέχρι την τελική δράση της αλδοστερόνης.
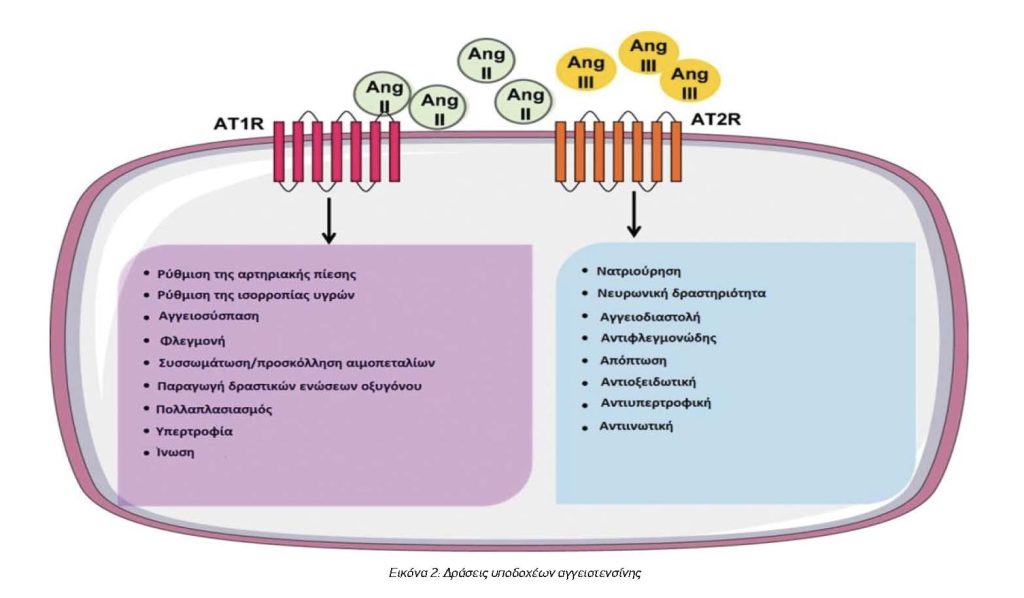
Η αγγειοτενσίνη ΙΙ δρα συνδεόμενη σε δύο τύπους μεμβρανικών υποδοχέων: τους υποδοχείς τύπου 1 (Angiotensin II type 1 receptor, AT1R) και τύπου 2 (Angiotensin II type 2 receptor, AT2R). Στου δύο αυτούς υποδοχείς εκτός της αγγειοτενσίνης ΙΙ συνδέονται και άλλα πεπτίδια που παράγονται από τον μεταβολισμό της αγγειοτενσίνης Ι, όπως επί παραδείγματι η αγγειοτενσίνη ΙΙΙ, η αγγειοτενσίνη ΙV, η αγγειοτενσίνη (1-7). Η αγγειοτενσίνη ΙΙ συνδέεται και με τους δύο τύπους υποδοχέων, ενώ τα υπόλοιπα πεπτίδια φαίνεται να έχουν μεγαλύτερη συγγένεια με τους υποδοχείς τύπου 2 (AT2R), αλλά ασθενέστερη δράση από την αγγειοτενσίνη ΙΙ. Οι κύριες δράσεις της αγγειοτενσίνης ΙΙ, δηλαδή η αγγειοσύσπαση, η αύξηση της επαναρρόφησης ιόντων νατρίου και ύδατος στα νεφρικά σωληνάρια και η διέγερση της έκκρισης αλδοστερόνης και αντιδιουρητικής ορμόνης επιτυγχάνονται μέσω της σύνδεσης με τους υποδοχείς τύπου 1 (AT1R). Οι υποδοχείς τύπου 2 (AT2R) φαίνεται ότι έχουν τις αντίθετες δράσεις, δηλαδή προκαλούν αύξηση της αποβολής νατρίου στα ούρα και διαστολή των αγγείων, ενώ αναστέλλουν και την έκκριση ρενίνης από τους νεφρούς.5,6 Στην εικόνα 2 μπορούμε να δούμε το σύνολο των δράσεων των 2 τύπων υποδοχέων.
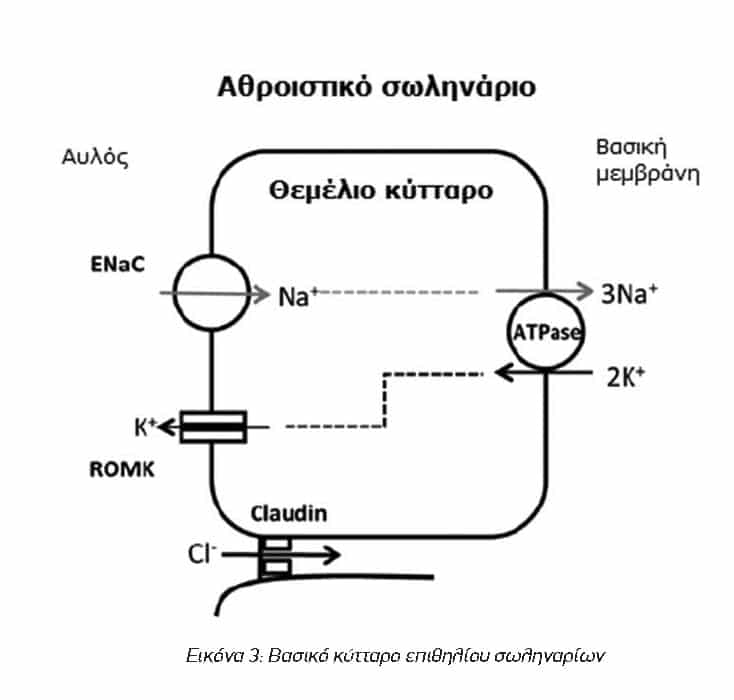
Η κύρια επίδραση της αλδοστερόνης είναι στα βασικά κύτταρα του επιθηλίου των απώτερων τμημάτων του νεφρώνα (άπω εσπειραμμένα και αθροιστικά σωληνάρια). Η αλδοστερόνη συνδέεται με τον υποδοχέα αλατοκορτικοειδών (Mineralocorticoid receptor, MR) και το σύμπλεγμα που δημιουργείται μετακινείται στον πυρήνα του κυττάρου, όπου επάγει τη μεταγραφή γονιδίων και την αύξηση του αριθμού συγκεκριμένων μεμβρανικών πρωτεϊνών μεταφοράς ιόντων. Στην πραγματικότητα το μεγαλύτερο μέρος της αύξησης μεταφοράς Na+, που οφείλεται στην αλδοστερόνη, προκαλείται από τα ταχέως διεγερθέντα γονίδια που κωδικοποιούν τις ρυθμιστικές πρωτεΐνες. Η πιο χαρακτηριστική ρυθμιστική πρωτεΐνη είναι η κινάση σερίνης-θρεονίνης (SGK1) η οποία ρυθμίζεται και από άλλες ορμόνες όπως η ινσουλίνη και η αγγειοτενσίνη ΙΙ. Οι γονιδιακές αυτές διαδικασίες που προκαλούνται από την αλδοστερόνη, προωθούν τελικά την νεφρική επαναπρόσληψη Na+ από τα άπω εσπειραμένα και τα αθροιστικά σωληνάρια με αποτέλεσμα την αύξηση του όγκου υγρών και της αρτηριακής πίεσης. Πιο συγκεκριμένα, αλδοστερόνη αυξάνει τους επιθηλιακούς διαύλους Νατρίου (Epithelial sodium channel, ENaC) στην πλευρά του κυττάρου προς τον αυλό των σωληναρίων που επαναρροφούν ιόντα νατρίου από το διήθημα προς το εσωτερικό του κυττάρου, αυξάνει τους διαύλους καλίου (Renal outer medullary potassium channel, ROMK) στην πλευρά του κυττάρου προς τον αυλό που απεκκρίνουν ιόντα καλίου από το εσωτερικό του κυττάρου προς το διήθημα, και επίσης αυξάνει τη δράση της αντλίας ιόντων Na+/K+ (Na+-K+-ATPase) στην πλευρά του κυττάρου προς τη βασική μεμβράνη, που εξάγει ιόντα νατρίου και εισάγει ιόντα καλίου στο κύτταρο. Λόγω ηλεκτροστατικών δυνάμεων συντελείται και παθητική επαναρρόφηση ιόντων χλωρίου Cl–, ενώ ωσμωτικές δυνάμεις ευνοούν την επαναρρόφηση ύδατος από το διήθημα διαμέσου των μεμβρανικών υδατοπορινών (Aquaporins, AQP) που υπόκεινται στον ορμονικό έλεγχο της αντιδιουρητικής ορμόνης ή βαζοπρεσσίνης (Antidiuretic hormone, ADH ή Vasopressin, AVP). Το τελικό συνολικό αποτέλεσμα είναι η επαναρρόφηση ιόντων νατρίου, χλωρίου και ύδατος και η απέκκριση ιόντων καλίο.4,7 Στην εικόνα 3 μπορούμε να δούμε σχηματικά την ανταλλαγή ιόντων στο βασικό κύτταρο του επιθηλίου των σωληναρίων.
Φαρμακευτική Αναστολή
Το σύστημα Ρενίνης – Αγγειοτενσίνης – Αλδοστερόνης παίζει ουσιώδη ρόλο στην παθογένεση της αρτηριακής υπέρτασης αλλά και των σχετιζόμενων καρδιαγγειακών και νεφρικών διαταραχών, γι’ αυτό και έχει αποτελέσει βασικό στόχο φαρμακευτικών θεραπευτικών παρεμβάσεων. Οι χημικές ουσίες που αναστέλλουν στοιχεία του συστήματος ενδείκνυνται επί του παρόντος για τη θεραπεία της αρτηριακής υπέρτασης, της διαβητικής νεφροπάθειας, της μετεμφραγματικής δυσλειτουργίας της αριστερής κοιλίας και της χρόνιας καρδιακής ανεπάρκειας και η χρήση τους έχει αποδειχθεί ότι σχετίζεται με βελτιωμένη επιβίωση και σημαντικά καρδιαγγειακά και νεφρικά οφέλη σε ασθενείς υψηλού κινδύνου.8
Αναστολείς Μετατρεπτικού ενζύμου Αγγειοτενσίνης (α-ΜΕΑ) ή Angiotensin-Converting Enzyme Inhibitors (ACEIs)
Οι α-ΜΕΑ αναστέλλουν ανταγωνιστικά τη δράση του μετατρεπτικού ενζύμου Αγγειοτενσίνης και συνεπώς τη μετατροπή της αγγειοτενσίνης Ι σε αγγειοτενσίνη II, μειώνοντας έτσι την κυκλοφορία και τα τοπικά επίπεδα της αγγειοτενσίνης ΙΙ. Οι α-ΜΕΑ μειώνουν επίσης την αλδοστερόνη και την έκκριση βαζοπρεσσίνης και τη δραστηριότητα των συμπαθητικών νεύρων. Η θεραπεία με α-ΜΕΑ είναι γενικά καλά ανεκτή από τους περισσότερους ασθενείς εντούτοις συνδέεται με ορισμένες σημαντικές παρενέργειες, συχνότερη μεταξύ των οποίων είναι ο ξηρός βήχας. Γνωστές φαρμακευτικές ουσίες της κατηγορίας είναι οι καπτοπρίλη, εναλαπρίλη, λισινοπρίλη, βεναζεπρίλη, κιναπρίλη, ραμιπρίλη, περινδοπρίλη, σιλαζαπρίλη, τρανδολαπρίλη.8
Ανταγωνιστές υποδοχέων αγγειοτενσίνης ΙΙ ή Angiotensin Receptor Blockers (ARBs)
Τα φάρμακα της κατηγορίας αυτής αναστέλλουν τη δράση της αγγειοτενσίνης ΙΙ στο επίπεδο του υποδοχέα, ανταγωνιζόμενα ειδικά τη δράση της αγγειοτενσίνης ΙΙ στον υποδοχέα AT1R. Η θεραπεία γενικά καλά ανεκτή, ακόμη και σε πολλούς ασθενείς που διακόπτουν τη θεραπεία με α-ΜΕΑ λόγω παρενεργειών. Όπως και οι α-ΜΕΑ, η χρήση τους αντενδείκνυται σε έγκυες γυναίκες λόγω της συσχέτισης του αποκλεισμού του συστήματος Ρενίνης – Αγγειοτενσίνης – Αλδοστερόνης με αυξημένη νοσηρότητα και θνησιμότητα του εμβρύου, ιδιαίτερα με έκθεση κατά το δεύτερο και τρίτο τρίμηνο. Γνωστές φαρμακευτικές ουσίες της κατηγορίας είναι οι βαλσαρτάνη, επροσαρτάνη, ιρβεσαρτάνη, κανδεσαρτάνη, λοσαρτάνη, ολμεσαρτάνη, τελμισαρτάνη.8
Αναστολείς ρενίνης ή Direct Renin Inhibitors
Η πιο πρόσφατη κατηγορία παραγόντων που αναστέλλουν το σύστημα Ρενίνης – Αγγειοτενσίνης – Αλδοστερόνης είναι οι άμεσοι αναστολείς ρενίνης με κύριο εκπρόσωπο την αλισκιρένη. Αυτή η ουσία διαφέρει από τις άλλες στο ότι, εμποδίζοντας την καταλυτική δραστικότητα της ρενίνης στο σημείο ενεργοποίησης του συστήματος Ρενίνης – Αγγειοτενσίνης – Αλδοστερόνης, εμποδίζει τη σύνθεση όλων των πεπτιδίων της αγγειοτενσίνης και αποτρέπει την αντισταθμιστική αύξηση της δραστηριότητας της ρενίνης.8
Μελλοντικές Κατευθύνσεις
Η κλινική δυνατότητα της ταυτόχρονης παρέμβασης σε πολλές θέσεις του συστήματος Ρενίνης – Αγγειοτενσίνης – Αλδοστερόνης είναι μια θελκτική σκέψη. Όπως έχει ήδη αποδειχθεί σε μικρές κλινικές δοκιμές, ο διπλός αποκλεισμός του συστήματος που χρησιμοποιεί συνδυασμό αναστολέων μετατρεπτικού ενζύμου αγγειοτενσίνης και αναστολείς υποδοχέων αγγειοτενσίνης μπορεί να έχει δυνητική κλινική αξία σε συμπτωματικούς ασθενείς με συμφορητική καρδιακή ανεπάρκεια ή συστολική δυσλειτουργία της αριστερής κοιλίας και σε ασθενείς με χρόνια πρωτεϊνουρική νεφρική νόσο. Τα αποτελέσματα που λαμβάνονται με αυτήν την προσέγγιση ενδέχεται να κατευθύνουν τους ερευνητές να διερευνήσουν επιπρόσθετους θεραπευτικούς στόχους στο μέλλον, όπως αναστολή άλλων υπότυπων υποδοχέων αγγειοτενσίνης, ή άλλα πεπτίδια αγγειοτενσίνης (π.χ. αγγειοτενσίνη III, αγγειοτενσίνη IV και αγγειοτενσίνη -(1-7)). Τέλος, η πιθανότητα μοριακών προσεγγίσεων όπως η γονιδιακή θεραπεία, με στόχευση τη ρενίνη, το αγγειοτενσινογόνο, ο υποδοχέας AT1R, πιθανότατα θα διερευνηθεί στο όχι και τόσο μακρινό μέλλον.8
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Μολυβδάς, Π, Γουργουλιάνης, Κ, Χατζηευθυμίου Α. Συνοπτική Φυσιολογία του Ανθρώπου με ερωτήσεις αυτοαξιολόγησης. Αθήνα: Ιατρικές εκδόσεις Π.Χ. Πασχαλίδης.
- Navar LG. Physiology: hemodynamics, endothelial function, renin-angiotensin-aldosterone system, sympathetic nervous system. J Am Soc Hypertens. 2014;8:519–524. DOI: 10.1016/j.jash.2014.05.014.
- Sparks MA, Crowley SD, Gurley SB, et al. Classical Renin-Angiotensin System in Kidney Physiology. Comprehensive Physiology. 2014;4(3):1201-1228. DOI:10.1002/cphy.c130040.
- Luuk te Riet, Joep H.M. van Esch, et al. Hypertension: Renin-Angiotensin-Aldosterone System Alterations. Circ Res. 2015; 116:960-975. DOI: 10.1161/CIRCRESAHA.116.303587
- Padia SH, Carey RM. AT2 Receptors: beneficial counter-regulatory role in cardiovascular and renal function. Pflugers Archiv: European journal of physiology. 2013;465(1):99-110. DOI:10.1007/s00424-012-1146-3.
- Matavelli LC, Siragy HM. AT2 Receptor activities and pathophysiological implications. Journal of cardiovascular pharmacology. 2015; 65(3):226-232. DOI:10.1097/FJC.0000000000000208.
- Pearce D, Soundararajan R, Trimpert C, et al. Collecting Duct Principal Cell Transport Processes and Their Regulation. Clinical Journal of the American Society of Nephrology: CJASN. 2015; 10(1):135-146. DOI:10.2215/CJN.05760513.
- Atlas SA. The renin-angiotensin aldosterone system: pathophysiological role and pharmacologic inhibition. J Manag Care Pharm. 2007;13(8 Suppl B):9-20. DOI:10.18553/jmcp.2007.13.s8-b.9.










Άφησε σχόλιο