Την τελευταία δεκαετία έχουν συμβεί σημαντικές αλλαγές στα κριτήρια διάγνωσης, τη σταδιοποίηση και τη θεραπευτική του πολλαπλού μυελώματος. Το πολλαπλούν μυέλωμα είναι μια αιματολογική κακοήθεια που ανήκει στις πλασματοκυτταρικες δυσκρασίες και αποτελεί το 10% όλων των αιματολογικών νεοπλασιών. Στην Ελλάδα κάθε χρόνο έχουμε περίπου 400 με 500 νέες διαγνώσεις. Είναι νόσος των ηλικιωμένων, με μέση ηλικία διάγνωσης τα 72 έτη.
Η αιτιολογία του είναι άγνωστη και προδιαθεσικούς παράγοντες αποτελούν το άρρεν φύλο, η αφρο-αμερικανική καταγωγή και η αγροκτηνοτροφική εργασία (έκθεση σε λοιμώξεις ζώων και φυτοφάρμακα). Οφείλεται στην ανεξέλεγκτη ανάπτυξη ενός κλώνου πλασματοκυττάρων, τα οποία, με εξαίρεση το μη-εκκριτικό μυέλωμα, συνθέτουν και εκκρίνουν μια μονοκλωνική ανοσοσφαιρίνη στο αίμα, η οποία ονομάζεται παραπρωτείνη. Τα κλωνικά πλασματοκύτταρα ανευρίσκονται διάσπαρτα στο μυελό των οστών, ωστόσο, μπορεί να δημιουργήσουν και διακριτές μάζες που ονομάζονται πλασμοκυττώματα.
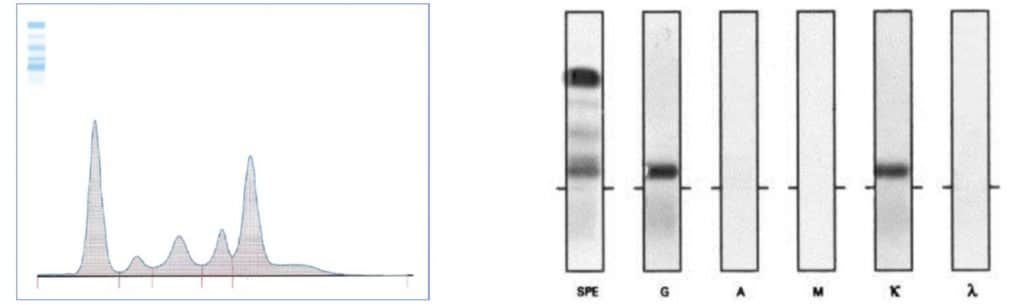
Σχεδόν σε όλους τους ασθενείς προηγείται μια φάση χωρίς συμπτώματα που λέγεται «μονοκλωνική γαμμαπάθεια αδιευκρίνιστης σημασίας» ή MGUS. Αυτή η πρόδρομος φάση του MGUS συχνά βρίσκεται τυχαία μετά από εργαστηριακό έλεγχο. Για κάθε τέτοια περίπτωση υπάρχει 1% πιθανότητα κάθε χρόνο εξέλιξης σε μυέλωμα. Η συχνότητά της είναι 3,2 έως 3,5% σε άτομα άνω των 50 ετών. Η μονοκλωνική γαμμαπάθεια διαγιγνώσκεται με την ανάδειξη στην ηλεκτροφόρηση πρωτεϊνών στο αίμα ή στα ούρα μιας ανώμαλης αιχμής και επιβεβαιώνεται με την τυποποίηση της μονοκλωνικής μπάντας σε ανοσοηλεκτροφόρηση ή ανοσοκαθήλωση (εικόνα 1). Παραπρωτεϊναιμία μπορεί να συνοδεύει και μη αιματολογικά νοσήματα, όπως νοσήματα του κολλαγόνου και νευροπάθειες. Συχνότερα είναι το IgG-MGUS (70%), ακολουθούμενο από το IgM (10-20%), IgA (10-17%) και σπανιότερα το δικλωνικό ή το MGUS ελαφρών αλύσεων. Το MGUS μεταπίπτει σε πολλαπλούν μυέλωμα όταν συμβεί βλάβη οργάνου ή όταν αυξηθεί το “φορτίο” του πράγμα που φαίνεται από συγκεκριμένους βιοδείκτες.
Ανάμεσα στο MGUS και στην εκδηλωμένη, με συμπτώματα νόσο, βρίσκουμε το ασυμπτωματικό μυέλωμα (“smoldering myeloma”). Πρόκειται για περιπτώσεις στις οποίες είτε ο μυελός έχει ≥10% πλασματοκύτταρα ή η παραπρωτεΐνη ποσοτικά είναι μεγαλύτερη από 3g/dl με την προϋπόθεση ότι ΔΕΝ υπάρχουν καθόλου βλάβες οργάνων-στόχων(1). Η συχνότητα με την οποία η νόσος μπορεί να εξελιχθεί σε συμπτωματικό πολλαπλούν μυέλωμα σύμφωνα με τους Kyle και συν(2) είναι μεγαλύτερη σε σχέση με το MGUS, με ετήσια (αθροιστική) πιθανότητα 10% τα πρώτα 5 έτη, 3% τα επόμενα 5 και 1% ετησίως μετά τα 10 έτη. Ο κίνδυνος είναι μικρότερος σε ασθενείς με λιγότερα από 10% πλασματοκύτταρα, με non-IgA τύπο, με φυσιολογικές τις άλλες ανοσοσφαιρίνες και χωρίς παραπρωτεΐνη στα ούρα.
Συμπτώματα
Το πολλαπλούν μυέλωμα παρουσιάζεται πολύ συχνά ως οσφυαλγία ή με ένα αυτόματο κάταγμα και μάλιστα η διάγνωσή μπορεί να καθυστερήσει αν θεωρηθεί ως ένα συνηθισμένο ορθοπαιδικό πρόβλημα. Κλασικές εκδηλώσεις του είναι οι παρακάτω:
- Αναιμία
- Οστεολύσεις ή κατάγματα ή οστεοπόρωση
- Νεφρική ανεπάρκεια
- Υψηλό ασβέστιο αίματος
- Σπανιότερα: σ. υπεργλοιότητας, αμυλοείδωση
Απαραίτητο για τη διάγνωση είναι το μυελόγραμμα και/η οστεομυελική βιοψία στα οποία βρίσκουμε αυξημένο αριθμό πλασματοκυττάρων.
Πρόγνωση
Για την πρόγνωση της νόσου και το σχεδιασμό της θεραπείας χρησιμοποιείται το διεθνές σύστημα σταδιοποίησης R-ISS. Για τον υπολογισμό του σταδίου κατά ISS χρησιμοποιούνται 2 παράμετροι: η β2-μικροσφαιρίνη και η λευκωματίνη του ορού. Προκύπτουν 3 στάδια: Ι,ΙΙ,ΙΙΙ. Στο revised ISS (R-ISS) ενσωματώνονται και τα αποτελέσματα του κυτταρογενετικού ελέγχου μετά από εξέταση δείγματος μυελού με iFISH [del(17p) , t(4;14) , t(14;16)] και της LDH ορού, οπότε και πάλι προκύπτουν 3 στάδια κινδύνου, τα οποία αντανακλούν σε συνολικό χρόνο επιβίωσης(3). Σύμφωνα με το αμερικάνικο σύστημα σταδιοποίησης της Mayo Clinic (mSMART 3) οι ασθενείς διακρίνονται σε υψηλού και σταθερού κινδύνου, ανάλογα κυρίως με τις κυτταρογενετικές ανωμαλίες που φέρουν(4). Υψηλού κινδύνου θεωρούνται τα: t(4;14) t(14;16) t(14;20), del 17p, p53 mutation, gain 1q, καθώς και το double ή triple hit μυέλωμα.
Θεραπεία
Τα τελευταία χρόνια, η θεραπεία του πολλαπλού μυελώματος παρουσιάζει αλματώδη εξέλιξη με την ανακάλυψη νέων παραγόντων που αυξάνουν κατά πολύ την επιβίωση. Παρόλη την πρόοδο όμως των τελευταίων 20 ετών, μόνο 10 με 15% των ασθενών επιτυγχάνουν επιβίωση ίση με την προβλεπόμενη για την ηλικία τους και η νόσος εξακολουθεί να θεωρείται ανίατη.
Σύμφωνα με το International Myeloma Working Group (IMWG) τα κριτήρια για τη διάγνωση ενεργού μυελώματος είναι(1):
Η ανεύρεση κλωνικών πλασματοκυττάρων στο μυελό σε ποσοστό > 10% ή πλασμοκυττώματος σε υλικό βιοψίας και ΕΠΙΠΛΕΟΝ οποιοδήποτε από τα παρακάτω (κριτήρια CRAB):
- Υπερασβεστιαιμία (>11mg/dL)
- Νεφρική ανεπάρκεια (κάθαρση <40ml/min ή κρεατινίνη >2g/dl)
- Αναιμία (αιμοσφαιρίνη κάτω από το κατώτερο όριο κατά τουλάχιστο 2g/l)
- Οστική νόσος με μια ή περισσότερες οστεολυτικές εστίες σε α/ες, CT, PET/CT (≥5mm) ή ΔΥΟ ή περισσότερες εστιακές αλλοιώσεις σε MRI ΣΣ (≥5mm)
- Βιοδείκτες όπως ≥ 60% πλασματοκύτταρα στο μυελό, λόγος ελαφρών αλυσίδων εμπλεκόμενων προς μη εμπλεκόμενες (FLC) ≥100 με την προϋπόθεση ότι η παθολογική αλυσίδα είναι τουλάχιστον 100mg/L
Όπου είναι εφικτό, για την απεικόνιση και τον εντοπισμό της οστικής νόσου προτιμώνται οι νεότερες μέθοδοι της χαμηλής δόσης ολοσωματικής αξονικής τομογραφίας και του PET/CT. Οποιοδήποτε από τα κριτήρια 1-5 βρεθεί θετικό, σηματοδοτεί την ανάγκη για έναρξη θεραπείας.
Πριν από 35 χρόνια, τα μόνα διαθέσιμα φάρμακα ήταν οι αλκυλιωτικοί παράγοντες και τα κορτικοειδή τα οποία δεν άλλαζαν ιδιαίτερα την πορεία της νόσου. Η εισαγωγή της αυτόλογης μεταμόσχευσης αρχέγονων αιμοποιητικών κυττάρων τη δεκαετία του ’90 με την πρωτοποριακή μελέτη του Intergroupe Francophone du Myélome(5) ήταν το πρώτο μεγάλο βήμα στην αύξηση της επιβίωσης, ενώ η στοχευμένη θεραπεία ξεκινά από τα μέσα της δεκαετίας του 2000.
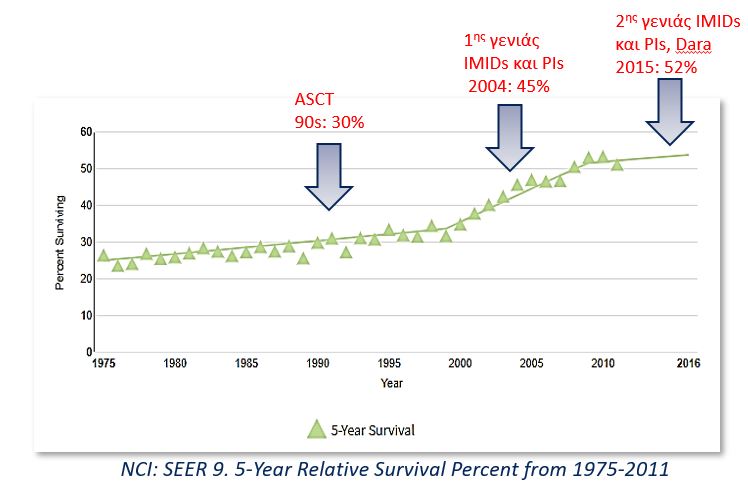
Οι κύριες κατηγορίες φαρμάκων που χρησιμοποιούνται αυτή τη στιγμή είναι: 1) τα ανοσοτροποποιητικά [IMIDS: θαλιδομίδη (T), λεναλιδομίδη (R), πομαλιδομίδη], 2) οι αναστολείς του πρωτεασώματος [PIs: βορτεζομίδη (V), καρφιλζομίδη, ιξαζομίδη], 3) τα μονοκλωνικά αντισώματα (νταρατούμουμαμπ, ισατούξιμαμπ, ελοτούζουμαμπ, μπελάνταμαμπ), 4) χημειοθεραπευτικά όπως η κυκλοφωσφαμίδη, η δοξορουμπικίνη, η μπενταμουστίνη και η μελφαλάνη και 5) κυτταρικές θεραπείες (αυτόλογη μεταμόσχευση αιμοποιητικών κυττάρων, αλλογενής μεταμόσχευση και CAR-T cells). Σχεδόν πάντα στο συνδυασμό φαρμάκων εντάσσεται και η κορτιζόνη. Τα περισσότερα σχήματα αποτελούν συνδυασμούς φαρμάκων «στοχευμένης» θεραπείας. Στην Εικόνα 2 φαίνεται η αύξηση της πενταετούς επιβίωσης των ασθενών με ΠΜ ανάλογα με τη δεκαετία διάγνωσης, λόγω της εισαγωγής των νέων φαρμάκων.
Το ασυμπτωματικό μυέλωμα (ΑΜ) μπορεί να διακριθεί σε χαμηλού, ενδιάμεσου και υψηλού κινδύνου ανάλογα με την ποσότητα της παραπρωτεΐνης, το FLC και το ποσοστό των πλασματοκυττάρων στο μυελό (ο κανόνας του 20-20-20)(6). Γενικά, δε χρειάζεται θεραπεία, αλλά μόνο παρακολούθηση, «watch and wait», κάθε 2-3 μήνες το πρώτο έτος. Αν τα αποτελέσματα είναι σταθερά, η παρακολούθηση συνεχίζεται κάθε 6 μήνες. Οι ασθενείς με υψηλού κινδύνου ΑΜ, έχουν 50% πιθανότητα εξέλιξης σε συμπτωματικό μυέλωμα στα επόμενα 2 έτη και αν τους δίνεται η δυνατότητα μπορούν να ενταχθούν σε μια από τις κλινικές μελέτες που «τρέχουν» παγκοσμίως. Τα αποτελέσματα μέχρι σήμερα 2 μεγάλων τυχαιοποιημένων μελετών, βασισμένων σε θεραπεία με λεναλιδομίδη, έδειξαν κάποιο όφελος τουλάχιστο στην επιβίωση χωρίς πρόοδο νόσου (PFS), αλλά δεν ήταν αρκετά ώστε να αλλάξει η κλινική πρακτική. Η μελέτη φάσης III EGOG EAA173 τυχαιοποιεί ασθενείς με ΑΜ υψηλού κινδύνου σε θεραπεία με νταρατουμουμάμπη, λεναλιδομίδη και δεξαμεθαζόνη, έναντι λεναλιδομίδης και δεξαμεθαζόνης. Αρκετές άλλες μελέτες χρησιμοποιούν νέους παράγοντες όπως η ισατουξιμάμπη, η καρφιλζομίμπη, η ελοτουζουμάμπη, η σιλτουξιμάμπη. Η Aggressive Smoldering Curative Approach Evaluating Novel Therapies and Transplant (ASCENT) είναι μια μελέτη φάσης 2 που επιχειρεί την αξιολόγηση του συνδυασμού νταρατουμουμάμπης καρφιλζομίμπης, λεναλιδομίδης και δεξαμεθαζόνης με στόχο την πλήρη ίαση ασθενών με ΑΜ υψηλού κινδύνου(7). Επί του παρόντος δε συστήνεται θεραπεία εκτός κλινικών μελετών, εν αναμονή αποτελεσμάτων που να προάγουν την ολική επιβίωση και όχι μόνο την καθυστέρηση της εξέλιξης της νόσου(8).
Οι στόχοι της θεραπείας σε ενεργό μυέλωμα είναι:
- Η αύξηση της ολικής επιβίωσης και της επιβίωσης χωρίς νόσο
- Η αντιμετώπιση/πρόληψη επιπλοκών της νόσου
- Η επανάκτηση και διατήρηση της ποιότητα ζωής του ασθενούς
1. Θεραπεία Πρώτης Γραμμής
Η απόφαση για θεραπεία είναι μια σύνθετη διαδικασία, που εξαρτάται από τους παρακάτω παράγοντες:
- Ηλικία, κατάσταση ικανότητας και συν-νοσηρότητες ασθενούς
- Επιθετικότητα, κυτταρογενετικό προφίλ και κλινική εκδήλωση της νόσου πχ νεφρική ανεπάρκεια, κάταγμα
Νεότεροι, Fit Ασθενείς
Οι ασθενείς καταρχάς διακρίνονται σε επιλέξιμους για μεταμόσχευση ή όχι. Έτσι, οι ασθενείς νεότεροι των 70 ετών, χωρίς σημαντικές συν-νοσηρότητες, ιδανικά αντιμετωπίζονται αρχικά με ένα βραχύ σχήμα «τριπλέτα», δηλαδή με συνδυασμό 3 (ή και τεσσάρων) φαρμάκων για 4-6 κύκλους και στη συνέχεια προχωρούν σε αυτόλογη μεταμόσχευση αιμοποιητικών κυττάρων, εντός των πρώτων 12 μηνών από την έναρξη θεραπείας(8). Εναλλακτικά, σε ασθενείς σταθερού κινδύνου, μπορεί να γίνει συλλογή κυττάρων (harvesting) και κρυοκατάψυξη, ώστε να υποβληθούν σε μεταμόσχευση αργότερα, κατά την πρώτη υποτροπή, καθώς έχει αποδειχθεί ότι η ολική επιβίωση είναι παρόμοια(9). Μετά τη μεταμόσχευση ακολουθεί συντήρηση με λεναλιδομίδη επ’ αόριστον. Όλοι οι ασθενείς λαμβάνουν θεραπεία για την οστική νόσο με διφωσφονικά (ζολεανδρονικό οξύ μηνιαίως) ή με το νεότερο παράγοντα ντενόσουμπαμπ μηνιαίως αν υπάρχει δυσανεξία.
Στο πλαίσιο των κλινικών μελετών, η ανταπόκριση εκτιμάται όχι μόνο με τους κλασικούς στόχους CR (πλήρης ύφεση), sCR (stringent CR), DFS (disease free survival), PFS και OS (ολική επιβίωση), αλλά και με μετρήσεις της ελάχιστης υπολειπόμενης νόσου (Minimal Residual Disease ή MRD) με NGS ή με next-generation flow cytometry, διότι έχει αποδειχθεί πλέον ότι αποτελεί έναν υποκατάστατο δείκτη (surrogate marker) για το PFS. Με τον τρόπο αυτό διευκολύνεται η σύγκριση διάφορων θεραπειών, μειώνοντας τον χρόνο που πιθανώς απαιτείται για την εξαγωγή ασφαλών συμπερασμάτων από τις μελέτες.
Η ολική επιβίωση διαφοροποιείται ανάλογα με το σχήμα εφόδου. Σύμφωνα με τις κατευθυντήριες οδηγίες του ESMO 2020(8), 1η επιλογή για τη θεραπεία ασθενών με πολλαπλούν μυέλωμα που είναι επιλέξιμοι για μεταμόσχευση αποτελούν τα σχήματα VRD (Bortezomib-Lenalidomide-Dexamethazone) και DaraVTD (Daratumumab-Bortezomib-Thalidomide-Dexamethazone), ακολουθούμενα από τα VTD (Bortezomib-Thalidomide-Dexamethazone) και VCD (Bortezomib-Cyclophosphamide-Dexamethazone). Πρακτικά η θεραπεία εφόδου πρέπει να περιέχει μπορτέζομιμπ και ένα IMID, με ή χωρίς daratumumab. Αντίθετα ο συνδυασμός KRd (Karfilzomib-Lenalidomide-Dexamethazone) συγκρινόμενος με το VRD δεν βελτίωσε το PFS στην πρώτη γραμμή, ενώ είχε και μεγαλύτερη τοξικότητα στη μελέτη ENDURANCE(10).
Η ανοσοθεραπεία είναι αυτή που άλλαξε δραματικά το τοπίο της θεραπείας του ΠΜ. To daratumumab ένα ανθρώπινο μονοκλωνικό αντίσωμα (mAb) IgG1κ που συνδέεται με την πρωτεΐνη CD38, η οποία εκφράζεται σε υψηλό επίπεδο στην επιφάνεια των καρκινικών κυττάρων του πολλαπλού μυελώματος, καθώς και στα ΝΚ κύτταρα και τα μονοκύτταρα. Το daratumumab έχει ισχυρή αντι-μυελωματική δράση μέσω διαμεσολαβούμενης από το συμπλήρωμα κυτταροτοξικότητας (CDC), εξαρτώμενης από αντιγόνο κυτταροτοξικότητας (ADCC), απευθείας επαγωγής απόπτωσης (antibody-dependent cellular phagocytosis, ADCP) και άλλους μηχανισμούς, όπως ενεργοποίηση των ΝΚ κυττάρων(11). Έχει πλέον ένδειξη στην πρώτη γραμμή θεραπείας στους συνδυασμούς Dara-Lenalidomide-Dexamethazone (DRd), Dara-Melphalan-Bortezomib-Dexamethazone (D-VMP) και Dara-VTD. Αναμένεται σύντομα η ήδη εγκεκριμένη στην Αμερική ένδειξη του σχήματος 4 φαρμάκων Dara-VRD, το οποίο στις μελέτες GRIFFIN(12) και PERSEUS έδειξε υψηλά ποσοστά αρνητικής MRD έναντι του VRD ακόμα και στους ασθενείς υψηλού κυτταρογενετικού ρίσκου, τόσο στους επιλέξιμους όσο και στους μη επιλέξιμους για μεταμόσχευση. Σύμφωνα με τον αμερικανικό αλγόριθμο mSMART, όλοι οι σταθερού κινδύνου ασθενείς λαμβάνουν VRD και όλοι οι υψηλού κινδύνου Dara-VRD(13).
Ο Ρόλος της Μεταμόσχευσης Αρχέγονων Αιμοποιητικών Κυττάρων
Η αυτόλογη μεταμόσχευση αρχέγονων αιμοποιητικών κυττάρων (ASCT) παραμένει η standard θεραπεία πρώτης γραμμής των επιλέξιμων ασθενών. Χωρίς να επιφέρει ίαση, επιμηκύνει την ολική επιβίωση κατά 12 μήνες. Σε ασθενείς υψηλού κινδύνου [t(4;14) και/ή del17p που δεν πέτυχαν πλήρη ύφεση μετά από έφοδο περιέχουσα μπορτέζομιμπ] έχει ακόμα ένδειξη και η tandem μεταμόσχευση, δηλαδή η δεύτερη αυτόλογη μεταμόσχευση, μέσα σε 6 μήνες από την πρώτη, εάν και η πρόσφατη αμερικανική μελέτη STAMINA στην οποία οι περισσότεροι ασθενείς έλαβαν έφοδο με VRD, δεν έδειξε πλεονέκτημα της tantem μεταμόσχευσης(14). Αφού μειωθεί το φορτίο της νόσου με κάποια αρχική θεραπεία, γίνεται συλλογή αρχέγονων αιμοποιητικών κυττάρων (stem cells) από τον ασθενή και κρυοκατάψυξη. Στη συνέχεια ο ασθενής υποβάλλεται σε μεγαθεραπεία με ενδοφλέβια μελφαλάνη (200mg/m2), η οποία, εκτός από την ύφεση της νόσου, φαίνεται ότι επιτυγχάνει και “reset” του αιμοποιητικού μικροπεριβάλλοντος του μυελού. Ασθενείς με κάθαρση κρεατινίνης κάτω από 60ml/min λαμβάνουν ελαττωμένη δόση μελφαλάνης, 140mg/m2. Λόγω της μυελοαφανιστικής της δράσης, ο ασθενής υποστηρίζεται με την έγχυση του αυτόλογου μοσχεύματος, που αναγεννά τον μυελό των οστών σε λίγες ημέρες.
Μέχρι πρόσφατα θεωρούνταν η καλύτερη προσέγγιση με στόχο την αύξηση της ολικής επιβίωσης και της PFS σε σχέση με όλες τις άλλες διαθέσιμες θεραπείες. Με τις νεότερες θεραπείες ωστόσο, ιδίως με το VRD, φάνηκε ότι δεν υπήρχε πλέον διαφορά στην ολική επιβίωση εάν και διατηρείται η υπεροχή της ASCT ως προς το PFS και την MRD, με μέσο PFS 50 μήνες στη μελέτη-σταθμό IFM/DFCI, έναντι 35 μηνών στο σκέλος VRD μόνο(15). Το ίδιο δείχνουν και μετα-αναλύσεις με άλλα σχήματα εφόδου. Αποδεδειγμένος είναι επίσης ο ευνοϊκός ρόλος της θεραπείας συντήρησης με λεναλιδομίδη μετά τη μεταμόσχευση, η οποία χορηγείται επ’ αόριστον. Άλλα πλεονεκτήματα της μεταμόσχευσης είναι η βραχεία διάρκεια της θεραπείας που απαλλάσσει τον ασθενή από την ανάγκη μακρόχρονης, συνεχούς θεραπείας, καθώς και η χαμηλή TRM της τάξης του 1-2%. Μένει να δούμε αν η προσθήκη ανοσοθεραπείας με μονοκλωνικά αντισώματα στη θεραπεία εφόδου θα αλλάξει τον μέχρι τώρα αδιαμφισβήτητο ρόλο της ASCT.
Η αλλογενής μεταμόσχευση μυελού, ενώ έχει δυνητικά την πιθανότητα πλήρους ίασης, έχει υψηλό TRM (transplantation related mortality) 10-20% ανάλογα με το προπαρασκευαστικό σχήμα, υψηλή συχνότητα GVHD(16), ασαφή αποτελέσματα ως προς την επίτευξη plateau στις καμπύλες επιβίωσης και έχει (?) θέση μόνο σε νέους ασθενείς υψηλού κινδύνου με ανθεκτική νόσο.
Ηλικιωμένοι, Unfit Ασθενείς
Το μυέλωμα είναι νόσος των ηλικιωμένων και μόνο 20% των ασθενών θα καταφέρουν να υποβληθούν σε ASCT. Οι μη επιλέξιμοι για μεταμόσχευση ασθενείς σύμφωνα με το ESMO(8) προτείνεται να αντιμετωπίζονται με 1η επιλογή τα σχήματα DaraRd, DaraVMP ή VRd, ακολουθούμενα από τα VMP και Rd αν δεν μπορούν να λάβουν ένα από τα προηγούμενα. Ανάλογα με το σχήμα που επιλεγεί, η χορήγηση συνεχίζεται έως την πρόοδο νόσου (DRD) ή για 8-12 κύκλους (VRD) ακολουθούμενους από συντήρηση με λεναλιδομίδη.
Η επιλογή των φαρμάκων εξαρτάται από διάφορους παράγοντες, για παράδειγμα ασθενείς που εμφανίζονται με οξεία νεφρική ανεπάρκεια συνήθως λαμβάνουν θεραπεία που εμπεριέχει αναστολέα πρωτεασώματος (μπορτέζομιμπ) και μάλιστα προτιμάται το VCD. Η προσθήκη Daratumumab στην αρχική θεραπεία αυξάνει την PFS και σε μερικές περιπτώσεις και την ολική επιβίωση των ασθενών, όπως φαίνεται σε όλες τις μετα-αναλύσεις, εάν και το όφελος αυτό δε διατηρείται κατ’ ανάγκη στους ασθενείς υψηλού κυτταρογενετικού κινδύνου (σε αντίθεση με την 1η υποτροπή)(17). Ένα μειονέκτημα του DRD είναι η ανάγκη χορήγησής επ’ αόριστον, που αυξάνει το κόστος της θεραπείας και επιβαρύνει με πολλές επισκέψεις τον ασθενή, ωστόσο η εισαγωγή του υποδορίου daratumumab θα ελαττώσει τις δυσκολίες.
2. Υποτροπιάζουσα/Ανθεκτική Νόσος
Παρά την αύξηση της επιβίωσης χωρίς υποτροπή της νόσου με τις νεότερες θεραπείες, με ή χωρίς μεταμόσχευση, το μυέλωμα πάντα υποτροπιάζει, ενώ υπάρχει και μικρό ποσοστό ασθενών που θα είναι ανθεκτικοί στη θεραπεία πρώτης γραμμής. Σε κάθε υποτροπή, ακόμα και αν ο ασθενής τεθεί εκ νέου σε ύφεση, η διάρκεια της ύφεσης είναι βραχύτερη και τελικά η νόσος γίνεται ανθεκτική σε όλες τις κατηγορίες φαρμάκων.
Οι υποτροπές διακρίνονται σε κλινικές και βιοχημικές ανάλογα με το αν υπάρχουν κριτήρια CRAB ή μόνο εργαστηριακή επιδείνωση (αύξηση κατά ≥25% από το ναδίρ της παραπρωτεΐνης ορού ή ούρων ή του FLC ή της πλασματοκυτταρικής διήθησης μυελού ή των κυκλοφορούντων πλασματοκυττάρων)(18). Η βιοχημική υποτροπή δε χρειάζεται κατ’ ανάγκη θεραπεία, εκτός αν ο ασθενής ήταν εξαρχής υψηλού κινδύνου.
Αρχές τη Θεραπείας Υποτροπής
- Η επιλογή θεραπείας είναι πιο δύσκολη σε σχέση με την πρώτη γραμμή και εξαρτάται κατά πολύ από το είδος και την τοξικότητα προηγούμενης θεραπείας (ASCT, Bortezomib, Lenalidomide), την απάντηση (αντοχή) στην προηγούμενη θεραπεία και τη διάρκεια αυτής. Ασθενείς που υποτροπιάζουν <12 μήνες από την έναρξη θεραπείας εφόδου θεωρούνται υψηλού κινδύνου ακόμα και αν είναι σταθερού κινδύνου με FISH(19).
- Δεύτερη αυτόλογη μεταμόσχευση είναι μια επιλογή για ασθενείς οι οποίοι υποβλήθηκαν σε ASCT μετά από έφοδο που περιελάμβανε μπορτέζομιμπ και συντήρηση με λεναλιδομίδη, με την προϋπόθεση ότι η ύφεση είχε διάρκεια τουλάχιστο 36 μήνες ή 18 μήνες χωρίς συντήρηση(8). Επίσης, ασθενείς που επέλεξαν την αναβολή της ASCT στην πρώτη γραμμή με harvesting κυττάρων, μπορούν να υποβληθούν σε μεταμόσχευση διάσωσης, «salvage», στην υποτροπή.
- Εάν η υποτροπή συμβεί σε περισσότερους από 6 μήνες από τη διακοπή κάθε θεραπείας, μπορεί να επαναληφθεί το αρχικό σχήμα.
- Η επιθετική ή υψηλού κινδύνου υποτροπή απαιτεί θεραπεία με 3 φάρμακα και συνεχιζόμενη(20).
- Η θεραπεία στην υποτροπή δίδεται συνήθως επ’ αόριστον, εάν και μπορεί να δοκιμαστεί διακοπή θεραπείας σε αργή υποτροπή μετά από πλήρη ύφεση σε σταθερού κινδύνου νόσο.
- Δίδονται φάρμακα στα οποία ο ασθενείς δεν έχει ανθεκτικότητα, με αλλαγή κλάσης φαρμάκων συνήθως. Εξαίρεση αποτελούν η πομαλιδομίδη και το καρφίλζομιμπ, τα οποία έχουν δραστικότητα σε ασθενείς ανθεκτικούς στη λεναλιδομίδη και το μπορτέζομιμπ αντίστοιχα.
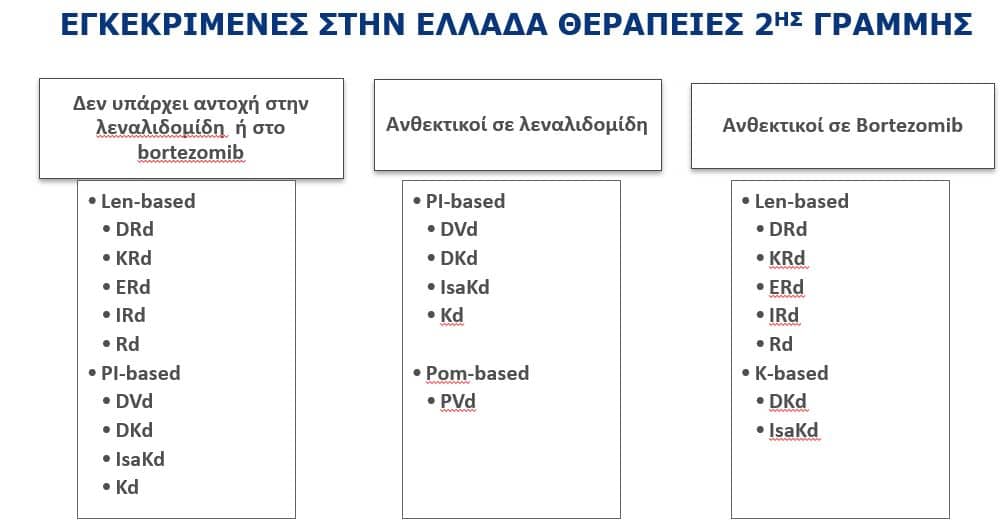
Σύμφωνα με τις κατευθυντήριες οδηγίες του ESMO 2020(8), οι ασθενείς χωρίζονται σε ανθεκτικούς στη λεναλιδομίδη, σε ανθεκτικούς στο μπορτέζομιμπ και σε διπλά ανθεκτικούς (πχ μετά από VRD). PomVd, DaraVd, DaraKd και IsaKd συστήνονται για ασθενείς ανθεκτικούς στη λεναλιδομίδη, ενώ τα DaraKd και IsaKd μπορούν να δοθούν και σε ανθεκτικούς σε μπορτέζομιμπ και είναι θεραπείες εκλογής σε διπλά ανθεκτικούς μετά από VRD. Για ασθενείς ευαίσθητους στη λεναλιδομίδη προτιμώνται τα DaraRd, KRd σε fit ασθενείς και τα IRd(ixazomib-lenalidomide-dexa) και EloRd σε ευπαθείς ασθενείς. Μάλιστα, το IRd αποτελεί την πρώτη all-oral τριπλέτα. Στην Εικόνα 3 φαίνονται οι εγκεκριμένες στην Ελλάδα θεραπείες 2ης γραμμής (2022).
3. Μονήρες Πλασμοκύττωμα
Το μονήρες πλασματοκύττωμα είναι μια σπάνια πλασματοκυτταρική δυσκρασία και διακρίνεται σε οστικό και εξωμυελικό. Εξ ορισμού δεν υπάρχει διήθηση μυελού από κλωνικά πλασματοκύτταρα ούτε παραπρωτεϊναιμία (ή αν υπάρχει ίχνος παραπρωτεΐνης, εξαφανίζεται με την αντιμετώπιση του πλασμοκυττώματος). Ομοίως δεν υπάρχουν και συμπτώματα μυελώματος. Πριν από τη θεραπεία θα πρέπει να γίνεται απεικόνιση με ολοσωματική MRI και PET-CT για τον αποκλεισμό ύπαρξης πολυεστιακών πλασμοκυττωμάτων τα οποία απαιτούν συστηματική θεραπεία.
Θεραπεία εκλογής αποτελεί η υψηλή δόση τοπικής ακτινοθεραπείας εάν και τα δύο τρίτα των ασθενών θα αναπτύξουν ΠΜ στα επόμενα 10 έτη. Εναλλακτικά μπορεί να γίνει χειρουργική εκτομή όταν η θέση του όγκου, κοντά σε ευαίσθητα όργανα αποκλείει την ακτινοβολία.
4. Πλασματοκυτταρική Λευχαιμία
Πρόκειται για ένα σπάνιο, πολύ επιθετικό νόσημα το οποίο είναι συνήθως πρωτοπαθές, δηλαδή χωρίς να έχει προηγηθεί διάγνωση μυελώματος. Ορίζεται από την παρουσία 20% και/ή απόλυτου αριθμού πλασματοκυττάρων > 2χ10 9/L στο αίμα. Η πρόγνωση είναι πτωχή, με επιβίωση περίπου 1 έτους και δεν υπάρχουν συγκεκριμένες κατευθυντήριες οδηγίες για τη θεραπεία του. Αντιμετωπίζεται με συνδυασμένη χημειοθεραπεία VTD-PACE και αυτόλογη μεταμόσχευση, tantem αυτόλογη ή και αλλογενή μεταμόσχευση σε επιλεγμένες περιπτώσεις(13).
5. Ερευνητικές θεραπείες
Ένα από τα πιο συναρπαστικά πεδία έρευνας είναι η θεραπεία με CAR (Chimeric Antigen Receptor)-T cells που στοχεύουν στο αντιγόνο BCMA. Μέχρι στιγμής άνω του 80% των ασθενών φαίνεται να ανταποκρίνεται, με διάμεση διάρκεια απόκρισης ~12 μήνες(21). Άλλη μια πολλά υποσχόμενη θεραπεία είναι τα BiTEs που στοχεύουν στο BCMA.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014; 15: e538-548.
- Kyle RA, Remstein ED, Therneau TM, et al. Clinical course and prognosis of smoldering (asymptomatic) multiple myeloma. N Engl J Med. 2007; 356: 2582-2590.
- Palumbo A, Avet-Loiseau H, Oliva S, et al. Revised International Staging System for Multiple Myeloma: A Report From International Myeloma Working Group. Journal of Clinical Oncology. 2015; 33: 2863-2869.
- Kumar SK, Mikhael JR, Buadi FK, et al. Management of newly diagnosed symptomatic multiple myeloma: updated Mayo Stratification of Myeloma and Risk-Adapted Therapy (mSMART) consensus guidelines. Mayo Clin Proc. 2009; 84: 1095-1110.
- Attal M, Harousseau JL, Stoppa AM, et al. A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. Intergroupe Français du Myélome. N Engl J Med. 1996; 335: 91-97.
- Mateos MV, Kumar S, Dimopoulos MA, et al. International Myeloma Working Group risk stratification model for smoldering multiple myeloma (SMM). Blood Cancer J. 2020; 10: 102.
- Kumar SK, Abdallah Al-Ola, Badros Ashraf Z., Laplant Betsy. Aggressive Smoldering Curative Approach Evaluating Novel Therapies (ASCENT): A Phase 2 Trial of Induction, Consolidation and Maintenance in Subjects with High Risk Smoldering Multiple Myeloma (SMM): Initial Analysis of Safety Data. Blood. 2020; 136: 35-36.
- Dimopoulos MA, Moreau P, Terpos E, et al. Multiple myeloma: EHA-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up(†). Ann Oncol. 2021; 32: 309-322.
- Perrot A, Lauwers-Cances V, Cazaubiel T, et al. Early Versus Late Autologous Stem Cell Transplant in Newly Diagnosed Multiple Myeloma: Long-Term Follow-up Analysis of the IFM 2009 Trial. Blood. 2020; 136(supp1).
- Kumar SK, Jacobus SJ, Cohen AD, et al. Carfilzomib or bortezomib in combination with lenalidomide and dexamethasone for patients with newly diagnosed multiple myeloma without intention for immediate autologous stem-cell transplantation (ENDURANCE): a multicentre, open-label, phase 3, randomised, controlled trial. The Lancet Oncology. 2020; 21: 1317-1330.
- Viola D, Dona A, Caserta E, et al. Daratumumab induces mechanisms of immune activation through CD38+ NK cell targeting. Leukemia. 2021; 35: 189-200.
- Voorhees PM, Kaufman JL, Laubach J, et al. Daratumumab, lenalidomide, bortezomib, and dexamethasone for transplant-eligible newly diagnosed multiple myeloma: the GRIFFIN trial. Blood. 2020; 136: 936-945.
- Rajkumar SV. Multiple myeloma: 2020 update on diagnosis, risk-stratification and management. American Journal of Hematology. 2020; 95: 548-567.
- Stadtmauer EA, Pasquini MC, Blackwell B, et al. Autologous Transplantation, Consolidation, and Maintenance Therapy in Multiple Myeloma: Results of the BMT CTN 0702 Trial. J Clin Oncol. 2019; 37:589- 597.
- Attal M, Lauwers-Cances V, Hulin C, et al. Lenalidomide, Bortezomib, and Dexamethasone with Transplantation for Myeloma. New England Journal of Medicine. 2017; 376: 1311-1320.
- Stewart AK. Reduced-intensity allogeneic transplantation for myeloma: reality bites. Blood. 2009; 113: 3135-3156.
- Premkumar V, Pan S, Lentzsch S, Bhutani D. Use of daratumumab in high-risk multiple myeloma: A meta-analysis. eJHaem. 2020; 1: 267-271.
- Kumar S, Paiva B, Anderson KC, et al. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma. The Lancet Oncology. 2016; 17: e328-e346.
- Majithia N, Rajkumar SV, Lacy MQ, et al. Early relapse following initial therapy for multiple myeloma predicts poor outcomes in the era of novel agents. Leukemia. 2016; 30: 2208-2213.
- Rajkumar SV, Kumar S. Multiple myeloma current treatment algorithms. Blood Cancer J. 2020; 10: 94.
- Raje N, Berdeja J, Lin Y, et al. Anti-BCMA CAR T-Cell Therapy bb2121 in Relapsed or Refractory Multiple Myeloma. N Engl J Med. 2019; 380: 1726-1737.










Άφησε σχόλιο