Εισαγωγή
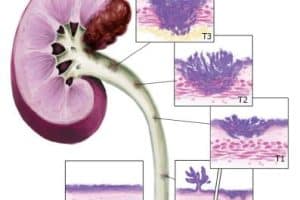
Ο νεφροκυτταρικός καρκίνος (NKK) βρίσκεται μέσα στους 10 συχνότερα διαγιγνωσκόμενους καρκίνους και αποτελεί τη συχνότερη κακοήθη νόσο (90%) που προσβάλει τον νεφρό. Η επίπτωση της νόσου αυξάνονταν εκθετικά τα τελευταία 20 περίπου έτη, πιθανά σαν αποτέλεσμα και της αυξανόμενης χρήσης απεικονιστικών μέσων από τον γενικό πληθυσμό. Το γεγονός αυτό προκύπτει και από την παρατήρηση ότι >50% των διαγνώσεων προέρχονται πλέον από τυχαίο προσυμπτωματικό έλεγχο. Πρόκειται για νόσο κυρίως της μέσης και μεγάλης ηλικίας, με το 91% των διαγνώσεων να αφορά ασθενείς μεγαλύτερους των 45 ετών, και εμφανίζεται δύο φορές συχνότερα στους άντρες από τις γυναίκες.
Οι περισσότερο γνωστοί προδιαθεσικοί παράγοντες για τον NKK είναι το κάπνισμα, η υπέρταση και η παχυσαρκία. Ασθενείς με χρόνια νεφρική ανεπάρκεια τελικού σταδίου και επίκτητη κυστική νόσο των νεφρών επίσης εμφανίζουν συχνότερα ΝΚΚ.
Διαχρονικά η πρόγνωση του ΝΚΚ ήταν δυσμενής. Σε μεγάλο βαθμό αυτό οφείλονταν στην μέχρι πριν από 15 έτη έλλειψη αποτελεσματικών συστηματικών θεραπειών. Ιστορικές αναφορές δείχνουν ότι από τους ασθενείς που μπορούσαν να αντιμετωπιστούν χειρουργικά περίπου το 30% βρίσκονταν εν ζωή μετά από 5 έτη. Αυτό το ποσοστό, ήδη από την περίοδο 2006- 2012, έχει πλέον υπερδιπλασιαστεί, αλλά η 5ετής επιβίωση των ασθενών με τοπικά προχωρημένη/ ανεγχείρητη και μεταστατική νόσο παρέμενε σε πολύ χαμηλά επίπεδα: 53% και 8% αντίστοιχα. Επιπλέον, το γεγονός ότι αρκετοί ασθενείς -περίπου 1 στους 4- ακόμα και μετά από μια θεραπευτική νεφρεκτομή θα παρουσιάσουν στο μέλλον μεταστατική/ υποτροπιάζουσα νόσο, τονίζει την ανάγκη για ανάπτυξη αποτελεσματικής συστηματικής θεραπείας.
Βιολογία της Νόσου και Θεραπευτικές Επιλογές
Βιολογία της Νόσου
Ο πιο συχνός ιστολογικός τύπος ΝΚΚ είναι το διαυγοκυτταρικό καρκίνωμα (clear cell/cc), το οποίο ανευρίσκεται στο 70%-80% των διαγνώσεων ΝΚΚ. Το θηλώδες και το χρωμόφοβο καρκίνωμα είναι οι επόμενοι πιο συχνοί ιστολογικοί τύποι και εμφανίζονται στο 80% των υπολοίπων ΝΚΚ.
Στο διαυγοκυτταρικό ΝΚΚ, η βασική βιολογική διαταραχή που οδηγεί στην καρκινογένεση σχετίζεται με μεταλλάξεις στο ογκοκατασταλτικό γονίδιο VHL (Von Hippel Lindau), το οποίο εντοπίζεται στο χρωμόσωμα 3. Το γονίδιο VHL έχει φυσιολογικό ρόλο στην αντιμετώπιση της υποξίας από το κύτταρο. Στην περίπτωση του ΝΚΚ, η υποξία οδηγεί σε παθολογική συσσώρευση παραγόντων που ευνοούν την παραγωγή άλλων ουσιών όπως του αγγειακού ενδοθηλιακού αυξητικού παράγοντα (VEGF), και άλλων γονιδίων, με τελικό αποτέλεσμα την νέο-αγγειογένεση, την κυτταρική αύξηση και επιβίωση των καρκινικών κυττάρων. Εκτός από το γονίδιο VHL, σημαντικό ρόλο στην εξέλιξη του ccΝΚΚ έχουν και άλλα μοριακά γεγονότα όπως η εμφάνιση μεταλλάξεων στο μεταβολικό μονοπάτι του mTOR (mammalian target of rapamycin). Στην καρκινογένεση των άλλων ιστολογικών τύπων και κυρίως του θηλώδους καρκινώματος έχει αναγνωριστεί ο ρόλος των μεταλλάξεων στο μονοπάτι του ΜΕΤ, διαταραχές στη μεθυλίωση και μεταλλάξεις σε πυρηνικούς αυξητικούς παράγοντες και κινάσες κυκλινών.
Σε κυτταρικό επίπεδο, τα περισσότερα ΝΚΚ εκφράζουν στην επιφάνεια τους τον υποδοχέα programmed cell death-1 (PD-1) ή τον συνδέτη του, το PD-L1. Η σύνδεση υποδοχέα- συνδέτη οδηγεί σε αρνητική ρύθμιση την αντικαρκινική ανοσολογική απάντηση, αναστέλλοντας την απελευθέρωση κυτταροκινών και την κυτταροτοξική αντικαρκινική δράση των Τ κυττάρων.
Σε μια πιο πρόσφατη εξέλιξη, η οποία βασίστηκε στη γενωμική ανάλυση 823 ccΝΚΚ, προέκυψε μια μοριακή κατηγοριοποίηση του ΝΚΚ σε 7 υποτύπους με ξεχωριστές γονιδιακές υπογραφές και σημαντική προβλεπτική σημασία για τις χρησιμοποιούμενες σήμερα θεραπείες, που θα αναλυθούν στη συνέχεια.
Θεραπευτικές Επιλογές
Η ορμονοθεραπεία και η κυτταροτοξική χημειοθεραπεία έχουν λίγη ή και καθόλου δράση στο προχωρημένο/μεταστατικό ΝΚΚ. Η ανοσοθεραπεία με ιντερφερόνη-α (IFN α) ή με χορήγηση υψηλών δόσεων ιντερλευκίνης-2 (IL-2) ήταν οι βασικές θεραπευτικές επιλογές έως πριν από 15 έτη. Αυτές οι θεραπείες επιτύγχαναν ανταποκρίσεις περίπου στο 10% των ασθενών (αρκετές από αυτές πλήρεις και μακράς διάρκειας), αλλά με το κόστος μια πολύ σημαντικής -συχνά μη ανεκτής- τοξικότητας.
Την διετία 2005- 2007 εγκρίθηκαν οι πρώτοι παράγοντες που στόχευαν την νεοαγγειογένεση που επάγεται από το μόριο VEGF, το sunitinib και το sorafenib. Τα επόμενα χρόνια εγκρίθηκαν άλλοι πέντε παράγοντες αντιαγγειογένεσης : pazopanib, axitinib, bevacizumab, cabozantinib, lenvatinib και tivozanib). Από τους παράγοντες αυτούς, μόνο το bevacizumab είναι ενδοφλέβια χορηγούμενο μονοκλωνικό αντίσωμα έναντι του VEGF, ενώ όλοι οι άλλοι είναι από του στόματος χορηγούμενοι αναστολείς κινασών τυροσίνης (TKIs), που στοχεύουν πολλαπλά μόρια τα οποία σχετίζονται με την επαγόμενη από την υποξία νέο-αγγειογένεση. Την ίδια περίοδο έδειξαν όφελος στις κλινικές μελέτες και έλαβαν έγκριση δύο αναστολείς του mTOR το temsirolimus και το everolimus, ενώ το 2015 ανακοινώθηκε η πρώτη κλινική μελέτη με θετικά αποτελέσματα για το μονοκλωνικό αντίσωμα nivolumab, ένα αντί-PD-1 αντίσωμα, ανοίγοντας έτσι την εποχή της σύγχρονης ανοσοθεραπείας σαν βασική θεραπευτική επιλογή.
Η θεραπεία των ασθενών με προχωρημένο/ μεταστατικό καρκίνο του νεφρού επιλέγεται με βάση κλινικά κριτήρια εκτίμησης κινδύνου (IMDC / International Metastatic RCC Database Consortium criteria) , και συνολικής επιβίωσης των ασθενών. Μια τροποποίηση των κριτηρίων αυτών (Heng criteria) χρησιμοποιείται μέχρι σήμερα, καθώς παρά την εκτεταμένη έρευνα λείπουν ακόμα διεθνώς καθιερωμένοι προβλεπτικοί και προγνωστικοί βιοδείκτες.
Στη σημερινή εποχή, μετά από μία σειρά επιτυχημένων μελετών, η καθιερωμένη πλέον θεραπευτική επιλογή στην 1η γραμμή θεραπείας (δηλαδή στην πρώτη εμφάνιση προχωρημένης/μεταστατικής ή υποτροπιάζουσας νόσου), βασίζεται στη χορήγηση συνδυασμού αναστολέων αγγειογένεσης και αντι-PD1 μονοκλωνικών αντισωμάτων ή συνδυασμό ανοσοθεραπείας με δύο διαφορετικά μονοκλωνικά αντισώματα. Μια συγκεντρωτική εικόνα των βασικών μελετών με θετικό αποτέλεσμα παρατίθεται στον Πίνακα 1. Στην περίπτωση ασθενών οι οποίοι για λόγους ασφαλείας δεν μπορούν να λάβουν θεραπεία με μονοκλωνικά αντισώματα, η χορήγηση TKIs ως μονοθεραπείας παραμένει μια δόκιμη επιλογή.
Οι νέοι συνδυασμοί θεραπείας που έχουν εγκριθεί, προσφέρουν σημαντικό όφελος στην επιβίωση των ασθενών, στην καθυστέρηση εμφάνισης υποτροπής της νόσου και στον έλεγχο της νόσου και των συμπτωμάτων της για σημαντικό χρονικό διάστημα. Οι σημαντικότερες ανεπιθύμητες ενέργειες που έχουν αναφερθεί, προκύπτουν είτε από την υπερδιέγερση του ανοσοποιητικού συστήματος (π.χ. δερματίτιδα, κολίτιδα, πνευμονίτιδα), είτε από την εμφάνιση συμβαμάτων που σχετίζονται με την αναστολή της νέο-αγγειογένεσης (π.χ. υπέρταση, καθυστέρηση επούλωσης τραυμάτων, αιμορραγία, λευκωματουρία), είτε από το συνδυασμό τους. Καθώς η έγκαιρη αναγνώριση και η σωστή διαχείριση των ανεπιθύμητων ενεργειών είναι βασική προϋπόθεση για την ασφαλή και αποτελεσματική χρήση αυτών των φαρμάκων, η χορήγησή τους θα πρέπει να γίνεται υπό την εποπτεία ιατρών με εξειδίκευση και εμπειρία στις συγκεκριμένες θεραπείες.
Στην 2η γραμμή θεραπείας (στην επανεμφάνιση/ επιδείνωση της νόσου μετά ή υπό συστηματική θεραπεία), οι χορηγούμενοι παράγοντες είναι οι ίδιοι με αυτούς της 1ης γραμμής, αλλά η χορήγηση αφορά σε μονοθεραπεία παρά σε συνδυασμούς. Κατά κανόνα, η χορηγούμενη αγωγή επικεντρώνεται το σκέλος της στόχευσης που δεν είχε χορηγηθεί στην 1η γραμμή, και ως εκ τούτου σε ασθενείς που είχαν λάβει TKIs χορηγείται ανοσοθεραπεία, σε ασθενείς που είχε χορηγηθεί ανοσοθεραπεία, χορηγούνται TKIs, ενώ σε ασθενείς που είχε χορηγηθεί συνδυασμός ανοσοθεραπείας – ΤΚΙs προτιμάται η συνέχιση της αγωγής με ένα διαφορετικό TKI από αυτόν που είχε αρχικά χορηγηθεί.
Μέχρι πρόσφατα, οι περισσότερες θεραπευτικές επιλογές για τους ασθενείς με νεφροκυτταρικό καρκίνο μη-διαυγοκυτταρικής ιστολογίας, προέκυπταν είτε από εξαγωγή συμπερασμάτων εκ του διαγοκυτταρικού, είτε από μικρές τυχαιοποιημένες μελέτες που αφορούσαν κυρίως τη χρήση του sunitinib. Πολύ πρόσφατα, το 2021, ανακοινώθηκαν θετικά αποτελέσματα μελέτης που ανέδειξαν την υπεροχή του cabozantinib έναντι του sunitinib, και αυτός ο παράγοντας αποτελεί πλέον την προτιμώμενη επιλογή για τους ασθενείς με θηλώδη ιστολογικό τύπο ΝΚΚ.
Όπως αναφέρθηκε προηγούμενα, η βασική οδός καρκινογένεσης για τον ΝΚΚ σχετίζεται με την ύπαρξη μεταλλάξεων στον γονίδιο VHL. Οι ασθενείς που πάσχουν από την κληρονομική μορφή της νόσου VHL, εμφανίζουν 70% δια βίου κίνδυνο ανάπτυξης ΝΚΚ. Η βασική αντιμετώπιση αυτών των καρκινωμάτων είναι κατά βάση χειρουργική, όταν υπερβούν ένα συγκεκριμένο μέγεθος, καθώς έχουν χαμηλό μεταστατικό δυναμικό. Αυτό έχει ως αποτέλεσμα πολλοί ασθενείς να οδηγούνται τελικά σε ανεπάρκεια λειτουργικού νεφρικού ιστού. Σύμφωνα με τα αποτελέσματα κλινικής μελέτης, η θεραπεία με τον αναστολέα του ιστικού παράγοντα της υποξίας (HIF)-2a, belzutifan, προκάλεσε ανταπόκριση της νόσου στο 49% των ασθενών και μακρά σταθεροποίηση αυτής σε ένα επιπλέον 49% των ασθενών. Σύμφωνα με αυτά τα δεδομένα το belzutifan έλαβε έγκριση από τον FDA τον Αύγουστο 2021. Η χρήση του φαίνεται ότι μπορεί να καθυστερήσει ή και να αποτρέψει περαιτέρω χειρουργικές παρεμβάσεις σε ασθενείς με νόσο VHL, με ό,τι αυτό συνεπάγεται στη μείωση εμφάνισης άμεσων ή απώτερων επιπλοκών.
| Μελέτη | Θεραπευτικό Σχήμα | Τελικό καταληκτικό σημείο | Συνολική ανταπόκριση (ORR %) | Διάστημα ελεύθερο υποτροπής (PFS, μήνες) | Συνολική επιβίωση (OS, μήνες) |
| Checkmate 214 | Ipilimumab/ nivolumab vs Sunitinib | ORR, PFS, and OS in IMDC I/P | 42 v 27 | 11.6 v 8.4 | NR v 26 |
| KEYNOTE-426 | Axitinib/ pembrolizumab vs Sunitinib | OS and PFS in ITT | 59.3 v 35.7 | 15.1 v 11.1 | HRc: 0.53 P<.001 |
| JAVELIN Renal 101 | Axitinib/avelumab vs Sunitinib | PFS and OS in PDL1– positive | 55.2 v 25.5 | 13.8 v 7.2 | HRc: 0.82 P= .38 |
| Checkmate 9ER | Cabozantinib/ nivolumab vs Sunitinib | PFS in ITT | 55.7 v 27.1 | 16.6 v 8.3 | HRc: 0.60 P= .001 |
| CLEAR | Lenvatinib/ pembrolizumab vs Sunitinib | PFS in ITT | 71 v 36.1 | 23.9 v 9.2 | HRc: 0.66 P= .005 |
Πίνακας 1. Οι Βασικές Κλινικές Μελέτες 1ης Γραμμής που Άλλαξαν την Θεραπευτική Στρατηγική. Ανακοινώσεις Αποτελεσμάτων έως 7ο/2021
Συντομογραφίες: CR, complete response; F, favorable; HR, hazard ratio; I, intermediate; IMDC, International Metastatic RCC Database Consortium; ITT,intent-to-treat; mOS, median overall survival; mPFS, median progression-free survival; mRCC, metastatic renal cell carcinoma; NA, not available; NE, not evaluable; NR, not reached; ORR, objective response rate; OS, overall survival; P, poor; PD-L1, programmed death ligand-1; PFS, progression-free survival.
Συμπέρασμα
Το εύρος των διαθέσιμων θεραπευτικών επιλογών για τον μεταστατικό/ προχωρημένο ΝΚΚ έχει εντυπωσιακά αυξηθεί στη διάρκεια της τελευταίας δεκαετίας. Η γρήγορη μετάβαση από την χορήγηση κυτταροκινών, στην στοχευτική θεραπεία, στην ανοσοθεραπεία με αναστολείς των ανοσορυθμιστικών υποδοχέων και τελικά στους συνδυασμούς των θεραπειών αυτών, έχει επιφέρει μια πραγματική επανάσταση τόσο στον τρόπο που αντιμετωπίζεται πλέον αυτή η νόσος, όσο και στα προσδοκώμενα αποτελέσματα.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Choueiri TK, Motzer RJ. Systemic Therapy for Metastatic Renal-Cell Carcinoma. N Engl J Med. 2017; 376: 354-366.
- Choueiri TK, Powles T, Burotto M, et al. Nivolumab plus Cabozantinib versus Sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med. 2021; 384: 829-841.
- Choueiri TK, Escudier B, Powles T, et al. Cabozantinib versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med. 2015; 373: 1814-1823.
- Curti BD. Immunotherapy in Advanced Renal Cancer – Is Cure Possible? N Engl J Med. 2018; 378: 1344-1345.
- Escudier B, Porta C, Schmidinger M, et al. Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2019; 30: 706-720.
- Escudier B. Combination Therapy as First-Line Treatment in Metastatic Renal-Cell Carcinoma. N Engl J Med. 2019; 380: 1176-1178.
- Gleave ME, Elhilali M, Fradet Y, et al. Interferon gamma-1b compared with placebo in metastatic renal-cell carcinoma. Canadian Urologic Oncology Group. N Engl J Med. 1998; 338: 1265-1271.
- Gulati S, Labaki C, Karachaliou GS, et al. First-Line Treatments for Metastatic Clear Cell Renal Cell Carcinoma: An Ever-Enlarging Landscape. The Oncologist. 2022; 27: 125–134.
- Jonasch E, Donskov F, Iliopoulos O, et al. Belzutifan for Renal Cell Carcinoma in von Hippel-Lindau Disease. N Engl J Med. 2021; 385: 2036-2046.
- Mintz E.R. Renal Cancer — End Results in 105 Consecutive Cases. Engl J Med 1938; 218: 329-337.
- Motzer RJ, Penkov K, Haanen J, et al. Avelumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med. 2019; 380: 1103-1115.
- Motzer R, Alekseev B, Rha SY, et al. Lenvatinib plus Pembrolizumab or Everolimus for Advanced Renal Cell Carcinoma. N Engl J Med. 2021; 384: 1289-1300.
- Motzer RJ, Tannir NM, McDermott DF, et al. Nivolumab plus Ipilimumab versus Sunitinib in Advanced Renal-Cell Carcinoma. N Engl J Med. 2018; 378: 1277-1290.
- Motzer RJ, Escudier B, McDermott DF, et al. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med. 2015; 373: 1803-1813.
- Motzer RJ, Banchereau R, Hamidi H, et al. Molecular Subsets in Renal Cancer Determine Outcome to Checkpoint and Angiogenesis Blockade. Cancer Cell. 2020; 38: 803-817.e4.
- Motzer RJ, Hutson TE, Tomczak P, et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Engl J Med. 2007; 356: 115-124.
- Powles T, Albiges L, Bex A, et al. ESMO Clinical Practice Guideline update on the use of immunotherapy in early stage and advanced renal cell carcinoma. Ann Oncol. 2021; 32: 1511-1519.
- Rini BI, Plimack ER, Stus V, et al. Pembrolizumab plus Axitinib versus Sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med. 2019; 380: 1116-1127.
- Sternberg CN, Davis ID, Mardiak et al. Pazopanib in locally advanced or metastatic renal cell carcinoma: results of a randomized phase III trial. J Clin Oncol. 2010; 28: 1061-1068.
- Tran J, Ornstein MC. Clinical Review on the Management of Metastatic Renal Cell Carcinoma. JCO Oncol Pract. 2022; 18: 187-196.
- Yang JC, Haworth L, Sherry RM, et al. A randomized trial of bevacizumab, an anti-vascular endothelial growth factor antibody, for metastatic renal cancer. N Engl J Med. 2003; 349: 427-434.
CMJ 2022; 2: 112-115