Εισαγωγή
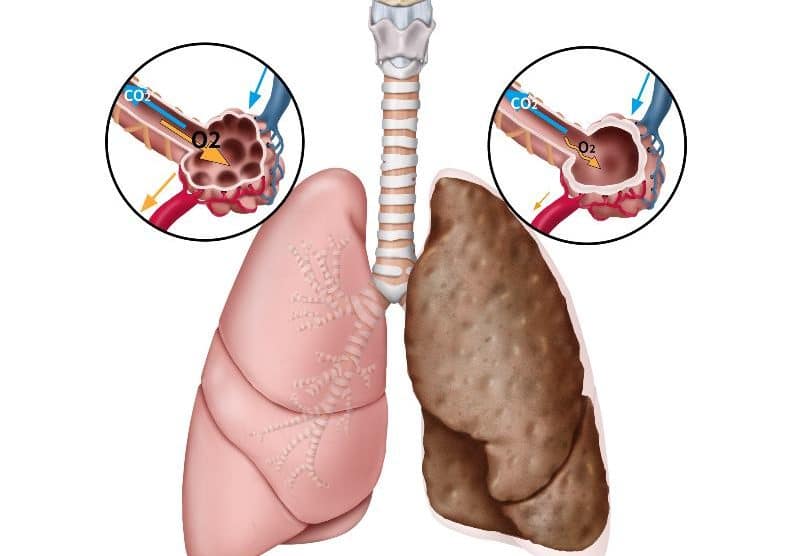
Η ιδιοπαθής πνευμονική ίνωση (idiopathic pulmonary fibrosis, IPF), είναι μια από τις πιο συχνές διάμεσες πνευμονοπάθειες (interstitial lung disease, ILDs) οι οποίες ανέρχονται περίπου σε 500 διαφορετικές οντότητες γνωστής ή άγνωστης (ιδιοπαθείς διάμεσες πνευμονίες) αιτιολογίας (Εικόνα 1), οι οποίες προσβάλλουν κυρίως τον διάμεσο χώρο μεταξύ των κυψελίδων και των περιβαλλόντων τριχοειδών του πνεύμονος. Σημαντική πρόοδος έχει σημειωθεί στην κατανόηση και διαχείριση της IPF τα τελευταία χρόνια.
Επιδημιολογία
Τα επιδημιολογικά δεδομένα για το IPF ποικίλλουν λόγω των διαφορετικών μεθόδων συλλογής δεδομένων παγκοσμίως. Σε όλη την Ευρώπη και τη Βόρεια Αμερική, η εκτιμώμενη επίπτωση της IPF κυμαίνεται από 2,8 έως 19 περιπτώσεις ανά 100.000 άτομα ετησίως. Ο επιπολασμός της IPF αυξάνεται με την ηλικία. Οι ασθενείς συνήθως βρίσκονται στην έκτη και έβδομη δεκαετία της ζωής κατά την παρουσίαση. Οι ασθενείς που είναι μικρότεροι των 50 ετών κατά τη διάγνωση είναι σπάνιοι, μπορεί να έχουν οικογενή IPF ή μπορεί στη συνέχεια να εκδηλώσουν χαρακτηριστικά νόσου του συνδετικού ιστού που ήταν υποκλινική κατά την πρώτη εμφάνιση. Η πάθηση είναι πιο συχνή στους άνδρες.
Παθογένεση
Η παθογένεση της IPF είναι ασαφής αλλά πιθανότατα προκύπτει από τη δυναμική αλληλεπίδραση γενετικών, επιγενετικών και περιβαλλοντικών παραγόντων κινδύνου. Η γενετική προδιάθεση προκύπτει από γονιδιακές μεταλλάξεις (π.χ. πολυμορφισμός MUC5B) ή συνδυασμό κοινών παραλλαγών γονιδίων. Η γνωστή περιβαλλοντική έκθεση περιλαμβάνει τον καπνό του τσιγάρου και τους ιούς. Η μικροαναρρόφηση του γαστρικού περιεχομένου στον πνεύμονα είναι μια άλλη πιθανή αιτία πνευμονικής βλάβης, με τον επιπολασμό της γαστροοισοφαγικής παλινδρόμησης να είναι αυξημένος. Ένας αριθμός μηχανισμών που σχετίζονται με τη γήρανση έχουν εμπλακεί, συμπεριλαμβανομένης της γενετικής αστάθειας, της μη φυσιολογικής βράχυνσης των τελομερών, της δυσλειτουργίας των μιτοχονδρίων και της κυτταρικής γήρανσης. Αυτό έχει ως αποτέλεσμα μη φυσιολογικές φαινοτυπικές και λειτουργικές αλλαγές στον αεραγωγό και στο κυψελιδικό επιθήλιο. Το ενεργοποιημένο δυσλειτουργικό επιθήλιο απελευθερώνει μεσολαβητές, οδηγώντας στη μετανάστευση, τον πολλαπλασιασμό και την ενεργοποίηση των μεσεγχυματικών κυττάρων, οι οποίοι οργανώνονται σε εστίες ινοβλαστών (fibroblastic foci) και μυοϊνοβλαστών, οι οποίοι είναι υπεύθυνοι για την έκκριση υπερβολικής εξωκυτταρικής θεμέλιας ουσίας και κολλαγόνου με συνέπεια την καταστροφή της αρχιτεκτονικής δομής των λειτουργικών μονάδων του πνεύμονος και την ουλώδη απεικόνιση (Εικόνα 2).
Κλινική Εικόνα
Η δύσπνοια κατά την άσκηση είναι συνήθως το πρώτο χαρακτηριστικό της IPF. Παρουσιάζεται ύπουλα, με σταδιακή εξέλιξη σε διάστημα μηνών έως ετών. Οι ασθενείς μπορούν να παρατηρήσουν μειωμένη αντοχή στην άσκηση. Ο επίμονος ξηρός βήχας είναι ένα άλλο κύριο χαρακτηριστικό. Τα αρχικά συμπτώματα αποδίδονται συχνά σε γήρανση, έλλειψη άσκησης ή άλλες συννοσηρότητες, οι οποίες μπορεί να οδηγήσουν σε καθυστερημένη διάγνωση. Οι ασθενείς μπορεί να έχουν μη ειδικά συμπτώματα έως και πέντε χρόνια πριν γίνει η διάγνωση. Οι συνήθεις εσφαλμένες διαγνώσεις περιλαμβάνουν τη χρόνια αποφρακτική πνευμονοπάθεια (ΧΑΠ), το άσθμα και τη συμφορητική καρδιακή ανεπάρκεια. Οι λεπτοί τελοεισπνευστικοί μη μουσικοί ρόγχοι, που μοιάζουν με velcro, ακούγονται κυρίως στο κάτω και πλάγιο θωρακικό τοίχωμα (Εικόνα 3). Τα ακροαστικά αυτά είναι από τα πιο πρώιμα ευρήματα από την αντικειμενική εξέταση. Η πληκτροδακτυλία (clubbing) είναι ένα συχνό εύρημα (30-50%). Καθώς η νόσος εξελίσσεται και αναπτύσσεται αναπνευστική ανεπάρκεια, μπορεί να είναι εμφανής η κεντρική κυάνωση. Η έλλειψη ειδικών κλινικών ευρημάτων και η συνύπαρξη άλλων καταστάσεων μπορεί να καθυστερήσει τη διάγνωση της IPF, η οποία έχει αρνητικό αντίκτυπο στην επιβίωση των ασθενών. Απαιτείται αυξημένη ευαισθητοποίηση και γνώση των διάμεσων πνευμονοπαθειών για τη βελτίωση της έγκαιρης διάγνωσης και θεραπείας.
Εργαστηριακή Διερεύνηση
Η ακτινογραφία θώρακος είναι μια πολύ χρήσιμη πρώτη ακτινολογική εξέταση όταν ένας ασθενής παρουσιάζει συμπτώματα δύσπνοιας και βήχα. Είναι σημαντικό να σημειωθεί ότι η ακτινογραφία θώρακος στερείται διαγνωστικής εξειδίκευσης για την IPF, αλλά είναι χρήσιμη για τον αποκλεισμό άλλων αιτιών δύσπνοιας. Μπορεί να είναι φυσιολογική (10%) ή να δείχνει μη ειδικά ευρήματα στην αρχή της πορείας της νόσου. Καθώς η IPF εξελίσσεται, τα κύρια ευρήματα της ακτινογραφίας θώρακα είναι μειωμένοι εισπνευστικοί όγκοι πνευμόνων, αμφοτερόπλευρη δικτυωτή θολερότητα, με βασική και περιφερική επικράτηση.
Οι δοκιμασίες της πνευμονικής λειτουργίας (PFTs) θα δείξουν μια περιοριστική εικόνα. Αυτό είναι εμφανές από τους μειωμένους όγκους των πνευμόνων, όπως προσδιορίζεται από μια μέτρηση της ολικής χωρητικότητας των πνευμόνων (TLC) μικρότερη από 80% της προβλεπόμενης. Η δυναμική ζωτική χωρητικότητα (FVC) είναι τυπικά μειωμένη, μαζί με μειωμένη ικανότητα διάχυσης του πνεύμονα για μονοξείδιο του άνθρακα (DLCO), υποδηλώνοντας μειωμένη ανταλλαγή αερίων. Ωστόσο, είναι σημαντικό να θυμόμαστε ότι η σπιρομέτρηση και οι μετρήσεις του όγκου των πνευμόνων μπορεί να είναι φυσιολογικές, ιδιαίτερα κατά τα αρχικά στάδια της νόσου ή όταν υπάρχει ταυτόχρονο εμφύσημα. Εάν υπάρχει υποψία διάμεσης πνευμονοπάθειας από το ιστορικό, τη φυσική εξέταση και τις αρχικές εξετάσεις, θα πρέπει να πραγματοποιηθεί αξονική τομογραφία υψηλής ανάλυσης (HRCT).
Η HRCT θώρακα (τομές 1 mm, αλγόριθμος ανασύνθεσης υψηλής ευκρίνειας) χωρίς σκιαγραφικό, σε στεφανιαίο και οβελιαίο επίπεδο, σε εισπνοή και εκπνοή, θα καθορίσει εάν υπάρχει ILD και μπορεί να εντοπίσει συγκεκριμένα ακτινολογικά πρότυπα (4 πρότυπα: τυπικό UIP, συμβατό με UIP, ακαθόριστο ή διαγνωστικό άλλης ILD) που θα βοηθήσουν τον κλινικό ιατρό να περιορίσει τη διαφορική διάγνωση. Το εύρημα της κηρήθρας (honeycombing) με ή χωρίς βρογχεκτασίες εξ έλξεως (traction bronchiectasis) σε υποϋπεζωκοτική και βασική κατανομή είναι σύμφωνο με την τυπική «συνήθη διάμεση πνευμονία» (UIP), που θεωρείται το χαρακτηριστικό ακτινολογικό πρότυπο της IPF (Εικόνα 4).
Η HRCT είναι βασική εξέταση στη διάγνωση και παρακολούθηση των ILDs. Περιορίζει το διαγνωστικό φάσμα, διαχωρίζει τις τυπικές περιπτώσεις που δεν χρειάζεται βιοψία πνεύμονος, συμβάλλει στην πρώιμη διάγνωση, στην μελέτη της έκτασης της νόσου, στην ανάδειξη συνοδών νοσημάτων (εμφύσημα, καρκίνος) θέτει τη σωστή διάγνωση στο 60-80%.
Η θετική προγνωστική αξία της ακτινολογικής διάγνωσης της UIP για μια παθολογοανατομική διάγνωση της UIP είναι μεταξύ 90 – 100%. Μικρή λεμφαδενοπάθεια του μεσοθωρακίου μπορεί να είναι παρούσα σε ασθενείς με IPF, ασύμμετρη πνευμονική νόσος μπορεί να εμφανιστεί έως και στο 25% των περιπτώσεων.
Διάγνωση
Για τη διάγνωση της IPF είναι απαραίτητος ο αποκλεισμός άλλων γνωστών αιτιών ILD, όπως η έκθεση στο περιβάλλον (π.χ., αμίαντος, οργανικές ουσίες), παθήσεων του συνδετικού ιστού και τοξικότητα των φαρμάκων. Απαιτείται ένα λεπτομερές ιστορικό τόσο της χρήσης φαρμάκων όσο και των εκθέσεων στο σπίτι, την εργασία και άλλα μέρη που επισκέπτεται συχνά ο ασθενής. Απαιτείται επίσης ενδελεχής φυσική εξέταση αναζητώντας κλινικά σημεία παθήσεων του συνδετικού ιστού (π.χ. χέρια μηχανικού, ερύθημα προσώπου, φαινόμενο Raynaud, δακτυλικά έλκη, Gottron papules).
H βρογχοσκόπηση και το βρογχοκυψελιδικό έκπλυμα (BAL) μπορεί να βοηθήσουν στον αποκλεισμό άλλων παθήσεων (πνευμονίτιδα από υπερευαισθησία, ηωσινοφιλικά σύνδρομα, αμιάντωση, κλπ.).
Η χειρουργική βιοψία πνεύμονα (βιντεοσκοπική ή κρυοβιοψία) μπορεί να είναι απαραίτητη σε μη τυπικές περιπτώσεις μετά από διεπιστημονικό συμβούλιο. Ειδικός παθολογοανατόμος θώρακος απαιτείται για την ορθή διάγνωση, δεύτερη γνώμη μπορεί να απαιτηθεί από ειδικό κέντρο αναφοράς.
Διεπιστημονικό Συμβούλιο
Για να τεθεί η ορθή διάγνωση της IPF, ιδίως σε μη τυπικές περιπτώσεις, και για να αποκλειστούν άλλες ILD ή επικαλυπτόμενες καταστάσεις, απαιτείται συζήτηση με διεπιστημονική ομάδα (MDT), στην οποία συμμετέχουν, κατά τα πρότυπα του ογκολογικού συμβουλίου, ο θεράπων κλινικός, και ειδικός ακτινολόγος, ο ειδικός παθολογοανατόμος θώρακος, και κατά περίπτωση ρευματολόγος, ιδανικά σε εξειδικευμένα κέντρα ILD .
Αντιμετώπιση
Η διαχείριση των ασθενών με IPF περιλαμβάνει τη βελτίωση των συμπτωμάτων, τη διατήρηση της πνευμονικής λειτουργίας, τη βελτίωση της ποιότητας της ζωής, την ελαχιστοποίηση των αρνητικών επιπτώσεων της θεραπείας και ιδανικά, τη βελτίωση της επιβίωσης.
Φαρμακολογική Θεραπεία
Δύο αντιινωτικά φάρμακα εγκρίθηκαν για θεραπεία με IPF από τον ΕΜΑ και τον FDA, συγκεκριμένα η πιρφενιδόνη και η νιντεδανίμπη, φάρμακα που επιβραδύνουν την εξέλιξη της νόσου.
Η Pirfenidone (Esbriet™) είναι ένα αντιινωτικό φάρμακο που μειώνει τον πολλαπλασιασμό των ινοβλαστών και τη συσσώρευση κολλαγόνου. Μειώνει τον ρυθμό μείωσης της FVC, και βελτιώνει την επιβίωση. Θα πρέπει να λαμβάνεται τρεις φορές την ημέρα με τροφή σε μια δόση (801 mg) που τιτλοποιείται προς τα πάνω σε μια περίοδο 14 ημερών. Απαιτούνται εξετάσεις ηπατικής λειτουργίας κατά την έναρξη και τακτικά στη συνέχεια. Οι παρενέργειες περιλαμβάνουν φωτοευαισθησία, εξάνθημα και γαστρεντερική δυσφορία. Συνιστάται στους ασθενείς να αποφεύγουν την έκθεση στον ήλιο και να φορούν αντηλιακή προστασία. Εάν αναπτυχθούν παρενέργειες ή/και ηπατοτοξικότητα, η δόση της πιρφενιδόνης μπορεί να μειωθεί ή να διακοπεί προσωρινά και να επανεισαχθεί σε πιο αργή τιτλοδότηση δόσης. Η πιρφενιδόνη μεταβολίζεται από τα ένζυμα του κυτοχρώματος P450 1A2 (CYP1A2) και θα πρέπει να αποφεύγεται ή να χρησιμοποιείται με εξαιρετική προσοχή εάν ο ασθενής χρησιμοποιεί επίσης άλλους αναστολείς του CYP12A (π.χ. σιπροφλοξασίνη,) ή επαγωγείς (π.χ. ομεπραζόλη, rifampicin). Επίσης αντενδείκνυται η χρήση fluvoxamine.
Η Nintedanib (Ofev™) είναι ένας αναστολέας της τυροσινικής κινάσης, με αναστολή του υποδοχέα του αυξητικού παράγοντα που προέρχεται από αιμοπετάλια (PDGF), του υποδοχέα του αυξητικού παράγοντα ινοβλαστών (FGF) και του υποδοχέα του αγγειακού ενδοθηλιακού αυξητικού παράγοντα (VEGF). Μειώνει το ρυθμό μείωσης της FVC και μειώνει το χρόνο μέχρι την πρώτη οξεία έξαρση της IPF. Έχει επίσης αποδείξει αποτελεσματικότητα σε ένα ευρύ φάσμα προοδευτικών ινωτικών ILDs. Η δόση της nintedanib είναι 150 mg από το στόμα δύο φορές την ημέρα. Απαιτούνται εξετάσεις ηπατικής λειτουργίας κατά την έναρξη και τακτικά στη συνέχεια. Οι παρενέργειες περιλαμβάνουν διάρροια και ναυτία. Λόγω του μηχανισμού δράσης της, οι ασθενείς που λαμβάνουν από του στόματος αντιπηκτική αγωγή θα πρέπει να λαμβάνουν θεραπεία με nintedanib εάν το αναμενόμενο όφελος υπερτερεί του κινδύνου και θα πρέπει να παρακολουθούνται στενά για κίνδυνο αιμορραγίας.
Η επιλογή ενός αντιινωτικού έναντι ενός άλλου μπορεί να είναι δύσκολη για τον κλινικό ιατρό, λόγω της απουσίας κλινικών δοκιμών head to head. Οι αποφάσεις σχετικά με τα αντιινωτικά πρέπει να βασίζονται σε αυτό που είναι πιο κατάλληλο για τον κάθε ασθενή. Προς το παρόν, τα φάρμακα δεν χορηγούνται σε συνδυασμό.
H κορτιζόνη δεν έχει πλέον θέση στην θεραπεία της IPF. Μεγάλη κλινική μελέτη έδειξε ότι η χρήση της αυξάνει την θνησιμότητα! (Panther trial, NEJM 2012). Σήμερα ένας αριθμός κλινικών μελετών με νέα μόρια βρίσκεται σε εξέλιξη.
Μη Φαρμακολογική Αγωγή
Περιλαμβάνει τη διακοπή του καπνίσματος, εμβολιασμούς, τη διάγνωση και τη διαχείριση του άγχους και της κατάθλιψης, τη διαχείριση βάρους και διατροφής Η πνευμονική αποκατάσταση είναι μια ολοκληρωμένη παρέμβαση που έχει σχεδιαστεί για τη βελτίωση της σωματικής και ψυχολογικής κατάστασης των ασθενών με χρόνια προχωρημένη πνευμονοπάθεια μέσω της προπόνησης των αναπνευστικών μυών και της άσκησης. Η πνευμονική αποκατάσταση αυξάνει την ανοχή στην άσκηση και την ποιότητα ζωής.
Ασθενείς με σημαντική υποξαιμία ηρεμίας (κορεσμός οξυγόνου < 88%) θα πρέπει να λαμβάνουν χρόνια οξυγονοθεραπεία (LTOT). Πολλοί ασθενείς με IPF έχουν φυσιολογικούς κορεσμούς οξυγόνου σε κατάσταση ηρεμίας αλλά γρήγορο αποκορεσμό κατά την άσκηση. Η χρήση φορητού οξυγόνου κατά την κινητοποίηση μπορεί να βελτιώσει την ικανότητα άσκησης και να ανακουφίσει από τη δύσπνοια. Ενώ η μικροαναρρόφηση του γαστρικού περιεχομένου στον πνεύμονα έχει εμπλακεί στην αιτιολογία της IPF, η αντιόξινη θεραπεία απέτυχε να αποδείξει κανένα όφελος και στην πραγματικότητα, μπορεί να συσχετιστεί με αυξημένες λοιμώξεις του αναπνευστικού. Επομένως, η θεραπεία που κατευθύνεται στην παλινδρόμηση θα πρέπει να εξετάζεται σε ατομική βάση εάν ο ασθενής έχει συμπτώματα παλινδρόμησης και σύμφωνα με τις υπό δημοσίευση νεότερες διεθνείς οδηγίες η επιτροπή μας δεν συστήνει την χρήση γαστροπροστατευτικών, λόγω ανεπαρκών υποστηρικτικών δημοσιεύσεων.
Η υποστήριξη και η εκπαίδευση των ασθενών είναι απαραίτητη. Ο Ελληνικός Σύλλογος Πνευμονικής Ίνωσης, o οποίος συστήθηκε κατόπιν παρότρυνσής μας, παρέχει υποστήριξη στους ασθενείς και τις οικογένειές τους.
Παρακολούθηση
Μόλις διαγνωστεί ένας ασθενής και ξεκινήσει η κατάλληλη θεραπεία, είναι απαραίτητη η τακτική ανά 3-4 μήνες επανεξέταση από ειδικούς. Τα συμπτώματα παρακολουθούνται στενά. Ενημερώνονται οι ασθενείς ότι, ενώ τα αντιινωτικά φάρμακα επιβραδύνουν τον ρυθμό μείωσης της FVC, τα συμπτώματά τους θα επιμείνουν και πιθανόν να επιδεινωθούν. Οι δοκιμασίες της πνευμονικής λειτουργίας εκτελούνται σε τακτά χρονικά διαστήματα (3-4 μήνες). Μια μείωση της FVC σε διάστημα 6-12 μηνών είναι ένας αξιόπιστος προγνωστικός δείκτης θνησιμότητας στην IPF. Οι μειώσεις του DLCO σχετίζονται επίσης με μειωμένη επιβίωση, αλλά έχουν μικρότερη αναπαραγωγιμότητα από την FVC. Η δοκιμασία βάδισης 6 λεπτών είναι χρήσιμη εξέταση, όπως και τα ερωτηματολόγια ποιότητας ζωής.
Αξιολόγηση για Μεταμόσχευση Πνεύμονα
Η μεταμόσχευση πνεύμονα αναγνωρίζεται ως η μόνη αποτελεσματική θεραπεία για την IPF. Απαιτείται η κατάλληλη και έγκαιρη παραπομπή στο Εθνικό Κέντρο Μεταμοσχεύσεων Πνεύμονα. Οι ηλικιωμένοι ασθενείς έχουν συχνά συννοσηρότητες που αποκλείουν τη μεταμόσχευση, αλλά οι αποφάσεις θα πρέπει να λαμβάνονται κατά περίπτωση, δεδομένης της έλλειψης μοσχευμάτων. Στη χώρα μας άρχισε η διενέργεια μεταμοσχεύσεως πνεύμονος.
Συννοσηρότητες
Ασθενείς με IPF έχουν αυξημένα ποσοστά καρκίνου του πνεύμονα, με τον επιπολασμό ο καρκίνος του πνεύμονα στην IPF να κυμαίνεται περίπου στο 10%. Ο καρκίνος του πνεύμονα αναπτύσσεται συνήθως στα περιφερικά μέρη των κάτω λοβών, δίπλα σε περιοχές της UIP. Η διάκριση μεταξύ κακοήθειας και περιοχών συρρέουσας ίνωσης μπορεί να είναι δύσκολη, ειδικά εάν δεν είναι διαθέσιμη προηγούμενη απεικόνιση. Για την έγκαιρη διάγνωση απαιτείται ετήσιος έλεγχος με HRCT.
Η επιβίωση ανέρχεται σε 3 έως 5 έτη από τη διάγνωση. Ωστόσο, η πρόγνωση είναι κυμαινόμενη με ορισμένους ασθενείς να επιβιώνουν και 10 έτη ανάλογα με το στάδιο της νόσου.
Οξείες Παροξύνσεις
Ενώ η πλειονότητα των ασθενών με IPF εμφανίζει σταδιακή επιδείνωση των συμπτωμάτων με την πάροδο του χρόνου, μια σημαντική μειοψηφία ασθενών εμφανίζει επεισόδια οξείας επιδείνωσης των αναπνευστικών συμπτωμάτων χωρίς αναγνωρίσιμη αιτία. Μια οξεία έξαρση της IPF πιθανότατα πυροδοτείται από ένα οξύ συμβάν (π.χ., λοίμωξη του αναπνευστικού, μικροεισρόφηση, μηχανική τάση κατά την γενική αναισθησία), που οδηγεί σε εκτεταμένη οξεία βλάβη του πνεύμονα (που χαρακτηρίζεται από σχηματισμό υαλώδους μεμβράνης και διάμεσο οίδημα), η οποία μπορεί επίσης να επισπεύσει την επιτάχυνση της υποκείμενης ινωτικής διαδικασίας. Δεν υπάρχουν αποδεδειγμένα αποτελεσματικές θεραπείες για τις οξείες παροξύνσεις της IPF. Πολλοί ασθενείς λαμβάνουν συστηματικά στεροειδή χωρίς αποδεικτικά στοιχεία, η οποία σε πολλές περιπτώσεις μπορεί να είναι και καταστροφική. Συμπληρωματικό οξυγόνο χορηγείται για τη διόρθωση της υποξαιμίας. Η εκτιμώμενη ενδονοσοκομειακή θνησιμότητα είναι έως και 90%, διπλάσια εκείνης του ARDS γνωστής αιτιολογίας. Ο μηχανικός αερισμός έχει υψηλό ποσοστό θνησιμότητας. Εάν δεν υπάρχει ξεκάθαρη αναστρέψιμη αιτία, δεν συνιστάται η τοποθέτηση του ασθενούς σε μηχανικό αερισμό. Η μη επεμβατική αναπνευστική υποστήριξη, όπως ο μη επεμβατικός αερισμός και η ρινική οξυγονοθεραπεία υψηλής ροής, μπορεί να παρασχεθεί ως το ανώτατο όριο της φροντίδας.
Συμπέρασμα
Η γνώση γύρω από την IPF έχει επεκταθεί πολύ τα τελευταία δέκα χρόνια. Η βέλτιστη διαχείριση περιλαμβάνει την έγκαιρη διάγνωση μέσω της εισαγωγής MDT και την απόφαση για την κατάλληλη θεραπεία. Οι αποφάσεις διαχείρισης περιλαμβάνουν και την τις επιθυμίες και τις προσδοκίες των ασθενών. Η θεραπεία απαιτεί εξέταση των παρενεργειών του φαρμάκου, πιθανές αλληλεπιδράσεις φαρμάκων, εξέταση του βέλτιστου χρόνου για αξιολόγηση μεταμόσχευσης πνεύμονα και αναγνώριση του πότε μπορεί να είναι σκόπιμο να αποσυρθεί η παρέμβαση και να εισαχθούν μέτρα παρηγορητικής φροντίδας. Οι συννοσηρότητες είναι συχνές και απαιτούν ανάλογη αντιμετώπιση. Απαιτούνται περισσότερες μελέτες για την αξιολόγηση των βέλτιστων θεραπειών για οξείες παροξύνσεις της IPF και για την ανάπτυξη βέλτιστων θεραπειών για την ανάσχεση ή ακόμη και την αναστροφή της προοδευτικής ίνωσης. Απαραίτητη είναι η ανάγκη διεθνών συνεργασιών, η προώθηση μεγάλων βάσεων δεδομένων, η αξιοποίηση της τεχνητής νοημοσύνης και των μεγάλων δεδομένων για την διερεύνηση αναπάντητων ερωτημάτων αναφορικά με την παθογένεια της νόσου και την ανάπτυξη νέων θεραπευτικών προσεγγίσεων.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Raghu G, Remy-Jardin M, Myers JL, et al. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med. 2018; 198: e44-e68.
- Raghu G, Remy-Jardin M, Myers JL, et al. Idiopathic pulmonary fibrosis (an update) and progressive pulmonary fibrosis in adults. An Official ATS / ERS / JRS / ALAT Clinical Practice Guideline. Am J Respir Crit Care Med. 2022 (In press).
- An official American Thoracic Society/European Respiratory Society statement: update of the international multidisciplinary classification of the idiopathic interstitial pneumonias Am J Respir Crit Care Med. 2013;188: 733-748
- Epidemiology of interstitial lung diseases in Greece. Hellenic Interstitial Lung Diseases Group. Respir Med. 2009; 103:1122-1129.
- Bouros D. Pirfenidone for idiopathic pulmonary fibrosis. Lancet. 2011; 377: 1727-1729. doi:10.1016/S0140-6736(11)60546-1.
- Bouros D, Tzilas V, Tzouvelekis A. Diagnostic guidelines for IPF: when art meets science. Lancet Respir Med. 2018; 6:812-814. DOI: https://doi.org/10.1016/S2213-2600(18)30430-2
- Bouros D, Tzouvelekis A. Idiopathic pulmonary fibrosis: on the move. Lancet Respir Med. 2014; 2: 17-19
- Kotsianidis I, Nakou E, Bouchliou I, et al. Global impairment of CD4+CD25+FOXP3+ regulatory T cells in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2009. PMID: 19342412
- Tzouvelekis A, Karampitsakos T, Kontou M, et al. Safety and efficacy of nintedanib in idiopathic pulmonary fibrosis: A real-life observational study in Greece. Pulm Pharmacol Ther. 2018; 49: 61-66
- Tzouvelekis A, Spagnolo P, Bonella F, et al. Patients with IPF and lung cancer: diagnosis and management. Lancet Respir Med. 2018; 6: 86-88. PMID: 29241977
- Tzouvelekis A, Karampitsakos T, Gomatou G, et al. Lung cancer in patients with Idiopathic Pulmonary Fibrosis. A retrospective multicenter study in Greece. Pulm Pharmacol Ther. 2020; 60: 101880.
- Tzilas V, Tzouveleki A, Chrysikos S, et al. Diagnosis of Idiopathic Pulmonary Fibrosis “Pragmatic Challenges in Clinical Practice”. Front Med (Lausanne). 2017; 4: 151. PMID: 28979896
- Karampitsakos T, Tzilas V, Tringidou R, et al. Lung cancer in patients with idiopathic pulmonary fibrosis. Pulm Pharmacol Ther. 2017; 45: 1-10.
- Tzouvelekis A, Tzilas V, Papiris S, et al. Diagnostic and prognostic challenges in Idiopathic Pulmonary Fibrosis: A patient’s “Q and A” approach. Pulm Pharmacol Ther. 2017; 42: 21-24.
- Walsh SLF, Maher TM, Kolb M, et al. IPF Project Consortium. Diagnostic accuracy of a clinical diagnosis of idiopathic pulmonary fibrosis: an international case-cohort study. Eur Respir J. 2017; 50: 1700936
- Tzouvelekis A, Paspaliaris V, Koliakos G, et al. A prospective, non-randomized, no placebo-controlled, phase Ib clinical trial to study the safety of the adipose derived stromal cells-stromal vascular fraction in idiopathic pulmonary fibrosis. J Transl Med. 2013; 11: 171.
- Mermigkis C, Stagaki E, Tryfon S, et al.. How common is sleep-disordered breathing in patients with idiopathic pulmonary fibrosis? Sleep Breath. 2010; 14: 387-390
- Papiris SA, Kagouridis K, Kolilekas L, et al. Expert Rev Respir Med. 2014; 8: 271-273.