Intravenous Iron Therapy in Patients with Iron Deficiency Anemia: Dosing Considerations
Anemia, Volume 2015, Article ID 763576
Todd A. Koch1, Jennifer Myers2 and Lawrence Tim Goodnough3
1 Luitpold Pharmaceuticals, Inc., Norristown, PA 19403, USA, 2 St. John’s University, Jamaica, NY 11439 USA, 3 Department of Pathology and Medicine (Hematology), Stanford, CA 94305, USA
Σκοπός. Σκοπός του παρόντος είναι η παροχή στους κλινικούς ιατρούς τεκμηριωμένων κατευθυντήριων οδηγιών για τη δοσολογία της θεραπείας σιδήρου σε ασθενείς με σιδηροπενική αναιμία (ΣΑ), πραγματοποιώντας μια μελέτη που εξετάζει τα οφέλη από μια υψηλότερη αθροιστική δόση σιδήρου ενδοφλεβίως (IV) από ό,τι τυπικώς χορηγείται.
Μέθοδος. Πρώτα αναλύθηκαν ξεχωριστά 5 κλινικές μελέτες, οι οποίες μετρούσαν το κατά μέσο όρο συνολικό έλλειμμα σιδήρου σε όλους τους ασθενείς που χρησιμοποιούν ένα τροποποιημένο τύπο Ganzoni. Στη συνέχεια αναλύθηκαν ομοίως 2 μεγαλύτερες κλινικές μελέτες. Για τη δεύτερη από τις μεγαλύτερες μελέτες (Μελέτη 7), αναλύθηκαν η αποτελεσματικότητας και η επανεπεξεργασία της αθροιστικής δόσης των 1500mg καρβοξυμαλτόζης σιδήρου (FCM) έως 1000mg σακχαρόζη σιδήρου (IS).
Αποτελέσματα. Το μέσο έλλειμμα σιδήρου υπολογίστηκε σε 1,531mg για τους ασθενείς στις μελέτες 1-5 και 1392mg για τους ασθενείς στις μελέτες 6-7. Το ποσοστό των ασθενών που έλαβαν επαναληπτικά IV σίδηρο μεταξύ των ημερών 56 και 90 ήταν σημαντικά (???? <0,001) κατώτερο (5,6%) στην ομάδα που έλαβε 1500mg συγκριτικά με την ομάδα που έλαβε 1000 mg (11,1%).
Συμπεράσματα. Τα στοιχεία μας δείχνουν ότι η συνολική αθροιστική δόση 1000mg IV σιδήρου μπορεί να είναι ανεπαρκής για την αναπλήρωση του σιδήρου στην πλειονότητα των ασθενών με ΣΑ και μια δόση 1500mg είναι πλησιέστερα με το πραγματικό έλλειμμα σιδήρου σε αυτούς τους ασθενείς.
- Εισαγωγή
Ο σίδηρος είναι ένα απαραίτητο στοιχείο του οργανισμού και η ισορροπία του πρέπει να διατηρείται για τη σωστή φυσιολογική λειτουργία. Η απώλεια αίματος, ένα σημαντικό αίτιο της ανεπάρκειας σιδήρου, είναι ιδιαίτερα διαδεδομένη (π.χ., γυναίκες με έμμηνο ρύση και ασθενείς με χρόνια λαθραία γαστρεντερική απώλεια αίματος) και απαιτεί σωστή διάγνωση και αντιμετώπιση1-4. Η θεραπευτική αντιμετώπιση της ΣΑ επικεντρώνεται κυρίως στην αναπλήρωση των αποθεμάτων σιδήρου1-4. Αν και τα άτομα με έλλειψη σιδήρου χωρίς φλεγμονή μπορεί να ανταποκριθούν σε θεραπεία με από του στόματος λήψη σιδήρου, η IV χορήγηση σιδήρου είναι ευεργετική σε πολλούς ασθενείς, συμπεριλαμβανομένων εκείνων με φλεγμονή (π.χ., από νεφρική νόσο, καρδιακή ανεπάρκεια ή ρευματικές νόσους), σε ασθενείς που δεν μπορούν να ανεχθούν ή που δεν τηρούν τη θεραπεία με την από του στόματος λήψη σιδήρου5-8. Ακόμη και υπό τις καλύτερες συνθήκες, η από του στόματος λήψη σιδήρου δεν είναι καλά ανεκτή και οι ασθενείς δεν συμμορφώνονται για διάφορους λόγους, συμπεριλαμβανομένων των μη ανεκτών παρενεργειών και την ανάγκη για πολλαπλές ημερήσιες δόσεις9. Η συχνά κακή απορρόφηση του λαμβανομένου σιδήρου από του στόματος μπορεί επιπλέον να συμβάλει στην ελαττωμένη ανταπόκριση του ασθενούς. Η απόκριση εψιδίνης σε αναιμικούς ασθενείς που έχουν φλεγμονώδεις συνθήκες, όπως φλεγμονώδη νόσο του εντέρου, αναστέλλει την γαστρεντερική απορρόφηση του σιδήρου από του στόματος10. Επιπλέον, οι επιπτώσεις της εψιδίνης στην ομοιόσταση του σιδήρου σε ασθενείς με συνυπάρχουσα φλεγμονή (π.χ., κατεσταλμένη ανακύκλωση σιδήρου από το δικτυοενδοθηλιακό σύστημα και αποκλεισμός του μυελού των οστών) μπορεί να περιορίσει τόσο την από του στόματος όσο και την IV αναπλήρωση σιδήρου και μπορεί να χρησιμεύσει στην ερμηνεία γιατί αυτοί οι ασθενείς έχουν ανεπάρκεια σιδήρου παρά τους πολλαπλούς κύκλους θεραπείας6,10,11.
Η αναιμία που σχετίζεται με τον καρκίνο (ΚΣΑ) έχει πολλαπλές αιτιολογίες, συμπεριλαμβανομένων της καταστολής του μυελού η οποία προκαλείται από την χημειοθεραπεία, απώλεια αίματος, λειτουργική ανεπάρκεια σιδήρου, έλλειψη ερυθροποιητίνης εξαιτίας νεφρικής νόσου και συμμετοχή του μυελού με όγκο. Οι πιο συνηθισμένες επιλογές θεραπείας για ΚΣΑ περιλαμβάνουν τη θεραπεία με σίδηρο, παράγοντες ερυθροποιητικής διέγερσης – (ΠΕΔ) και μετάγγιση ερυθρών αιμοσφαιρίων. Οι ανησυχίες για την ασφάλεια καθώς και οι περιορισμοί σχετικά με τη θεραπεία με ΠΕΔ για ΚΣΑ έχουν οδηγήσει σε μη βέλτιστη θεραπεία. Πολλοί πιστεύουν ότι η πιο συνηθισμένη χρήση της IV χορήγησης σιδήρου για την ΚΣΑ και την προκαλούμενη αναιμία από την χημειοθεραπεία (ΑΧ) είναι κατάλληλη ενόψει των υφιστάμενων αποδεικτικών στοιχείων. Οι ογκολογικοί ασθενείς των οποίων η ΑΧ αντιμετωπίζεται με ΠΕΔ ανταποκρίνεται καλύτερα στη θεραπεία με IV χορήγηση σιδήρου συγκριτικά με από του στόματος συμπληρώματα7,13-19.
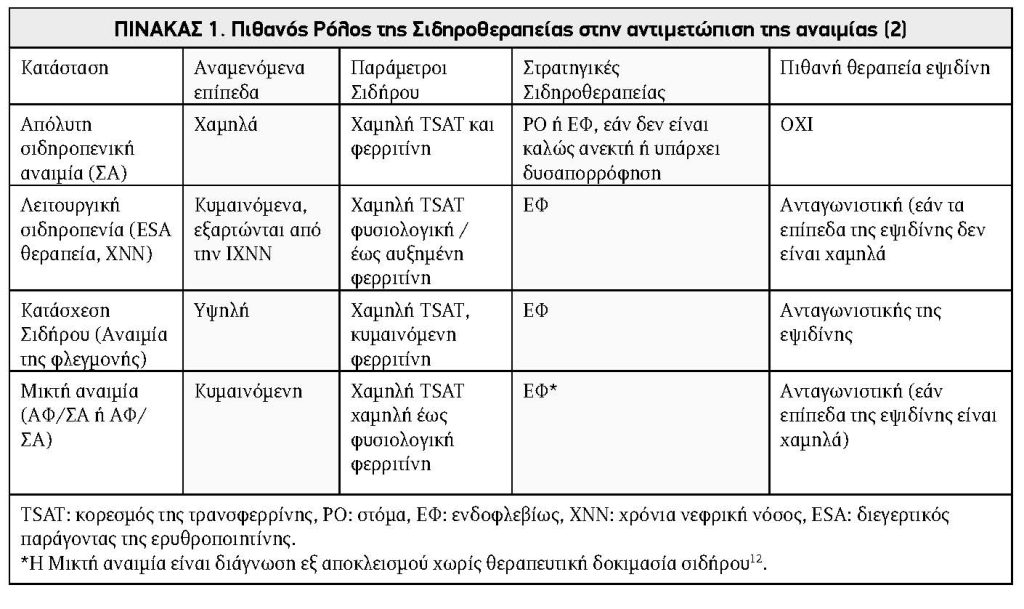
Ο Πίνακας 1 απεικονίζει διάφορες συνθήκες όπου η IV θεραπεία σιδήρου μπορεί να δικαιολογείται.
Παρά τα ευεργετικά αποτελέσματα σε ένα ευρύ φάσμα ασθενών, η IV χορήγηση σιδήρου μπορεί να δημιουργήσει οξειδωτικό στρες και άλλες φλεγμονώδεις αλλαγές και η εικόνα κινδύνου-οφέλους της IV χορήγησης σιδήρου συνεχίζει να βρίσκεται υπό αξιολόγηση σε ασθενείς με νεφρική αιμοκάθαρση20,21 καθώς και σε ασθενείς με αναιμία που οφείλεται σε άλλες χρόνιες νόσους22. Οι μακροπρόθεσμες επιπτώσεις των IV σκευασμάτων σιδήρου θα απαιτήσει περαιτέρω μελέτη σε σχετικές κλινικές συνθήκες23 όπως και οι μακροπρόθεσμες επιβλαβείς επιδράσεις των αλλογενών μεταγγίσεων αίματος24-26.
Το συνολικό έλλειμμα σιδήρου στον οργανισμό του ασθενούς μπορεί να υπολογιστεί με τη χρήση του τύπου Ganzoni (συνολική δόση σιδήρου = [βάρος σώματος × (15 – πραγματική τιμή Hb)] × 2.4 + αποθήκες σιδήρου)32. Επειδή πολλοί θεωρούν αυτόν τον τύπο ενοχλητικό, αυτός δεν χρησιμοποιείται με συνέπεια στην κλινική πράξη37. Αν και η χρήση του τύπου Ganzoni είναι ιδανικά ο καλύτερος τρόπος για την επιλογή της δόσης, αυτός δεν είναι πρακτικός, εν μέρει, επειδή η δοσολογία που αναγράφεται στα προϊόντα αφορά σχήματα συγκεκριμένης δοσολογίας. Στην καθημερινή κλινική πρακτική οι δόσεις επιλέγονται πιο αποτελεσματικά βάσει των εγκεκριμένων δοσολογιών των προϊόντων και των τοπικών πρωτοκόλλων και μόνο για το Dexferrum (ένεση σιδήρου δεξτράνης, USP) και INFeD (ένεση σιδήρου δεξτράνης, USP) οι πληροφορίες βασίζονται στον τύπο Ganzoni για τον υπολογισμό των συνολικών αναγκών σιδήρου του ασθενούς. Υπάρχει, επίσης, μόνο ένας περιορισμένος αριθμός των κατευθυντήριων οδηγιών κλινικής πρακτικής σχετικά με τη χρήση μιας συνολικής αθροιστικής δόσης αναπλήρωσης του IV σιδήρου σε ασθενείς με ΣΑ και η έγκριση από το FDA για πολλά προϊόντα IV χορήγησης σιδήρου αφορά μια συνολική αθροιστική δόση περίπου 1000 mg. Επί του παρόντος, δεν υπάρχει συναίνεση σχετικά με την καταλληλότερη δοσολογία αναπλήρωσης του ελλείμματος σιδήρου σε ασθενείς με ΣΑ, εν μέρει επειδή η δοσολογία του σιδήρου που έχει επιλεγεί για σχεδόν όλες τις δοκιμές έχει βασιστεί σε μεγάλο βαθμό στη κλινική κρίση, στις κλινικές κατευθυντήριες οδηγίες στη νεφρολογία ή σε καλύτερες εκτιμήσεις από τα αποτελέσματα του παρελθόντος. Σε αυτή την αναδρομική μελέτη ερευνήσαμε συστηματικά το έλλειμμα σιδήρου σε ασθενείς οι οποίοι έλαβαν IV σίδηρο σε κλινικές μελέτες και εξετάζονται τα δυνητικά οφέλη (δηλαδή, ομαλοποίηση της Hb και του χρόνο επανάληψης της θεραπείας με IV σίδηρο) της υψηλότερης αθροιστικής δόσης IV σιδήρου από ό, τι συνήθως χορηγείται, με στόχο την παροχή στους κλινικούς ιατρούς, με πρακτικές και βάση στοιχείων, καθοδήγηση για τον προσδιορισμό των δοσολογικών απαιτήσεων σιδήρου για ένα ευρύ φάσμα ασθενών με ΣΑ.
2. Υλικό και Μέθοδος
Σε αυτή τη μελέτη χρησιμοποιήσαμε τον ίδιο πληθυσμό που είχε συμπεριληφθεί σε προηγούμενες κλινικές δοκιμές38-44. Οι μελέτες αυτές έγιναν βάση των ομοσπονδιακών κανονισμών των ΗΠΑ, διεξήχθησαν σύμφωνα με τη Διακήρυξη του Ελσίνκι και τέλος, τα πρωτόκολλα και τα έντυπα ενημέρωσης και συγκατάθεσης εγκρίθηκαν από τα τοπικά ή εθνικά θεσμικά συμβούλια. Όλοι οι συμμετέχοντες σε αυτές τις μελέτες παρείχαν γραπτή συγκατάθεση. Οι φάκελοι των συμμετεχόντων ήταν ανώνυμοι και η ανάγνωσή τους έγινε πριν από την ανάλυση. Στις Μελέτες 1-5 (που συνοψίζονται παρακάτω) το έλλειμμα σιδήρου και η δόση του χορηγούμενου σιδήρου σε κάθε ασθενή (mg) είχε αρχικά υπολογιστεί σύμφωνα με ένα τροποποιημένο τύπο Ganzoni: βάρος σώματος σε kg × [15 – τιμή Hb g/dL] × 2.4 + 500, όπως ορίζεται σε κάθε πρωτόκολλο της μελέτης. Ο τύπος Ganzoni τροποποιήθηκε σε αυτές τις μελέτες για να βοηθήσει στην βελτίωση οποιουδήποτε δυναμικού από την υπερφόρτωση σιδήρου σε άτομα που είχαν κορεσμό τρανσφερίνης (TSAT) > 20% και φερριτίνη > 50ng/mL κατά την εισαγωγή στη μελέτη. Για τα άτομα αυτά έγινε μια συντηρητική εκτίμηση και τα επιπλέον 500 mg από τον τύπο Ganzoni για την αναπλήρωση σιδήρου δεν προστέθηκαν στο σύνολο των απαιτήσεων σιδήρου. Σε κάθε μελέτη χορηγήθηκε σιδήρος IV (σίδηρος καρβοξυμαλτόζη, FCM) ως μια συνολική αθροιστική δόση και οι ασθενείς τυχαιοποιήθηκαν βάση του υπολογιζόμενου ελλείμματος σιδήρου. Κατά την ανάλυση κάθε μελέτης χρησιμοποιήθηκαν οι βασικές τιμές ελλείμματος σιδήρου για κάθε ασθενή χρησιμοποιώντας την ίδια μέθοδο και στη συνέχεια υπολογίστηκε ο μέσος όρος του συνολικού ελλείμματος σιδήρου σε όλους τους ασθενείς. Αυτές οι κλινικές μελέτες εξέτασαν την ΣΑ σε ασθενείς μετά τον τοκετό, σε ασθενείς με βαριά αιμορραγία της μήτρας, χρόνια νεφρική νόσο χωρίς την ανάγκη για αιμοκάθαρση, γαστρεντερικές διαταραχές και άλλες υποκείμενες συνθήκες.
Παρακάτω παρατίθενται σύντομες περιγραφές της κάθε μελέτης:
- Σύγκριση της ασφάλειας και της αποτελεσματικότητας της IV χορήγησης σιδήρου (FCM) και της από του στόματος λήψης σιδήρου (θειϊκού σιδήρου) σε ασθενείς με αναιμία μετά τον τοκετό (Α = 361)38, NCT00396292.
- Σύγκριση της ασφάλειας και της αποτελεσματικότητας της IV χορήγησης σιδήρου (FCM) και της από του στόματος λήψης σιδήρου (θειϊκού σιδήρου) στη θεραπεία της ΣΑ δευτεροπαθώς σε βαριά αιμορραγία της μήτρας (Α = 477)39, NCT00395993.
- Σύγκριση της ασφάλειας και της αποτελεσματικότητας της IV χορήγησης σιδήρου (FCM) και της από του στόματος λήψης σιδήρου (θειϊκού σιδήρου) στη θεραπεία των ασθενών μετά τον τοκετό (Α = 291)40, NCT00354484.
- Σύγκριση της ασφάλειας και της ανεκτικότητας της IV χορήγησης σιδήρου (FCM) και τη συνήθη ιατρική φροντίδα (από του στόματος και IV σιδήρου) στη θεραπεία ΣΑ διαφόρων αιτιολογιών (Α = 708)41, NCT00703937.
- Σύγκριση της ασφάλειας και ανεκτικότητας του IV σιδήρου (FCM) και σιδηροδεξτράνης στη θεραπεία ΣΑ διαφόρων αιτιολοιών (Α = 160)42, NCT00704028.
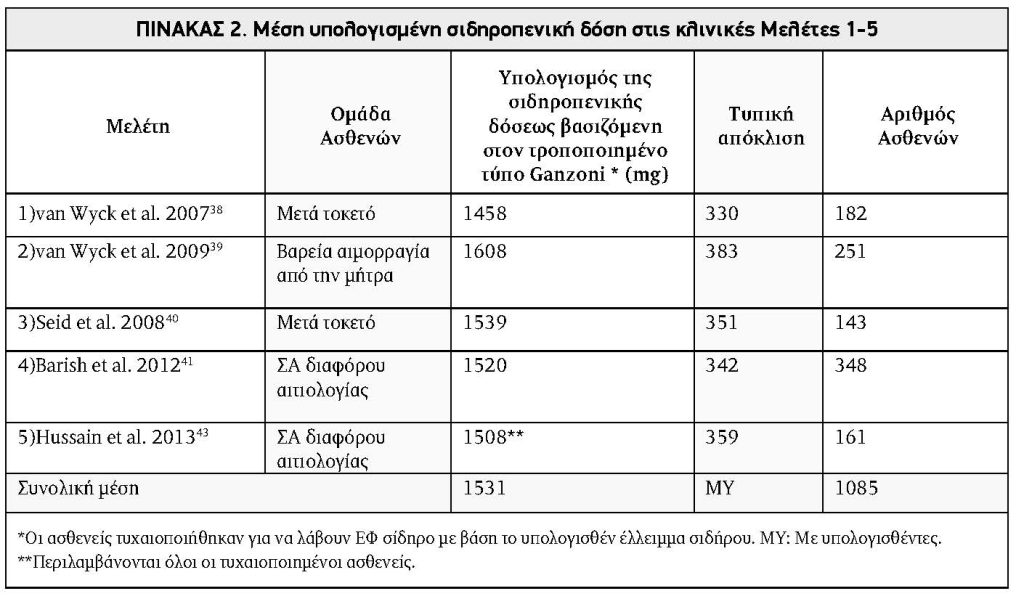
ΠΙΝΑΚΑΣ 2. Μέση υπολογισμένη σιδηροπενική δόση στις κλινικές Μελέτες 1-5
Μετά από επανεξέταση των Μελετών 1-5 εξετάστηκαν δύο μεγαλύτερες μελέτες (6 και 7) οι οποίες χρησιμοποίησαν 1500mg IV σιδήρου (όπως καθορίζεται στα πρωτόκολλα). Παρά το γεγονός ότι ο τροποποιημένος τύπος Ganzoni δεν ορίστηκε λεπτομερώς στα πρωτόκολλα για τον καθορισμό των απαιτούμενων δόσεων σε αυτές τις 2 μελέτες, εφαρμόσαμε τον τύπο Ganzoni για τον προσδιορισμό του ελλείμματος σιδήρου των ασθενών σε μια ξεχωριστή αναδρομική post hoc ανάλυση της κάθε μελέτης. Στη συνέχεια, υπολογίστηκε ο μέσος όρος του συνολικού ελλείμματος σιδήρου σε όλους τους ασθενείς. Επιπλέον, η Μελέτη 7 συνέκρινε την ασφάλεια και την αποτελεσματικότητας της IV χορήγησης σιδήρου 1500 mg (ως FCM) με την IV χορήγηση σιδήρου 1000mg (ως η σακχαρόζη σιδήρου [IS]) εξετάζοντας την αποτελεσματικότητα ή την διαφορά στην ασφάλεια μεταξύ των δύο δοσολογικών σχημάτων. Μια σύντομη περίληψη των Μελετών 6 και 7 είναι η εξής:
- Σύγκριση της IV χορήγησης σιδήρου 1500 mg (FCM) με την από του στόματος χορήγηση σιδήρου και IV χορήγηση σιδήρου φροντίδας (SoC) (όπως προσδιορίζεται από τους ερευνητές) σε ασθενείς με ΣΑ διαφόρων αιτιολογιών που είχαν αρνητική απάντηση στην από του στόματος λήψη σιδήρου ή σε αυτούς που κρίθηκαν ακατάλληλοι για την από του στόματος λήψη σιδήρου43, NCT00982007.
- Σύγκριση της ασφάλειας και της αποτελεσματικότητας της IV χορήγησης σιδήρου 1500mg (FCM) και 1000mg (IS) σε ασθενείς με ΣΑ και χρόνια νεφρική νόσο χωρίς την ανάγκη για αιμοκάθαρση44, NCT00981045.
Στατιστική ανάλυση. Οι βασικές τιμές αναφοράς του ελλείμματος σιδήρου σε κάθε κλινική μελέτη υπολογίστηκαν για όλους τους ασθενείς που τυχαιοποιήθηκαν για να λάβουν IV σίδηρο. Στη Μελέτη 542, το έλλειμμα σιδήρου υπολογίστηκε για όλους τους ασθενείς όπως επίσης και η δοσολογία της σιδηροδεξτράνης με βάση τον τροποποιημένο τύπο Ganzoni και συνοψίστηκε με περιγραφική στατιστική. Για τον υπολογισμό του ελλείμματος σιδήρου στις Μελέτες 6 και 7 συμπεριλήφθηκαν όλα τα υποκείμενα του Πληθυσμού Ασφαλείας. Έγινε ο υπολογισμός του μέσου όρους ελλείμματος σιδήρου και παρήχθη η τυπική απόκλιση.
Στη Μελέτη 7, ο Πληθυσμός Ασφαλείας αποτελούνταν από όλους τους ασθενείς οι οποίοι έλαβαν μία δόση της τυχαιοποιημένης θεραπείας. Ο πληθυσμός προς θεραπεία για την αξιολόγηση όλων των τελικών σημείων αποτελεσματικότητας αποτελούνταν από όλους τους ασθενείς που έλαβαν τουλάχιστον 1 δόση φαρμάκου της τυχαιοποιημένης μελέτης και είχαν τουλάχιστον 1 post-baseline αξιολόγηση της Hb. Η θεραπεία αναλύθηκε σύμφωνα με την πραγματική θεραπεία που έλαβε. Οι διαφορές μεταξύ της δόσης των 1500mg και 1000mg στη Μελέτη 7 αξιολογήθηκαν με το σημείου υπολογισμού και 95% υπολογίστηκε CI για την αναλογία κινδύνου από το Cox μοντέλο αναλογικού κινδύνου. Οι διαφορές της ομάδας θεραπείας εκτιμήθηκαν χρησιμοποιώντας τον αναλογικό κίνδυνο του μοντέλου Cox με τη θεραπεία ως σταθερό παράγοντα. Επιπλέον, οι τιμές ???? για τις διαφορές μεταχείρισης δόθηκαν από την log-rank δοκιμή. Οι time-to-event μεταβλητές εμφανίζονται περιγραφικά ως Καμπύλες κατά Kaplan-Meier.
Όλες οι στατιστικές δοκιμασίες ήταν εκ των υστέρων χωρίς προσαρμογή στον Τύπο Σφάλματος Ι για πολλαπλές συγκρίσεις.
3. Αποτελέσματα
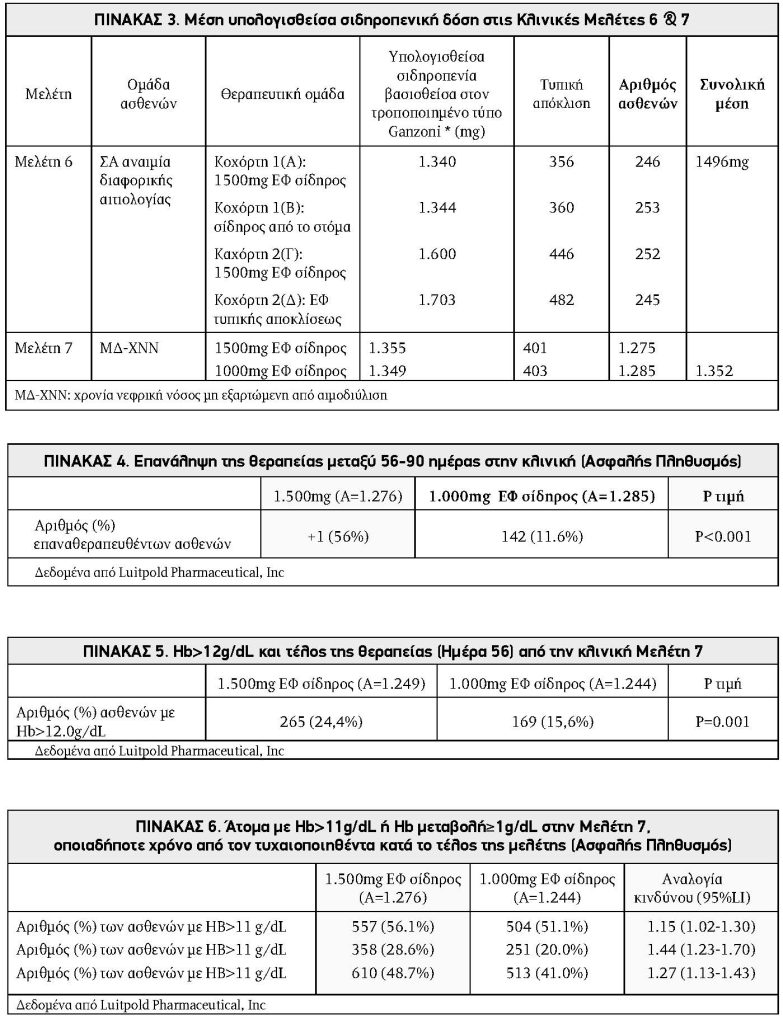
Το μέσο συνολικό έλλειμμα σιδήρου για τους ασθενείς στις 7 μελέτες συνοψίζεται στους Πίνακες 2 και 3. Το συνολικό μέσο του συνολικού ελλείμματος σιδήρου στις αρχικές 5 κλινικές δοκιμές ήταν 1531mg (Πίνακας 2). Οι συνολικές ανάγκες σε σίδηρο μεταξύ των ασθενών σε κάθε ομάδα στις Μελέτες 6 και 7 συνοψίζονται στον Πίνακα 3. Στη Μελέτη 6, το μέσο υπολογιζόμενο έλλειμμα σιδήρου (Κοχόρτη 1 και 2) ήταν 1496mg. Στη Μελέτη 7, το μέσο υπολογιζόμενο έλλειμμα σιδήρου για τους ασθενείς οι οποίοι λαμβάνουν είτε 1500 mg ή 1000 mg ήταν 1352 mg. Το ολικό μέσο συνολικό έλλειμμα σιδήρου για τις κλινικές μελέτες 6 και 7 ήταν 1392 mg.
Στη Μελέτη 7, οι συμμετέχοντες τυχαιοποιήθηκαν ώστε να λάβουν είτε δύο δόσεις 750mg IV σιδήρου (FCM) 7 ημερών ή 200mg χορηγούμενα σε έως 5 εγχύσεις σε διάστημα 14 ημερών. Το πρωτεύον καταληκτικό σημείο αποτελεσματικότητας ήταν η μέση μεταβολή της Hb από την αρχική τιμή έως την υψηλότερη αναφερθείσα τιμή Hb (από της ενάρξεως έως την Ημέρα 56). Οι ασθενείς παρακολουθήθηκαν για την ασφάλεια στην Ημέρα 120. Η μέση συνολική δόση σιδήρου που έλαβαν ήταν 1464 mg στην ομάδα των 1500mg και 963mg στην ομάδα των 1000 mg. Οι μέσες αρχικές τιμές Hb ήταν 10,31g/dL για την ομάδα των 1500mg και 10,32g/dL για την ομάδα των 1000mg.
Σε αυτή τη μελέτη, η μέση αύξηση της Hb συνολικά ήταν 1,13g/dL στην ομάδα των 1500mg και 0,92g/dL την ομάδα των 1000mg (95% CI, 0,13 – 0,28). Επιπλέον, όπως αποδεικνύεται από το 95% CI, μη συμπεριλαμβανομένων των 0, η δόση των 1500 mg ήταν ανώτερη από αυτή των 1000 mg όσον αφορά την αύξηση της Hb.
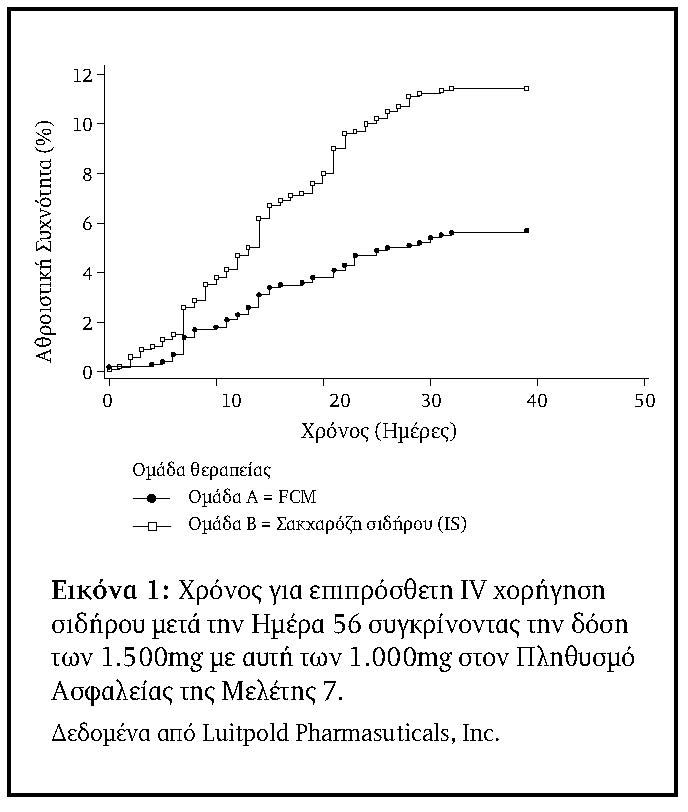
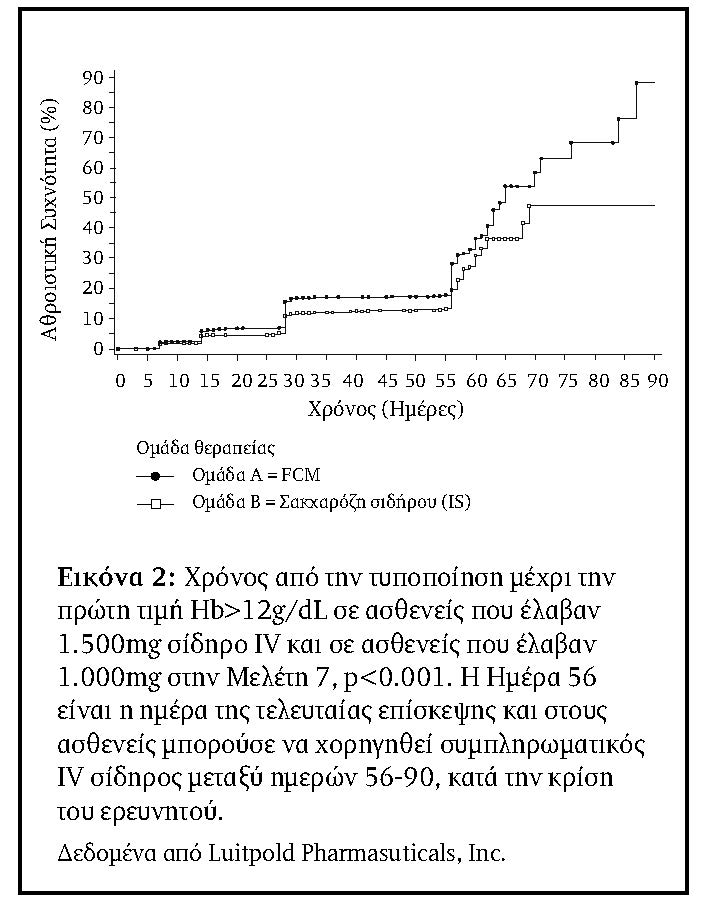
Η αναλογία των ασθενών στην ομάδα των 1500mg και στην οποία επαναχορηγήθηκε IV σίδηρος μεταξύ των Ημερών 56 και 90 (Πληθυσμός Ασφαλείας) ήταν σημαντικά (???? <0.001) χαμηλότερη, 71/1276 (5,6%), από ό,τι οι 142/1285 (11,1%) ασθενείς που απαίτησαν επανάληψη της θεραπείας στην ομάδα των 1000mg (Πίνακας 4). Στην Εικόνα 1 εμφανίζεται η ώρα από την Ημέρα 56 έως την ημέρα ανάγκης επιπλέον IV χορηγήσεως σιδήρου κατά τη σύγκριση των 1500mg και 1000 mg.
Διεξήχθησανpost hoc αναλύσεις ασθενών με Hb>12g/dL στο τέλος της θεραπείας (Ημέρα 56) και του χρόνου για Hb>11g/dL και >12g/dL και αύξηση της Hb ≥1g/dL. Το ποσοστό των ασθενών με Hb>12g/dL κατά το τέλος της θεραπείας (Βασική τιμή στην Ημέρα 56) ήταν 265/1249 στην ομάδα των 1500mg (24,4%) και 169/1244 στην ομάδα των 1000mg (15,6%), ???? = 0,001 (Πίνακας 5).
Οι ασθενείς που έλαβαν 1500mg IV σίδηρο ήταν επίσης πιο πιθανό να έχουν Hb>11g/dL, Hb>12g/dL, ή μια αύξηση στην Hb ≥1g/dl σε σύγκριση με εκείνους που έλαβαν 1000mg (Πίνακας 6). Επιπλέον, ο χρόνος για την πρώτη Hb>11g/dL και >12g/dL και για αύξηση της Hb ≥1g/dL ήταν όλες στατιστικά σημαντικά μικρότερες για την ομάδα των 1500mg από ότι για την ομάδα των 1000mg (???? = 0,013, ???? <0,001, και ???? <0,001, αντίστοιχα.). Το Σχήμα 2 παρουσιάζει την ανάλυση Kaplan-Meier για το χρόνο της πρώτης Hb >12g/dL.
Η συνολική αθροιστική δόση των 1500 mg είχε μια παρόμοια εικόνα ασφαλείας με αυτή των 1000mg της IS, αποδεικνύοντας ότι 50% περισσότερος σίδηρος με τη μορφή FCM μπορεί να χορηγηθεί, ενώ διατηρείται ένα προφίλ ασφάλειας συγκρίσιμο με αυτό του IS44.
4. Συζήτηση
Στις Η.Π.Α., είναι κοινή πρακτική η χορήγηση συνολικής αθροιστικής δόσης περίπου 1000mg IV σιδήρου (σε διαιρεμένες δόσεις) για την αγωγή της ΣΑ. Αυτό οφείλεται, σε μεγάλο μέρος, στη χρήση IV σιδήρου στη νεφρολογία. Τόσο η Kidney Disease Outcomes Quality Initiative (KDOQI) η οποία αρχικά αναπτύχθηκε το 1996 όσο και οι κατευθυντήριες οδηγίες πρακτικής της πιο πρόσφατης Kidney Disease: Improving Global Outcomes (KDIGO) έχουν προβεί σε συστάσεις για τη θεραπεία της ΣΑ με την χρήση IV σιδήρου. Στις τυχαιοποιημένες ελεγχόμενες δοκιμές που εξετάστηκαν για την ανάπτυξη των κατευθυντήριων οδηγιών χρησιμοποιήθηκε μια αθροιστική δόση των 1000mg IV σιδήρου45,46. Παρά το γεγονός ότι αυτή έχει γίνει πλέον η τυπική θεραπευτική δόση για την έλλειψη σιδήρου διαφόρων αιτιολογιών, υπό το φως ενός πλήθους στοιχείων για την ασφάλεια και την αποτελεσματικότητα, μπορεί να μην παρέχει τον κορεσμό του σιδήρου που είναι επαρκής για την αναπλήρωση της ανεπάρκειας σιδήρου, απαιτώντας έτσι επανεπεξεργασία ή την δημιουργία δυνατότητας για μια υποθεραπευτική ανταπόκριση.
Παρά τις συστάσεις αυτές, σε πολλές κλινικές καταστάσεις η θεραπεία της ΣΑ με IV χορήγηση σιδήρου δεν περιορίζεται σε μία αθροιστική δόση των 1000mg. Σε ογκολογικούς ασθενείς, για παράδειγμα, το National Comprehensive Cancer Network (NCCN) ορίζει ότι, αν η υπολογιζόμενη δόση υπερβαίνει τα 1000mg, η υπόλοιπη δόση μπορεί να δοθεί μετά από 4 εβδομάδες, εάν η ανταπόκριση της Hb είναι ανεπαρκής47.
Επιπλέον, σε δύο τυχαιοποιημένες ελεγχόμενες μελέτες που περιέλαβαν συμπληρώματα IV σιδήρου σε ογκολογικούς ασθενείς, συνολικά έως 3000mg σιδήρου χορηγήθηκαν σε εβδομαδιαίες δόσεις των 100mg48. Σε μια άλλη προοπτική, τυχαιοποιημένη, ελεγχόμενη μελέτη, οι ασθενείς με αναιμία σχετιζόμενη με χημειοθεραπεία έλαβαν αθροιστικές δόσεις IV σιδήρου που κυμαίνονταν από 1000 έως 3000mg7.
Οι κατευθυντήριες οδηγίες για τη διαχείριση της ΣΑ σε φλεγμονώδη νόσο του εντέρου, εξάλλου, προτείνουν την IV χορήγηση σιδήρου ως την προτιμώμενη οδό χορηγήσεως και δηλώνουν ότι οι ασθενείς αυτοί σπάνια εμφανίζουν συνολικό έλλειμμα σιδήρου κάτω των 1000mg.
Αυτές οι κατευθυντήριες οδηγίες συνιστούν τη χρήση του τύπου Ganzoni για την εκτίμηση των αναγκών αποκατάστασης σιδήρου και σε ελεγχόμενες δοκιμές, δόσεις μέχρι 3600mg σακχαρόζης σιδήρου έχουν χορηγηθεί με ασφάλεια (μέχρι να TSAT> 50%)49. Μια ανασκόπηση του 2011 από τον Gozzard50 υπογραμμίζει περαιτέρω τις πολυάριθμες κλινικές καταστάσεις που απαιτούν δόσεις IV σιδήρου πνω από μια αθροιστική δόση των 1000mg. Σύμφωνα με τις αποδείξεις που αναφέρονται στις διεθνείς κατευθυντήριες οδηγίες για ασθενείς με φλεγμονώδη νόσο του εντέρου, το άρθρο ορίζει ότι συνολικές δόσεις έως και 3600mg IV σιδήρου μπορεί να χορηγηθούν με ασφάλεια σε αυτούς τους ασθενείς. Η ανασκόπηση προτείνει, επίσης, ότι υψηλότερες δόσεις IV σιδήρου μπορεί να ξεπεράσουν την διαταραχή απορρόφησης σιδήρου η οποία σχετίζεται με αποκλεισμό της εψιδίνης σε αυτούς τους ασθενείς. Σε μια άλλη μελέτη πολλαπλών δόσεων, φάσης ΙΙ/ΙΙΙ, σε ασθενείς με ΣΑ και γαστρεντερικές διαταραχές χορηγήθηκε μέση συνολική αθροιστική δόση 1800mg IV σιδήρου51. Τα κλινικά στοιχεία αναφέρουν επίσης ότι οι ανάγκες σε σίδηρο από 1000 έως 1500mg ή υψηλότερα μπορεί να απαιτούνται σε ασθενείς με χρόνια νεφρική νόσο χωρίς την ανάγκη για αιμοκάθαρση για την επίτευξη του στόχου των επιπέδων φερριτίνης και αιμοσφαιρίνης, έως και 1600mg μπορεί να απαιτούνται σε γυναικολογικούς ασθενείς και μπορεί να απαιτούνται 2000 mg σε ασθενείς με βαριά ή ανώμαλη αιμορραγία εμμήνου ρύσεως50.
Για τον προσδιορισμό της βέλτιστης μέσης χορήγησης σε αυτές τις υψηλότερες δόσεις είναι σημαντικό να σημειωθεί ότι η κινητική υποβάθμιση και ως εκ τούτου η ασφάλεια και τα παρεντερικά προϊόντα σιδήρου έχουν άμεση σχέση με το μοριακό βάρος και τη σταθερότητα του συμπλόκου σιδήρου52-56.
Τα σύμπλοκα αυτά μπορούν να ταξινομηθούν γενικά ως ασταθή ή αυτοδύναμα (κινητική μεταβλητότητα, δηλαδή, πόσο γρήγορα οι συνδέσεις συντονίζονται για την πραγματοποίηση της ανταλλαγής του σιδήρου) και ασθενή ή ισχυρά (θερμοδυναμική μεταβλητότητα, δηλαδή, πόσο έντονα πραγματοποιούνται οι συνδέσεις με το σίδηρο και ως εκ τούτου πόση ενέργεια απαιτείται για τον διαχωρισμό μίας προσθέσεως από το σίδερο) ή οποιαδήποτε ενδιάμεση κατάσταση52. Η αντιδραστικότητα του κάθε συμπλόκου συσχετίζεται αντιστρόφως με το μοριακό βάρος του. Τα μεγαλύτερα σύμπλοκα είναι λιγότερο επιρρεπή στην απελευθέρωση σημαντικών ποσοτήτων ασταθούς σίδηρο ή αντιδρούν άμεσα με την τρανσφερίνη53,54.
Τα τύπου I σύμπλοκα, όπως είναι τα παρασκευάσματα δεξτράνης σιδήρου (INFeD Dexferrum) ή FCM (Injectafer) έχουν υψηλό μοριακό βάρος και μία υψηλή δομική ομοιογένεια και έτσι αποδίδουν τον σίδηρο από το σύμπλοκο προς τρανσφερίνη με ρυθμιζόμενη τρόπο μέσω της ενδοκύττωσης των μακροφάγων και την επακόλουθη ελεγχόμενη απελευθέρωση52,55. Μπορούν επίσης να δεσμεύουν σίδηρο ως μη ιονικό πολυπυρηνικό υδροξείδιο σιδήρου (III) και δεν απελευθερώνουν μεγάλες ποσότητες ιόντων σιδήρου στο αίμα. Τέτοια σύμπλοκα μπορούν να χορηγηθούν ενδοφλεβίως και είναι κλινικώς καλά ανεκτά ακόμη και όταν χορηγούνται σε υψηλές δόσεις. Για τα λιγότερο σταθερά σύμπλοκα σιδήρου, οι μέγιστες εφάπαξ δόσεις είναι σημαντικά χαμηλότερες και οι χρόνοι χορήγησης είναι πλέον δραστικοί 54,56. Ο FCM είναι ένα σταθερού τύπου Ι πολυπυρηνικό υδροξείδιο του σιδήρου (III) με σύνθετους υδατάνθρακες που αποτρέπει τη μερική απελευθέρωση του σιδήρου η οποία παρατηρείται με την φερριτίνη ορού IS επιτρέποντας έτσι τη χορήγηση υψηλών δόσεων, δεδομένου ότι ο σίδηρος αυτός είναι διαθέσιμος μόνο μέσω της δικτυοενδοθηλιακής επεξεργασίας37,57,58. Ο FCM μπορεί να χορηγηθεί ως εφάπαξ δόση 750mg μέσω βραδείας έγχυση IV με ώθηση πάνω από 7,5 λεπτά ή ως IV έγχυση επί τουλάχιστον 15 λεπτά. Η δεύτερη δόση χορηγείται τουλάχιστον 7 ημέρες αργότερα για μια συνιστώμενη αθροιστική δόση των 1500mg σιδήρου36. Η χρήση υψηλών δόσεων μειώνει τον αριθμό των εγχύσεων, επιτρέποντας έτσι την μείωση του κόστους σε σύγκριση με τις πολλαπλές εγχύσεις59-62.
Στη μελέτη μας, ένας τροποποιημένος τύπος Ganzoni χρησιμοποιήθηκε για να υπολογιστεί το συνολικό έλλειμμα σιδήρου σε ασθενείς από τις 5 κλινικές μελέτες που αφορούσαν τον FCM. Μετά την ανάλυση κάθε μελέτης ξεχωριστά, βρέθηκε το συνολικό μέσο έλλειμμα σιδήρου σε αυτές τις δοκιμές να είναι 1531mg, γεγονός που υποδηλώνει ότι οι ασθενείς που έχουν ΣΑ διαφόρων αιτιολογιών μπορεί να ωφεληθούν από την υψηλότερη αθροιστική δόση IV σιδήρου από αυτό που συνήθως χορηγείται στην κλινική πρακτική αξιοποιώντας τα περισσότερα από τα διαθέσιμα σήμερα σκευάσματα IV σιδήρου.
Χρησιμοποιώντας το ίδιο τροποποιημένο τύπο Ganzoni, το ολικό έλλειμμα σιδήρου υπολογίστηκε επίσης σε post hoc αναλύσεις των 2 μεγαλύτερων μελετών (6 και 7), στις οποίες συμμετείχαν ασθενείς με ΣΑ δευτεροπαθώς σε πολυάριθμες υποκείμενες διαταραχές, συμπεριλαμβανομένων βαριάς αιμορραγίας της μήτρας, γαστρεντερικές νόσους και χρόνια νεφρική νόσο. Στη Μελέτη 6, ο μέσος όρος ελλείμματος σιδήρου ήταν 1496mg. Στη Μελέτη 7, ο μέσος όρος ελλείμματος σιδήρου για την ασθενείς που έλαβαν είτε IV σιδήρου 150 mg, ως FCM, ή 1000mg ως IS ήταν 1352mg. Το χαμηλότερο ποσοστό μπορεί να οφείλεται σε υψηλότερες αρχικές τιμές φερριτίνης και κορεσμού αιμοσφαιρίνης στον πληθυσμό με χρόνια νεφρική νόσο, καθώς το 29% των ασθενών δεν είχαν τα 500mg αποθεμάτων σιδήρου που περιλαμβάνονται στον υπολογισμό του ελλείμματος σιδήρου όταν χρησιμοποιήθηκε ο τροποποιημένος τύπος Ganzoni. Συνολικά, ο μέσος όρος ελλείμματος σιδήρου σε ασθενείς από τις μελέτες 6 και 7 ήταν 1392mg.
Τα δεδομένα από την Μελέτη 7 ενίσχυσαν τα οφέλη των υψηλότερων IV δόσεων σιδήρου έτσι ώστε σημαντικά λιγότεροι ασθενείς που έλαβαν μια συνολική αθροιστική δόση των 1500mg σιδήρου χρειάζονταν χορήγηση IV σιδήρου κατά τη διάρκεια της περιόδου παρακολούθησης (Ημέρες 56- 90) συγκριτικά με εκείνους που έλαβαν συνολική αθροιστική δόση 1000mg. Επιπλέον, στους ασθενείς που έλαβαν 1500mg σιδήρου επετευχθεί πρώτη τιμή Hb>11 g/dL και >12g/dL και μια αύξηση της Hb≥1g ταχύτερα από εκείνους που έλαβαν 1000mg. Το εύρημα αυτό υποδηλώνει ότι ασθενείς που έλαβαν 1000mg μπορεί να μην λαμβάνουν πλήρη δόση αναπλήρωσης σιδήρου σε σύγκριση με εκείνους που έλαβαν δόση 1500mg. Η Μελέτη 6 δεν αναλύεται ομοίως επειδή υπήρχαν συγχυτικοί παράγοντες (δηλαδή, μικρό μέγεθος δείγματος και έλλειψη συνεπούς δοσολογίας). Μολονότι οι ασθενείς της Cohort D (IV SoC) μελέτης είχαν τον υψηλότερο μέσο υπολογισμό ελλείμματος σιδήρου (1703mg), η μέση ποσότητα του σιδήρου που έλαβαν ήταν παραδόξως μόνο 812mg. Αυτή η διαφορά μεταξύ του ελλείμματος και της θεραπείας σε ασθενείς που έλαβαν IV SoC μπορεί να οφείλεται, εν μέρει, σε παράγοντες που σχετίζονται με την ευκολία της IV SoC διαθέσιμης δοσολογίας στους ερευνητές κατά τη διάρκεια της μελέτης, καθώς και στην έλλειψη πρακτικής καθοδήγησης για τον προσδιορισμό της δόσης του σιδήρου που απαιτείται.
Σε μια μελέτη που συνέκρινε τον υπολογισμό της δόσης με βάση τον τύπο Ganzoni σε ένα σχήμα απλοποιημένης δόσης, διαπιστώθηκε ότι η προσκόλληση ήταν υψηλότερη με την απλοποιημένη δοσολογία και είχε ως αποτέλεσμα την καλύτερη αποτελεσματικότητα59. Ως αποτέλεσμα, το πρότυπο περίθαλψης στην Ευρώπη έχει μετακινηθεί από τον υπολογισμό Ganzoni σε ένα σχέδιο απλής δοσολογίας. Στις Η.Π.Α., το μεγαλύτερο μέρος του IV σιδήρου έχει ένα απλό σύστημα δοσολογίας και ο τύπος Ganzoni δεν χρησιμοποιείται τόσο συχνά. Η μελέτη μας δείχνει ότι το απλουστευμένο καθεστώς δοσολογίας χρησιμοποιείται συχνότερα και δεν μπορεί να αναπληρώσει πλήρως τα αποθέματα σιδήρου στην πλειοψηφία των ασθενών.
Αν και τα αποτελέσματα της μελέτης μας δείχνουν ότι ένα σύνολο αθροιστικής δόσης IV σιδήρου μεγαλύτερη από 1000mg μπορεί να είναι κατάλληλη για πολλούς ασθενείς με ΣΑ (έχουμε επίγνωση ότι δεν υπάρχουν παρόμοιες δημοσιευμένες αναλύσεις), πρέπει να ληφθούν υπόψιν ορισμένοι περιορισμοί. Μέρη των αναλύσεών μας ήταν αναδρομικά και περαιτέρω προοπτική της έρευνας θα χρειαστεί ώστε να καθοριστεί η μακροπρόθεσμη αποτελεσματικότητα και η ασφάλεια αυτών των υψηλότερων συνολικών αθροιστικών δόσεων IV σιδήρου. Ο πληθυσμός που αναλύθηκε στη Μελέτη 7 ήταν περιορισμένος σε ασθενείς με χρόνια νεφρική νόσο. Άλλα αιτιολογίες της ΣΑ μπορεί να ανταποκρίνονται διαφορετικά σε σχέση με τη χορήγηση IV σιδήρου. Επιπλέον, οι περισσότερες από τις μελέτες που αξιολογήσαν τον τύπο Ganzoni περιελάμβαναν ασθενείς με ΣΑ που προκύπτουν από μια ποικιλία καταστάσεων ασθενείας. Επίσης, ενώ για το συγγραφέα διαφορές σημαντικής αποτελεσματικότητας των γνώσεων μεταξύ των παρόμοιων αθροιστικών δόσεων για τα διάφορα προϊόντα IV σιδήρου δεν έχουν αποδειχθεί, μια μελλοντική προοπτική μελέτη σύγκρισης στις διάφορες δόσεις του ιδίου προϊόντος σε έναν ομοιογενή πληθυσμό ασθενών θα εξαλείψει οποιαδήποτε προκατάληψη σχετικά με το προϊόν ή τον πληθυσμό των ασθενών που μπορεί να έχουν συμπεριληφθεί στη μελέτη μας. Μπορεί να είναι επωφελής η παρατήρηση αν υψηλότερες ή χαμηλότερες συνολικές αθροιστικές δόσεις του ίδιου IV σιδήρου είναι περισσότερο αποτελεσματικές για τους ασθενείς με συγκεκριμένες αιτιολογίες ΣΑ.
5. Συμπεράσματα
Η μελέτη μας δείχνει ότι μια συνολική αθροιστική δόση 1000 mg IV χορηγήσεως σιδήρου μπορεί να είναι ανεπαρκής για την αναπλήρωση του ελλείμματος σιδήρου στην πλειονότητα των ασθενών με ΣΑ και ότι μία δόση 1500 mg είναι πλησιέστερα στο πραγματικό έλλειμμα σιδήρου σε αυτούς τους ασθενείς. Επιπροσθέτως, η χορήγηση 1500mg σιδήρου οδήγησε σε μια πιο ταχεία και ισχυρή απόκριση της Hb, επέτρεψε σε περισσότερους ασθενείς να φτάσουν στα επίπεδα-στόχους της Hb και απαιτείται περισσότερος μέσος χρόνος για την επαναχορήγηση της θεραπείας με επιπλέον IV σίδηρο συγκριτικά με την χορήγηση 1000mg σιδήρου. Η ανάλυση και η αναθεώρηση της βιβλιογραφίας δείχνουν ότι η IV χορήγηση σιδήρου 1500mg είναι καταλληλότερη για την αναπλήρωση σιδήρου σε πολλούς ασθενείς με ΣΑ συγκριτικά με την συχνότερα χρησιμοποιούμενη δόση των 1000mg IV σιδήρου. Απαιτούνται πάντως περαιτέρω μελέτες ώστε να επιβεβαιωθεί η κατάλληλα απαιτούμενη δοσολογία σε διάφορους πληθυσμούς ασθενών.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- L. T. Goodnough, “The new age of iron: evaluation and management of iron-restricted erythropoiesis,” Seminars in Hematology, vol. 46, no. 4, pp. 325–327, 2009.
- B. Annibale, G. Capurso, A. Chistolini et al., “Gastrointestinal causes of refractory iron deficiency anemia in patients without gastrointestinal symptoms,” The American Journal of Medicine, vol. 111, no. 6, pp. 439–445, 2001.
- P. L. Acher, T. Al-Mishlab, M. Rahman, and T. Bates, “Irondeficiency anaemia and delay in the diagnosis of colorectal cancer,” Colorectal Disease, vol. 5, no. 2, pp. 145–148, 2003.
- D. Raje, H. Mukhtar, A. Oshowo, and C. Ingham Clark, “What proportion of patients referred to secondary care with iron deficiency anemia have colon cancer?” Diseases of the Colon and Rectum, vol. 50, no. 8, pp. 1211–1214, 2007.
- M. Auerbach, J. A. Pappadakis, H. Bahrain, S. A. Auerbach, H. Ballard, and N. V. Dahl, “Safety and efficacy of rapidly administered (one hour) one gram of low molecular weight iron dextran (INFeD) for the treatment of iron deficient anemia,” American Journal of Hematology, vol. 86, no. 10, pp. 860–862, 2011.
- L. T. Goodnough, E. Nemeth, and T. Ganz, “Detection, evaluation, and management of iron-restricted erythropoiesis,” Blood, vol. 116, no. 23, pp. 4754–4761, 2010.
- M. Auerbach, H. Ballard, J. R. Trout et al., “Intravenous iron optimizes the response to recombinant human erythropoietin in cancer patients with chemotherapy-related anemia: a multicenter, open-label, randomized trial,” Journal of Clinical Oncology, vol. 22, no. 7, pp. 1301–1307, 2004.
- M. Auerbach, “Ferumoxytol as a new, safer, easier-toadminister intravenous iron: yes or no?” The American Journal of Kidney Diseases, vol. 52, no. 5, pp. 826–829, 2008.
- J. Bonnar, A. Goldberg, and J. A. Smith, “Do pregnant women take their iron?” The Lancet, vol. 1, no. 7592, pp. 457–458, 1969.
- G. Weiss and L. T. Goodnough, “Anemia of chronic disease,”The New England Journal of Medicine, vol. 352, no. 10, pp. 1011–1059, 2005.
- N. C. Andrews, “Anemia of inflammation: the cytokinehepcidin link,” Journal of Clinical Investigation, vol. 113, no. 9, pp. 1251–1253, 2004.
- L. T. Goodnough and A. Shander, “Current status of pharmacologic therapies in patient blood management,” Anesthesia & Analgesia, vol. 116, no. 1, pp. 15–34, 2013.
- D. H. Henry, N. V. Dahl, M. Auerbach, S. Tchekmedyian, and L. R. Laufmane, “Intravenous ferric gluconate significantly improves response to epoetin alfa versus oral iron or no iron in anemic patients with cancer receiving chemotherapy,” Oncologist, vol. 12, no. 2, pp. 231–242, 2007.
- M. Hedenus, G. Birgegard, P. Nasman et al., “Addition of intravenous iron to epoetin beta increases hemoglobin response and decreases epoetin dose requirement in anemic patients with lymphoproliferative malignancies: a randomized multicenter study,” Leukemia, vol. 21, no. 4, pp. 627–632, 2007.
- L. Bastit, A. Vandebroek, S. Altintas et al., “Randomized, multicenter, controlled trial comparing the efficacy and safety of darbepoetin alfa administered every 3 weeks with or without intravenous iron in patients with chemotherapy-induced anemia,” Journal of Clinical Oncology, vol. 26, no. 10, pp. 1611–1618, 2008.
- A. Gafter-Gvili, D. P. Steensma, and M. Auerbach, “Should the ASCO/ASH guidelines for the use of intravenous iron in cancerand chemotherapy-induced anemia be updated?” Journal of the National Comprehensive Cancer Network, vol. 12, no. 5, pp. 657– 664, 2014.
- J. A. Gilreath, D. D. Stenehjem, and G. M. Rodgers, “Diagnosis and treatment of cancer-related anemia,” American Journal of Hematology, vol. 89, no. 2, pp. 203–212, 2014.
- M. Auerbach, A. S. Liang, and J. Glaspy, “Intravenous iron in chemotherapy and cancer-related anemia,” Community Oncology, vol. 9, no. 9, pp. 289–295, 2012.
- J. D. Rizzo, M. Brouwers, P. Hurley, J. Seidenfeld, M. R. Somerfield, and S. Temin, “American Society of Clinical Oncology/American Society of Hematology clinical practice guideline update on the use of epoetin and darbepoetin in adult patients with cancer,” Journal of Oncology Practice, vol. 6, no. 6, pp. 317–320, 2010.
- D. S. Silverberg, A. Iaina, G. Peer et al., “Intravenous iron supplementation for the treatment of the anemia of moderate to severe chronic renal failure patients not receiving dialysis,” American Journal of Kidney Diseases, vol. 27, no. 2, pp. 234–238, 1996.
- R. S. Hillman and P. A. Henderson, “Control of marrow production by the level of iron supply,” Journal of Clinical Investigation, vol. 48, no. 3, pp. 454–460, 1969.
- R. L. Jurado, “Iron, infections, and anemia of inflammation,” Clinical Infectious Diseases, vol. 25, no. 4, pp. 888–895, 1997.
- K. Bishu and R. Agarwal, “Acute injury with intravenous iron and concerns regarding long-term safety,” Clinical Journal of the American Society of Nephrology, supplement 1, pp. S19–S23, 2006.
- L. T. Goodnough, J. H. Levy, and M. F. Murphy, “Concepts of blood transfusion in adults,” The Lancet, vol. 381, no. 9880, pp. 1845–1854, 2013.
- D. R. Spahn and L. T. Goodnough, “Alternatives to blood transfusion,” The Lancet, vol. 381, no. 9880, pp. 1855–1865, 2013.
- L. T. Goodnough, “Blood management: transfusion medicine comes of age,” The Lancet, vol. 381, no. 9880, pp. 1791–1792, 2013.
- A. Shander, R. K. Spence, and M. Auerbach, “Can intravenous iron therapy meet the unmet needs created by the new restrictions on erythropoietic stimulating agents?: report from the Society for the Advancement of Blood Management 2008 Annual Meeting,” Transfusion, vol. 50, no. 3, pp. 719–732, 2010.
- M. Auerbach, L. T. Goodnough, D. Picard, and A. Maniatis, “The role of intravenous iron in anemia management and transfusion avoidance,” Transfusion, vol. 48, no. 5, pp. 988–1000, 2008.
- G. M. Chertow, P. D. Mason, O. Vaage-Nilsen, and J. Ahlmen, ´ “Update on adverse drug events associated with parenteral iron,” Nephrology Dialysis Transplantation, vol. 21, no. 2, pp. 378–382, 2006.
- Dexferrum [package insert], American Regent, Shirley, NY, USA, 2008.
- INFeD, Package Insert, Watson Pharma, Morristown, NJ, USA, 2009.
- A. M. Ganzoni, “Intravenous iron-dextran: therapeutic and experimental possibilities,” Schweizerische Medizinische Wochenschrift, vol. 100, no. 7, pp. 301–303, 1970.
- American Regent, Venofer [Package Insert], American Regent, Shirley, NY, USA, 2012.
- Ferrlecit, Package Insert, Sanofi-Aventis US, Bridgewater, NJ, USA, 2011.
- Feraheme [package insert], AMAG Pharmaceuticals, Lexington, Mass, USA, 2015.
- American Regent, Injectafer [Package Insert], American Regent, Shirley, NY, USA, 2013.
- S. Kulnigg, S. Stoinov, V. Simanenkov et al., “A novel intravenous iron formulation for treatment of anemia in inflammatory bowel disease: the ferric carboxymaltose (FERINJECT) randomized controlled trial,” The American Journal of Gastroenterology, vol. 103, no. 5, pp. 1182–1192, 2008.
- D. B. van Wyck, M. G. Martens, M. H. Seid, J. B. Baker, and A. Mangione, “Intravenous ferric carboxymaltose compared with oral iron in the treatment of postpartum anemia: a randomized controlled trial,” Obstetrics and Gynecology, vol. 110, no. 2, pp. 267–278, 2007.
- D. B. van Wyck, A. Mangione, J. Morrison, P. E. Hadley, J. A. Jehle, and L. T. Goodnough, “Large-dose intravenous ferric carboxymaltose injection for iron deficiency anemia in heavy uterine bleeding: a randomized, controlled trial,” Transfusion, vol. 49, no. 12, pp. 2719–2728, 2009.
- M. H. Seid, R. J. Derman, J. B. Baker, W. Banach, C. Goldberg, and R. Rogers, “Ferric carboxymaltose injection in the treatment of postpartum iron deficiency anemia: a randomized controlled clinical trial,” American Journal of Obstetrics & Gynecology, vol. 199, no. 4, pp. 435.e1–435.e7, 2008.
- C. F. Barish, T. Koch, A. Butcher, D. Morris, and D. B. Bregman, “Safety and efficacy of intravenous ferric carboxymaltose (750 mg) in the treatment of iron deficiency anemia: two randomized, controlled trials,” Anemia, vol. 2012, Article ID 172104, 9 pages, 2012.
- I. Hussain, J. Bhoyroo, A. Butcher, T. A. Koch, A. He, and D. B. Bregman, “Direct comparison of the safety and efficacy of ferric carboxymaltose versus iron dextran in patients with iron deficiency anemia,” Anemia, vol. 2013, Article ID 169107, 10 pages, 2013.
- J. E. Onken, D. B. Bregman, R. A. Harrington et al., “A multicenter, randomized, active-controlled study to investigate the efficacy and safety of intravenous ferric carboxymaltose in patients with iron deficiency anemia,” Transfusion, vol. 54, no. 2, pp. 306–315, 2014.
- J. E. Onken, D. B. Bregman, R. A. Harrington et al., “Ferric carboxymaltose in patients with iron-deficiency anemia and impaired renal function: the REPAIR-IDA trial,” Nephrology Dialysis Transplantation, vol. 29, no. 4, pp. 833–842, 2014.
- National Kidney Foundation. KDOQI, “Clinical practice guidelines and clinical practice recommendations for anemia in chronic kidney disease,” American Journal of Kidney Diseases, vol. 47, supplement 3, pp. S1–S145, 2006.
- Kidney Disease: Improving Global Outcomes (KDIGO) Anemia Work Group, “KDIGO clinical practice guideline for anemia in chronic kidney disease,” Kidney International Supplements, vol. 2, no. 4, pp. S279–S335, 2012.
- National Comprehensive Cancer Network (NCCN), Clinical Practice Guidelines in Oncology. Cancer- and ChemotherapyInduced Anemia. Version 2, NCCN, 2015.
- M. Aapro, A. Osterborg, P. Gasc ¨ on, H. Ludwig, and Y. Beguin, ´ “Prevalence and management of cancer-related anaemia, iron deficiency and the specific role of I.V. iron,” Annals of Oncology, vol. 23, no. 8, pp. 1954–1962, 2012.
- C. Gasche, A. Berstad, R. Befrits et al., “Guidelines on the diagnosis and management of iron deficiency and anemia in inflammatory bowel diseases,” Inflammatory Bowel Diseases, vol. 13, no. 12, pp. 1545–1553, 2007.
- D. Gozzard, “When is high-dose intravenous iron repletion needed? Assessing new treatment options,” Drug Design, Development and Therapy, no. 5, pp. 51–60, 2011.
- P. Geisser and V. Rumyantsev, “Pharmacodynamics and safety of ferric carboxymaltose: a multiple-dose study in patients with iron-deficiency anaemia secondary to a gastrointestinal disorder,” Arzneimittelforschung, vol. 60, no. 6, pp. 373–385, 2010.
- R. R. Crichton, B. Danielson, and P. Geisser, Iron Therapy with Special Emphasis on Intravenous Administration, UNI-MED, Bremen, Germany, 4th edition, 2008.
- B. G. Danielson, “Structure, chemistry, and pharmacokinetics of intravenous iron agents,” Journal of the American Society of Nephrology, vol. 15, no. 2, pp. S93–S98, 2004.
- P. Geisser, M. Baer, and E. Schaub, “Structure/histotoxicity relationship of parenteral iron preparations,” Drug Research, vol. 42, no. 12, pp. 1439–1452, 1992.
- S. Beshara, H. Lundqvist, J. Sundin et al., “Pharmacokinetics and red cell utilization of iron(III) hydroxide-sucrose complex in anaemic patients: a study using positron emission tomography,” British Journal of Haematology, vol. 104, no. 2, pp. 296–302, 1999.
- P. Geisser and S. Burckhardt, “The pharmacokinetics and pharmacodynamics of iron preparations,” Pharmaceutics, vol. 3, no. 1, pp. 12–33, 2011.
- M. Malone, C. Barish, A. He, and D. Bregman, “Comparative review of the safety and efficacy of ferric carboxymaltose versus standard medical care for the treatment of iron deficiency anemia in bariatric and gastric surgery patients,” Obesity Surgery, vol. 23, no. 9, pp. 1413–1420, 2013.
- K. A. Lyseng-Williamson and G. M. Keating, “Ferric carboxymaltose: a review of its use in iron-deficiency anaemia,” Drugs, vol. 69, no. 6, pp. 739–756, 2009.
- R. Evstatiev, P. Marteau, T. Iqbal et al., “FERGIcor, a randomized controlled trial on ferric carboxymaltose for iron deficiency anemia in inflammatory bowel disease,” Gastroenterology, vol. 141, no. 3, pp. 846.e2–853.e2, 2011.
- X. Calvet, M. A. Ruız, A. Dosal et al., “Cost-minimization analysis favours intravenous ferric carboxymaltose over ferric sucrose for the ambulatory treatment of severe iron deficiency,” PLoS ONE, vol. 7, no. 9, Article ID e45604, 2012.
- F. Gomollon and J. P. Gisbert, “Current management of iron ´ deficiency anemia in inflammatory bowel diseases: a practical guide,” Drugs, vol. 73, no. 16, pp. 1761–1770, 2013.
- A. A. Khalafallah and A. E. Dennis, “Iron deficiency anaemia in pregnancy and postpartum: pathophysiology and effect of oral versus intravenous iron therapy,” Journal of Pregnancy, vol. 2012, Article ID 630519, 10 pages, 2012.










Άφησε σχόλιο