Περίληψη
Η απρεμιλάστη είναι ένας από του στόματος αναστολέας της φωσφοδιεστεράσης 4 που τροποποιεί την ενδοκυτταρική σηματοδότηση και έτσι μπορεί να επιδράσει επί διαφόρων προφλεγμονωδών και αντιφλεγμονωδών κυτοκινών, η ελάττωση των οποίων μειώνει την φλεγμονή και άλλα συμπτώματα της ψωριάσεως και ψωριασικής αρθρίτιδας. Η απρεμιλάστη έχει τα πλεονεκτήματα της χορηγήσεως από του στόματος, καλής ανοχής και ελαχίστων φαρμακευτικών αλληλεπιδράσεων και σωστά φαίνεται ότι έχει καλύτερη ασφάλεια, ιδιαιτέρως συγκρινόμενη με εκείνης της μεθοτρεξάτης και βιολογικών θεραπειών. Τα οφέλη της θεραπείας με απρεμιλάστη σε ασθενείς με ψωριασική αρθρίτιδα συνίστανται στην βελτίωση της γενικής φυσικής λειτουργίας δια της ελαττώσεως του οιδήματος και του άλγους των φλεγμαινουσών αρθρώσεων. Επίσης, η απρεμιλάστη βελτιώνει την ποιότητα ζωής των ασθενών με ψωριασική αρθρίτιδα και ψωρίαση. Με βάση τα υπάρχοντα δεδομένα, η απρεμιλάστη θα πρέπει να θεωρηθεί ως θεραπεία εκλογής σε ασθενείς με ψωρίαση του δέρματος κατά πλάκας και ψωριασική αρθρίτιδα.
Apremilast: A New Oral Treatment for Adults with Psoriasis and Psoriatic Arthritis
Athanasiou P.
Apremilast is a new oral available phosphodiesterase 4 inhibitor. The phosphodiesterase 4 modulates intracellular signaling and thereby can impact various pro-inflammatory and anti-inflammatory mediators and as a result reduces the inflammation and other symptoms of the psoriasis and psoriatic arthritis. Advantages of apremilast is the oral administration, minimal drug interactions potential, and what appears to be a fairly safe profile, particularly in comparison to methotrexate and biologic therapies. In psoriatic arthritis, treatment with apremilast can improve general physical function by reducing the swelling and pain in the inflamed joints and improves the quality of life. Based on these results, apremilast should be considered as the therapeutic option of choice in the treatment of plaque psoriasis and psoriatic arthritis.
Εισαγωγή
Η ψωρίαση είναι χρονία, συστηματική φλεγμονώδης διαταραχή, προσβάλλουσα περίπου το 1-3% των ατόμων στις ΗΠΑ1. Η επίπτωση της νόσου εμφανίζει σημαντικές γεωγραφικές διακυμάνσεις οι οποίες πιθανόν αντανακλούν το γεγονός ότι περιβαντολλογικοί και γενετικοί παράγοντες επηρεάζουν αυτή την διαταραχή1. Η ψωρίαση είναι πολυσυστηματική νόσος προσβάλλουσα το δέρμα, τις αρθρώσεις και πιθανώς το έντερο. Οι κύριες, όμως, εκδηλώσεις της νόσου αφορούν το δέρμα και συνίστανται σε ερυθηματώδεις, λεπιδωτές πλάκες επί του δέρματος οι οποίες είναι συχνά κνησμώδεις και/ή επώδυνες. Τα αποτελέσματα από την πρώιμη ωρίμανση των κερατινοκυττάρων είναι η διήθηση του δέρματος από δενδριτικά κύτταρα, μακροφάγα και Τ λεμφοκύτταρα, τα οποία προκαλούν υπερπολλαπλιασμό του επιδερμικού στρώματος. Από τις άλλες εκδηλώσεις, το σημαντικότερο ενδιαφέρον έχουν οι επιδράσεις της νόσου επί των αρθρώσεων προκαλούσες την αποκαλούμενη ψωριασική αρθρίτιδα, κατάσταση που συνεπάγεται σημαντικές επιδράσεις επί του ασθενούς.
Οι ασθενείς με ψωρίαση έχουν την εμπειρία διαταραχής στην ποιότητα ζωής με αποτέλεσμα την φυσική και ψυχική ανικανότητα συγκριτικά με αυτή που βλέπουμε σε ασθενείς με άλλες χρόνιες νόσους (π.χ. σακχαρώδης διαβήτης, υπέρταση, καρδιακή νόσος)5. Συγκριτικά με τους ψωριασικούς ασθενείς, αυτοί με ψωριασική αρθρίτιδα έχουν μεγαλύτερη επιβάρυνση στην ποιότητα ζωής τους, μεγαλύτερη ανικανότητα στην εργασία τους και συχνότερες επισκέψεις στον ιατρό και περισσότερες νοσηλείες5. Όθεν, οι σκοποί της θεραπείας δεν είναι μόνον η ελάττωση των δερματικών και αρθρικών συμπτωμάτων και πρόληψη περαιτέρω ανατομικής βλάβης στους ασθενείς με ψωριασική αρθρίτιδα, αλλά επίσης και η δημιουργία αξιοσημείωτης επίδρασης επί της ποιότητας ζωής.
Οι πρόσφατες θεραπευτικές συστάσεις για ασθενείς με ψωρίαση εξαρτώνται από την βαρύτητα της νόσου. Η ήπια νόσος θεραπεύεται με τοπικές θεραπείες (π.χ. κορτικοστεροειδή, βιταμίνη D, ταραζοτένη) μόνο ή, όταν υπάρχει αυξημένη βαρύτητα της νόσου, σε συνδυασμό με φωτοθεραπεία και/ή με παραδοσιακή μη βιολογική συστηματική θεραπεία (μεθοτρεξάτη, κυκλοσπορίνη, ασιτρετίνη)6. Η μέτρια έως σοβαρή νόσος τυπικώς καθιστά αναγκαία τη χρήση των συστηματικών παραγόντων, οι οποίοι είναι είτε παραδοσιακοί παράγοντες ή βιολογικοί παράγοντες (π.χ. αναστολείς του παράγοντος νεκρώσεως του όγκου – TNF-a, μπιμεκίζουμαμπκ.α.)7. Σε ασθενείς με ψωριασική αρθρίτιδα η πρώτη σειρά θεραπείας είναι τα μη στεροειδή αντιφλεγμονώδη φάρμακα τα οποία συνιστώνται στην ήπια νόσο με ή χωρίς τη χρήση τοπικής ενέσεως κορτικοστεροειδών8. Σε πλέον εξελικτική νόσο χρειάζεται η χρήση των από του στόματος τροποιητικών αντιρευματικών φαρμάκων, όπως η μεθοτρεξάτη, σουλφασαλαζίνη ή λεφλουνομίδη και/ή αναστολείς του TNF–a ή ο αναστολέας της ιντερλευκίνης IL/23 ουστεκινουμάμπη8. Πάντως, η θεραπεία των ασθενών με ψωρίαση ή ψωριασική αρθρίτιδα πρέπει να εξατομικεύεται λαμβανομένης υπ’ όψιν της αποτελεσματικότητας, ανεπιθύμητων ενεργειών, διαθεσιμότητας, ευκολίας της χορηγήσεως και κόστος της θεραπείας, όπως επίσης τις συνυπάρχουσες καταστάσεις και νόσους8.
Μια σπουδαία ανάπτυξη στο πεδίο της συμβατικής τροποποιητικής θεραπείας της ψωριακής αρθρίτιδας είναι η απρεμιλάστη. Η απρεμιλάστη ενεκρίθη για την θεραπεία της μέτριας έως σοβαρής ψωριασικής αρθρίτιδας.
Η απρεμιλάστη είναι ένας από του στόματος παράγοντας που χρησιμοποιείται στην θεραπεία της ψωριάσεως. Σε αυτό το άρθρο ανασκοπούνται τα φαρμακολογικά και κλινικά χαρακτηριστικά αυτού του παράγοντα και συζητείται η εφαρμογή του στην κλινική πράξη.
Κλινική Φαρμακολογία
Διάφορες μελέτες έχουν δείξει ότι ο ακριβής αποκλεισμός του ενζύμου φωσφοδιεστεράση 4 (PDE4) είναι αποτελεσματικός στην θεραπείας της ψωριάσεως και ψωριασικής αρθρίτιδας 10-13.
Η φωσφοδιεστεράση 4 (PDE4) ανήκει στην οικογένεια των ενζύμων της φωσφοδιεστεράσης που συμμετέχουν στην διάσπαση της κυκλικής αδενοσίνης 3’ 5’ – μονοφωσφάτης (cAΜP). Το cAMP είναι ο δευτερογενής κεντρικός αγγελιοφόρος για την ρύθμιση της ανοσολογικής αντιδράσεως και την αναστολή της διασπάσεως που προκαλεί τονκαταρράκτη των κυτταρικών συμβαμάτων με αποτέλεσμα την ελάττωση των φλεγμονωδών μεσολαβητών, όπως ο παράγοντας νεκρώσεως του όγκου-άλφα και ιντερλευκίνη-23, όπως επίσης και της παραγωγής των αντιφλεγμονωδών κυτταροκινών, όπως είναι η ιντερλευκίνη-10 14.
Η φωσφοδιεστεράση 4 (PDE4) είναι ένα ένζυμο που ανευρίσκεται στο ανοσολογικό σύστημα και στο εσωτερικό των κερατινοκυττάρων και είναι το ένζυμο – κλειδί που ευθύνεται για την διάσπαση του cAMP. Δια μέσου αυτών των δράσεων αποκλεισμού του cAMP, οι αναστολείς της PDE4 μπορεί να παρατείνουν ή να αυξήσουν τις επιδράσεις του cAMP με αποτέλεσμα την ελάττωση αμφοτέρων των Τ-βοηθητικών (Th1) και Th2 ανοσολογικών αντιδράσεων. Η PDE4 εκφράζεται εκλεκτικώς στα ανοσολογικά κύτταρα και διαδραματίζει κεντρικό ρόλο στην ενεργοποίηση αυτών των κυττάρων, τα οποία ανευρίσκονται στην χρονία πλακώδη ψωρίαση και σε άλλες φλεγμονώδεις καταστάσεις, όπως η ψωριασική αρθρίτις. Η αναστολή του PDE4 προκαλεί την αύξηση της συγκεντρώσεως του ενδοκυτταρίου cAMP, ως εκ τούτου ελαττώνεται η παραγωγή των φλεγμονωδών μεσολαβητών και αυξάνονται οι αντιφλεγμονώδεις μεσολαβητές και συνεπώς μειώνεται η φλεγμονή και άλλα συμπτώματα της ψωρίασης και της ψωριασικής αρθρίτιδας15.
Η απρεμιλάστη είναι μια μικρή, χημικώς συνθετική ουσία, η οποία αναστέλλει την PDE4 και η οποία, όπως αναφέρθηκε, ρυθμίζει τις ανοσολογικές και φλεγμονώδεις διεργασίες. Δια της αναστολής της PDE4, η απρεμιλάστη προλαμβάνει την διάσπαση του cAMP. Η επακόλουθος αύξηση του επιπέδου του cAMP έχει ως αποτέλεσμα την ανταγωνιστική επίδραση επί των παραγομένων προφλεγμονωδών κυτταροκινών, όπως είναι ο TNF-a, IL-23 και ιντερφερόνη-γ και αύξηση των αντιφλεγμονωδών μεσολαβητών (π.χ IL-10)15. Όθεν, η απρεμιλάστη δρα ενδοκυττάρια για την διακοπή του φλεγμονώδους καταρράκτου σε πρώτο βαθμό, διαφορετικά των βιολογικών παραγόντων που στοχεύουν απλώς στους απλούς προ φλεγμονώδεις δείκτες (π.χ. TNF-a). Με αυτό τον τρόπο, η απρεμιλάστη μειώνει την φλεγμονή και άλλα συμπτώματα της ψωριάσεως και ψωριασικής αρθρίτιδας 13-15.
Φαρμακοκινητική
Η απρεμιλάστη, χορηγείται από του στόματος, απορροφάται καλώς, με την απόλυτη βιοδιαθεσιμότητα να φτάνει το 73% μετά την χορήγηση δόσεως 20mg με τις υψηλότερες συγκεντρώσεις στο πλάσμα να παρατηρούνται κατά μέσον χρόνο σε περίπου 2,5ώρες14,15. Η ταυτόχρονη χορήγηση με τροφή δεν διαταράσσει την έκταση της απορροφήσεως της απρεμιλάστης. Η απρεμιλάστη συνδέεται με τις πρωτεΐνες του πλάσματος περίπου στο 68%.
Μετά την χορήγηση από του στόματος στους ανθρώπους, η απρεμιλάστη είναι το κύριο κυκλοφορούν συστατικό (45%), 5’ ακολουθείται από τον αδρανή μεταβολίτη Μ12 (39%) που είναι συνδεδεμένος με το γλυκουρονικό οξύ της Ο-διμεθυλικής απρεμιλάστης. Η απρεμιλάστη μεταβολίζεται στους ανθρώπους με διαπιστούμενους πλέον των 23 μεταβολιτών στο πλάσμα, ουρά και ιστούς. Η απρεμιλάστη μεταβολίζεται από το CYP κυρίως και ακολούθως, σε μικρότερη έκταση, από το CYP1A2 και CYP2A614,15.
Η κάθαρση της απρεμιλάστης του πλάσματος είναι περίπου 10L/ώρα σε υγιή άτομα με τελικό χρόνο ημισείας απεκκρίσεως να είναι περίπου 6-8ώρες. Η κάθαρση του φαρμάκου είναι 36% χαμηλότερη σε ασθενείς με ψωριασική αρθρίτιδα.
Η ήπια ή μέτρια νεφρική ανεπάρκεια δεν διαταράσσει την φαρμακοκινητική συμπεριφορά της απρεμιλάστης. Σε ασθενείς με σοβαρά νεφρική ανεπάρκεια ελαττώνεται η απέκκριση του φαρμάκου.
Η φαρμακοκινητική της απρεμιλάστης δεν επηρεάζεται από την μέτρια ή σοβαρά ηπατική ανεπάρκεια.
Κλινικές Μελέτες
Η ασφάλεια και η αποτελεσματικότητα της απρεμιλάστης εκτιμήθηκε στην φάση 216-18 και φάση 3 των κλινικών μελετών (Efficacy and Safety Trial Evaluating the Effects of Apremilast to Psoriasis [ESTEM] 1 and 2) οι οποίες καθόρισαν την αποτελεσματικότητα της απρεμιλάστης στην ψωρίαση21-23.
Χρήση της Απρεμιλάστης στην Κατά Πλάκας Ψωρίαση
Η αποτελεσματικότητα και ασφάλεια της απρεμιλάστης στην θεραπεία της μέτριας έως σοβαράς κατά πλάκας ψωριάσεως (Ψωριασική Περιοχή και Ψωριασική περιοχή και Βαθμός Σοβαρότητας (PASI) 12 ή μεγαλύτερος, προσβαλλομένη περιοχή σωματικής επιφάνειας (BSA) 10% της στατικής Physician Global Assessment (sPGA) 3 ή περισσότερο, υποψήφιοι για φωτοθεραπεία ή συστηματική θεραπεία) εκτιμήθηκε σε δύο πολυκεντρικές, τυχαιοποιημένες, διπλές-τυφλές, placebo-ελεγχόμενες μελέτες συγκριτικού σχεδιασμού16-18.
Στις δύο μελέτες, ESTEEM 1 και ESTEEM 2, συμπεριελήφθησαν συνολικά 1.257 άτομα, ηλικίας 18 έως 83 ετών (μέση ηλικία 46έτη) με μέτρια έως σοβαρά ψωρίαση κατά πλάκας [προσβληθείσα σωματική επιφάνεια (BSA)≥10%, ³3% (μέτρια ή σοβαρά νόσος), ψωριασική περιοχή και βαθμονόμηση δείκτου σοβαρότητας (PASI) ≥12, υποψήφιοι για φωτοθεραπεία ή συστηματική θεραπεία]. Η ESTEEM 1 περιελάμβανε 844 ασθενείς και η ESTEEM 2 περιελάμβανε 413 ασθενείς. Σε αμφότερες τις μελέτες οι ασθενείς τυχαιοποιήθηκαν 2:1 για να λάβουν απρεμιλάστη 30mg δυο φορές ημερησίως για 16 εβδομάδες. Κατά τις 16 εβδομάδες, όλοι οι ασθενείς θεραπεύτηκαν με απρεμιλάστη μέχρι 32 εβδομάδες ακολουθουμένη από τυχαιοποιημένη φάση αποσύρσεως μέχρι την 52η εβδομάδα. Η αξιολόγηση της απρεμιλάστης βασίστηκε στα δεδομένα κατά τις 16 εβδομάδες16-18. Η πρωτογενής αποτελεσματικότητα ήταν σε αντιστοιχία επί τοις εκατό των συμμετεχόντων στους οποίους επετεύχθη 75% βελτίωση (ελάττωση) από το οριακό της PASI βαθμολογίας (PASI-75) κατά την 16η εβδομάδα16-18. Κατά την 16η εβδομάδα, η αναλογία των ασθενών στους οποίους επιτευχθεί PASI-75 ανταπόκριση ήταν σημαντικώς μεγαλυτέρα (P<0,0001) στην ομάδα με απρεμιλάστη έναντι της placebo ομάδας σε αμφότερες τις μελέτες (ESTEEM 1: 33% έναντι 5% αντιστοίχως και ESTEEM 2: 29% έναντι 6%, αντιστοίχως). Συγκριτικά με placebo, σημαντικώς μεγαλύτερη επιτυχία παρατηρήθηκε στην ομάδα των ασθενών με απρεμιλάστη σε βαθμολογία 0 ή 1 επί τους sPGA στην ESTEEM 1: 10% έναντι 22% αντιστοίχως και στην ESTEEM 2: 4% έναντι 20%, αντιστοίχως (P≤0.0001). Σημαντικά αποτελέσματα παρατηρήθηκαν επίσης με την απρεμιλάστη όσον αφορά τις επί τοις εκατό μεταβολές από την οριακή επιτηδευμένη BSA και PASI βαθμολογία στην επί τοις εκατό επιτευχθείσα PASI-5016-18. Στους ασθενείς που επανατυχαιοποιήθηκαν για placebo κατά την 32η εβδομάδα, ο μέσος χρόνος για την απώλεια της PASI-75 ανταποκρίσεως ήταν 5,1 εβδομάδες στην μελέτη ESTEEM 116-18.
Η αποτελεσματικότητα της απρεμιλάστης επίσης εδείχθη στην φάση 2β διπλής – τυφλής, τυχαιοποιημένης, placebo-ελεγχόμενης μελέτης σε 352 ασθενείς όπου συγκρίθηκε η απρεμιλάστη σε δόση 10mg, 20mg και 30mg ή placebo δυο φορές ημερησίως για 16 εβδομάδες, κατά την οποίαν ο αριθμός των ασθενών που έλαβαν placebo ακολούθως τυχαιοποιήθηκαν για να λάβουν 20mg ή 30mg δύο φορές ημερησίως μέχρι 24 εβδομάδες. Ο πρωτογενής τελικός στόχος PASI-75 κατά τις 16 εβδομάδες ήταν 11% για 10mg, 29% για 20mg και 41% για 30mg δυο φορές ημερησίως έναντι 6% των σθενών με placebo17.
Η θεραπεία με απρεμιλάστη επίσης προκάλεσε σημαντική βελτίωση των ασθενών στην δόση των 30mg δυο φορές ημερισίως18.
Ψωριασική Αρθρίτις
Η ψωριασική αρθρίτις (ΨΑ) είναι χρονία ανοσολογική νόσος. Οι εκδηλώσεις της ΨΑ περιλαμβάνουν οίδημα και ευαισθησία των αρθρώσεων, άλγος και ευαισθησία στην ψηλάφηση η οποία συνοδεύονται με διαταραχή της φυσικής λειτουργίας και προβλημάτων σχετικά με την ποιότητα ζωής 21.
Η κλινική αποτελεσματικότητα και ασφάλεια της απρεμιλάστης σε ασθενείς με ΨΑ εκτιμήθηκε σε τρείς πολυκεντρικές, τυχαιοποιημένες, διπλές-τυφλές, placebo-ελεγχόμενες μελέτες (Μελέτες PsA-1, PsA-2 και PsA-3) παρόμοιου σχεδιασμού.
Η PALACE 1 μελέτη ήταν μια διεθνής, πολυκεντρική, τυχαιοποιημένη, διπλή-τυφλή, placebo ελεγχόμενη μελέτη κατά την οποίαν εκτιμήθηκε η αποτελεσματικότητα και η ασφάλεια της απρεμιλάστης σε 504 ασθενείς με ενεργό ΨΑ παρά τις προηγούμενες θεραπείες με τροποποιητικούς φαρμακευτικούς παράγοντες και/ή βιολογική θεραπεία, ήταν διαρκείας 24 εβδομάδων και οι ασθενείς τυχαιοποιήθηκαν προκειμένου να λάβουν απρεμιλάστη σε 20mg δύο φορές ημερησίως (168 ασθενείς), 30mg δυο φορές ημερησίως (168 ασθενείς) ή placebo (168 ασθενείς). Κατά την 16η εβδομάδα, οι μη ανταποκρινόμενοι ασθενείς (ασθενείς χωρίς ³20% ελάττωση στο οίδημα και ευαισθησία του τένοντος), επανατυχαιοποιήθηκαν ομοίως στη μία από τις ομάδες των θεραπευόμενων με απρεμιλάστη, εάν αρχικώς τυχαιοποιήθηκαν για placebo ή παρέμειναν στην αυτή αρχική δόση της απρεμιλάστης. Κατά την 24η εβδομάδα, όλοι οι παραμένοντες ασθενείς στην θεραπεία με placebo επανατυχαιοποιήθηκαν για να λάβουν απρεμιλάστη σε δόση 20mg ή 30mg. Η πρωτογενής έκβαση ήταν καθορισμένη όπως οι ασθενείς πετύχουν 20% βελτίωση, σύμφωνα με τα τροποποιηθέντα κριτήρια του Αμερικανικού Κολλεγίου της Ρευματολογίας (ACR). Κατά την 16η εβδομάδα σημαντικώς περισσότεροι ασθενείς που έλαβαν απρεμιλάστη 20mg δυο φορές ημερησίως (31%) και 30mg δυο φορές ημερησίως (40%) επέτυχαν την κατά 20% ανταπόκριση του ACR έναντι placebo (17%) (P<0.001). Σημαντική βελτίωση παρατηρήθηκε στις μετρήσεις-κλειδιά δευτεροπαθών καταστάσεων (λειτουργία, ψωρίαση) με αμφότερες τις δόσεις της απρεμιλάστης έναντι placebo. Το πλείστον των ασθενών θεραπευθέντων με απρεμιλάστη έδειξε βελτίωση της φυσικής λειτουργίας και βελτίωση της ποιότητας ζωής.
Οι ασθενείς που συνέχισαν να λαμβάνουν απρεμιλάστη μέχρι 52 εβδομάδες αξιολογήθηκαν ως προς την ανταπόκριση22. Κατά την 52 εβδομάδα, 63% των ασθενών που έλαβαν απρεμιλάστη 20mg δύο φορές ημερησίως και 54% που έλαβαν 30mg δύο φορές ημερησίως επέτυχαν το ACR 20. Επίσης, παρατηρήθηκε βελτίωση της φυσικής λειτουργίας και της ποιότητας ζωής. Τα αποτελέσματα της PALACE 1 μελέτης και μετά 52 εβδομάδες θεραπείας δείχνουν ότι οι ασθενείς με ενεργό ΨΑ θεραπευόμενοι με απρεμιλάστη, έδειξαν την επιτευχθείσα ανταπόκριση πέραν των 52 εβδομάδων της θεραπείας.
Στην PALACE 2 μελέτη25 εκτιμήθηκε η αποτελεσματικότητα και ασφάλεια σε ασθενείς με ενεργό ψωριασική αρθρίτιδα παρά την προηγούμενη θεραπεία με τροποποιητικά αντιρρευματικά φάρμακα της νόσου και/ή βιολογική θεραπεία. Στην μελέτη συμπεριλήφθηκαν 484 ασθενείς οι οποίοι τυχαιοποιήθηκαν (1:1:1) και έλαβαν placebo, απρεμιλάστη 20mg δύο φορές ημερησίως ή απρεμιλάστη 30mg δύο φορές ημερησίως. Κατά την 16η εβδομάδα και οι ασθενείς με ευαισθησία του τένοντος βελτιώθηκαν <20% entered early escape placebo ασθενείς επανατυχαιοποιήθηκαν (1:1) για να λάβουν 20mg ή 30mg τρις φορές ημερησίως. Οι ασθενείς με απρεμιλάστη συνέχισαν την απρεμιλάστη στην αρχική δόση. Κατά την 24η εβδομάδα, οι ασθενείς που παρέμεναν σε placebo επανατυχαιοποιήθηκαν για να λάβουν 20mg ή 30mg απρεμιλάστης δύο φορές ημερησίως. Το πρωτογενές τελικό σημείο ήταν η επίτευξη >20% βελτιώσεως σύμφωνα με τα κριτήρια του ACR κατά την 16η εβδομάδα. Κατά την 16η εβδομάδα το κριτήριο του >20% του ACR επετεύχθη σε περισσότερους ασθενείς με 20mg δύο φορές ημερησίως (37,4%) και 30mg δύο φορές ημερησίως (32,1%) έναντι των ασθενών με placebo (18,9%). Κλινικώς σημαντικές βελτιώσεις παρατηρήθηκαν στα σημεία και συμπτώματα της ΨΑ, φυσικής λειτουργίας και ψωριάσεως με απρεμιλάστη μέχρι 52 εβδομάδες.
Στην PALACE 3 μελέτη συμπεριλήφθηκαν 505 ασθενείς τυχαιοποιηθέντες (1:1:1) σε placebo, απρεμιλάστη 20mg δύο φορές ημερησίως και απρεμιλάστη 30mg δύο φορές ημερησίως. Η θεραπεία διάσωσης με απρεμιλάστη έγινε την 16η εβδομάδα για τους ασθενείς με placebo που δεν επετεύχθη βελτίωση 20% ACR του οιδήματος και της ευαισθησίας του τένοντος. Κατά την 24η εβδομάδα οι παραμένοντες στην ομάδα placebo ασθενείς επανατυχαιοποιήθηκαν για να λάβουν απρεμιλάστη 20mg ή 30mg δύο φορές ημερησίως. Η αποτελεσματικότητα και ασφάλεια της απρεμιλάστης βεβαιώθηκε για διάστημα πέραν των 52 εβδομάδων. Κατά την 16η εβδομάδα, σημαντικά περισσότεροι ασθενείς που έλαβαν απρεμιλάστη 20mg (28%) και 30mg δύο φορές ημερησίως (41%) επέτυχαν 20% βελτίωση των κριτηρίων του ACR 20. Παρομοίως, σημαντική βελτίωση παρατηρήθηκε σε ποσοστό 50% στη δερματική ψωρίαση με απρεμιλάστη 30mg δύο φορές ημερησίως. Κατά την 52η εβδομάδα, οι παρατηρηθείσες βελτιώσεις σε αυτές τις παραμέτρους επέδειξαν συνεχή ανταπόκριση με συνεχή θεραπεία με απρεμιλάστη. Η απρεμιλάστη ήταν γενικώς καλώς ανεκτή και είχε καλή εικόνα ασφάλειας.
Ασφάλεια και Ανοχή της Απρεμιλάστης
Τα δεδομένα από την φάση 3 των κλινικών μελετών σε ασθενείς με ΨΑ και ψωρίαση υποδεικνύουν ότι η απρεμιλάστη είναι γενικώς καλώς ανεκτή. Οι πλέον συχνές ανεπιθύμητες ενέργειες προέρχονται από το γαστρεντερικό σύστημα και είναι εντερική δυσφορία, απώλεια της πράξεως, ναυτία και διάρροια. Αυτές οι ανεπιθύμητες ενέργειας ελαττώνονται μετά ολίγων εβδομάδων της θεραπείας. Άλλες συνήθεις ανεπιθύμητες επιδράσεις περιλαμβάνουν την απώλεια βάρους, δερματικό εξάνθημα, κόπωση ή δυσκολία ύπνου, βήχα, κεφαλαλγίες, αυξημένη αρτηριακή πίεση και οσφυϊκό άλγος. Αυτές οι ανεπιθύμητες ενέργειες, εάν παρατηρηθούν, συχνά ελαττώνονται με την συνέχιση της θεραπείας. Οι αλλεργικές αντιδράσεις είναι σπάνιες.
Κύηση και Γαλουχία: Η απρεμιλάστη δεν πρέπει να χορηγείται κατά την διάρκεια της κυήσεως ή την γαλουχία.
Νεφρική και Ηπατική Λειτουργία: Η δοσολογία της απρεμιλάστης θα πρέπει να προσαρμόζεται σε ασθενείς με νεφρική δυσλειτουργία με βάση την κάθαρση της κρεατινίνης ενώ δεν χρειάζεται προσαρμογή σε ασθενείς με ηπατική διαταραχή.
Φαρμακευτικές Αλληλεπιδράσεις
Η απρεμιλάστη μπορεί να εμφανίζει αλληλεπιδράσεις με την ριφαμπικίνη, καρβαμαζεπίνη, φαινυτοΐνη και φαινοβαρβιτάλη. Η απρεμιλάστη δεν αλληλοεπιδρά με την μεθοτρεξάτη.
Δόση και Χορήγηση
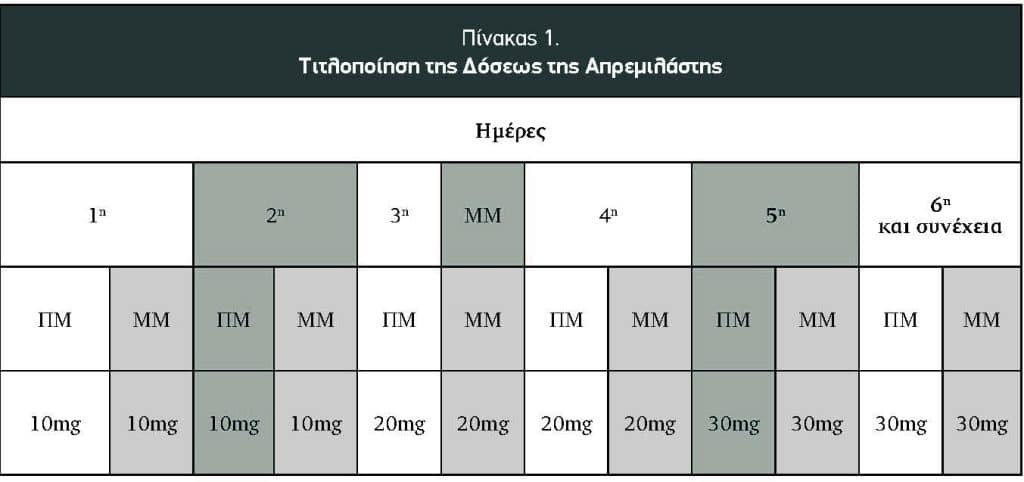
Η συνιστώμενη συντηρητική δόση της απρεμιλάστης, ανεξαρτήτως της ενδείξεως, είναι 30mg δύο φορές ημερησίως από τον στόματος χωρίς να σχετίζεται με το φαγητό. Για την ελάττωση των γαστρεντερικών ανεπιθύμητων ενεργειών που συνοδεύουν την απρεμιλάστη με την έναρξη της θεραπείας, συνιστάται η πέντε ημερών τιτλοποίηση (Πίνακας 1).
Συμπέρασμα
Η απρεμιλάστη είναι ένα νέο φάρμακο με καινοφανή μηχανισμό δράσεως στην θεραπεία της ψωριάσεως και ψωριασικής αρθρίτιδας, νοσήματα συνδυαζόμενα με σημαντική νοσηρότητα. Η απρεμιλάστη έχει τα πλεονεκτήματα της χορηγήσεως από του στόματος, καλής ανοχής και ελαχίστων φαρμακευτικών αλληλεπιδράσεων και σωστά φαίνεται ότι έχει καλύτερη ασφάλεια, ιδιαιτέρως συγκρινόμενη με εκείνης της μεθοτρεξάτης και βιολογικών παραγόντων. Τα οφέλη της θεραπείας με απρεμιλάστη σε ασθενείς με ΨΑ μπορεί να συνίστανται στην βελτίωση της γενικής φυσικής λειτουργίας δια της ελαττώσεως του οιδήματος και άλγους των φλεγμαινουσών αρθρώσεων. Επίσης η απρεμιλάστη βελτιώνει την ποιότητα ζωής των ασθενών με ΨΑ. Σε ασθενείς με ψωρίαση του δέρματος προκαλεί κλινικώς σημαντική βελτίωση. Με βάση τα υπάρχοντα δεδομένα, η απρεμιλάστη θα πρέπει να θεωρηθεί ως θεραπεία εκλογής σε ασθενείς με ψωρίαση κατά πλάκας και ψωριασική αρθρίτιδα.
Στην Ελλάδα η απρεμιλάστη κυκλοφορεί με την εμπορική ονομασία OTELZA σε δισκία των 10mg, 20mg και 30mg.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Parisi R, Symmons DP, Griffiths CE, et al. Global epidemiology of psoriasis: a systematic review of incidence and prevalence. J Invest Dermatol 2013; 133: 377-385.
- Menter A, Gottlieb A, Feldman SR, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: section 1. Overview of psoriasis and guidelines of care for the treatment of psoriasis with biologists. J Am Acad Dermatol 2008; 58: 826-850.
- Menter A, Korman NJ, Elmets CA, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: section 4. Guidelines of care for management and treatment of psoriasis with traditional systemic agents. J Am Acad Dermatol 2009; 61: 451-458.
- Menter A, Korman NJ, Elmets CA, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: section 6: Guidelines of care for the treatment of psoriasis and psoriatic arthritis: care-based presentations and evidence – based conclusions. J Am Acad Dermatol 2011; 65: 137-174.
- Mease PJ, Amstrong AW. Managing patients with psoriasis disease: the diagnosis and pharmacologic treatment of psoriatic arthritis in patients with psoriasis. Drugs 2014; 74: 426-421.
- National Institute for Health and Care Excellence. Psoriasis: the assessment and management of psoriasis. NICE clinical guideline 153. October 2012.
- Tores T, Romanelli M, Chiricozzi A. A revolutionary therapeutic approach for psoriasis: bispecific biologic agents. Expert Opin Investing Drugs 2016; 25: 751-754.
- Gossec I, Smolen JS, Gaujoux – VialaC et al. European League Against Rheumatism recommendations for the management of psoriatic arthritis with pharmacologic therapies. Ann Rheune DIS 71: 4-12.
- Busa S, Kavanaugh A. Drug safety evaluation of apremilast for treating psoriatic arthritis. Expert Opin Drug Safety 2015; 14: 975-985.
- Deeks ED. Apremilast: A review in psoriasis and psoriatic arthritis. Drugs 2015; 75: 1393-1403.
- Gooderham M, Papp K. Apremilast in the treatment of psoriasis and psoriatic arthritis. Skin The Letter 2015; 20: 1-6.
- Schett G. Apremilast in psoriatic arthritis. Clin Exp Rheumatol 2015; 33 (Suppl. 93): 598 – 5100.
- Haber SL, Jamilton S, Bank M, et al. Apremilast A novel drug for treatment of psoriasis and psoriatic arthritis. Ann Pharmacother 2016; 50: 282-290.
- Schafer PH. Apremilast mechanism of action and application to psoriasis and psoriatic arthritis. Biochem Pharmacol 2012; 83: 1583-1590.
- Schafer PH, Parton A, Lupone L, et al. Apremilast is a selective PDE 4 inhibitor with regulatory effects on innate immunity. Cell Signal 2014; 26: 2016-2019.
- Papp k, Cather JC, Rosoph L, et al. Efficacy of apremilast in the treatment of moderate to severe psoriasis: a randomized, controlled trial. Lancet 2012; 380: 738-746.
- Papp K, Kantmann R, Thaci D, et al. Efficacy and safety of apremilast in subjects with moderate to severe plaque psoriasis: results from phase II, multicenter, randomized, double blind, placebo-controlled, parallel-group, dose-comparison Study. J Eur Acad Dermatol Venereol 2013; 27: e 376-383.
- Strand V, Fiorentino D, Hu C, Day RM, Stevens RM, Papp KA. Improvements in patient-reported outcomes with apremilast, an oral phosphodiesterase 4 inhibitor, in the treatment of moderate to severe psoriasis: results from a phase IIb randomized, controlled study. Healthy Qual Life Outcomes 2013; 11: 81-86.
- Papp K1, Reich K2, Leonardi CL3, Kircik L4, Chimenti S, et al. Apremilast, an oral phosphodiesterase 4 (PDE4) inhibitor, in patients with moderate to severe plaque psoriasis: Results of a phase III, randomized, controlled trial (Efficacy and Safety Trial Evaluating the Effects of Apremilast in Psoriasis [ESTEEM] 1). [Poster 8359]. Presented at the 71nd Annual Meeting of the American Academy of Dermatology, March 21-25, 2014; Denver, Co.
- Papp K, Reich k, Leonard CL, et al. Apremilast, an oral phosphodiesterase 4 (PDE 4) inhibition in patients with moderate to severe plaque psoriasis: results of the phase III, randomized, controlled trial (Efficacy and Safety Trial Evaluation the Effects of Apremilast in Psoriasis [ESTEEM 1]. J Am Acad Dermatol 2015; 73: 37-48.
- Kavanagh A, Mease PJ, Gomez-Reino JJ, et al. Treatment of psoriatic arthritis in a phase 3 randomised, placebo – controlled trial with apremilast an oral phosphodiesterase 4 inhibitor. Ann Rheum Dis 2014; 73: 1020-1026.
- Kavanaugh A, Mease Ph J, Gomez-Reino JJ, et al. Longterm (52-week) results of a phase III randomized, controlled trial of apremilast in patients with psoriatic arthritis. J Rheumatol 2015; 42: 479-488.
- Christopher J Edwards, Francisco J Blanco, Jeffrey Crowley, et al. Apremilast, an oral phosphodiesterase 4 inhibitor, in patients with psoriatic arthritis and current skin involvement: a phase III, randomised, controlled trial (PALACE 3). Ann Rheum Dis. 2016 Jun; 75: 1-9.
- Gladman DD, Antoni C, Mease P, et al. Psoriatic arthritis: epidemiology, clinical features, course and outcomes. Ann Rheum Dis 2005; 64 (Suppl 2): ii 14-17.
- Cutolo M, Myerson GE, Fleischmann RM, Lioté F, et al. A Phase III, Randomized, Controlled Trial of Apremilast in Patients with Psoriatic Arthritis: Results of the PALACE 2 Trial. J Rheumatol. 2016 Sep; 43(9):1724-34.









Άφησε σχόλιο