Περίληψη
Τα σαρκώματα μαλακών μορίων είναι σπάνιοι όγκοι μεσεγχυματογενούς προέλευσης. Η νέα κατάταξη των όγκων μαλακών μορίων του Παγκόσμιου Οργανισμού Υγείας περιλαμβάνει περίπου 120 οντότητες (καλοήθεις, ενδιάμεσης κακοήθειας, κακοήθεις). Η αντιμετώπισή τους σε εξειδικευμένα κέντρα συνδέεται με καλύτερη έκβαση. Η διάγνωση μέσω βιοψίας προηγείται οποιουδήποτε θεραπευτικού χειρισμού και πρέπει να τίθεται από έμπειρο παθολογοανατόμο, δεδομένης της σπανιότητας και ετερογένειάς τους. Οι διάφορες τεχνικές μοριακής βιολογίας μπορεί να βοηθήσουν στην ακριβή ταυτοποίηση του σαρκώματος.
Η βασική θεραπεία των εντοπισμένων σαρκωμάτων μαλακών μορίων είναι η en bloc χειρουργική εκτομή επί υγιών ορίων. Ανάλογα με τον υπότυπο του σαρκώματος, το μέγεθος και την εντόπισή του, καθώς και την εξαιρεσιμότητά του, μπορεί να προταθεί νεοεπικουρική/ επικουρική χημειοθεραπεία ή ακτινοθεραπεία. Οι ανθρακυκλίνες, σε συνδυασμό συνήθως με την ιφωσφαμίδη, αποτελούν τη βασική χημειοθεραπεία των προχωρημένων σαρκωμάτων μαλακών μορίων. Η ολική επιβίωση των ασθενών έχει αυξηθεί τα τελευταία χρόνια, χάρη στην ύπαρξη θεραπείας δεύτερης γραμμής όπως η τραβεκτεδίνη και η παζοπανίμπη, στην ανάδειξη διαφόρων συστηματικών θεραπειών με δράση σε συγκεκριμένους ιστοτύπους (όπως η λαροτρεκτινίμπη στους όγκους με αναδιάταξη των γονιδίων NTRK και η ταζεμετοστάτη στο επιθηλιοειδές σάρκωμα) και στην αντιμετώπισή τους σε εξειδικευμένα κέντρα. Η διεξαγωγή μελετών ανά ιστότυπο, η ολοένα αυξανόμενη κατανόηση της βιολογίας των σαρκωμάτων σε συνδυασμό με την ανάπτυξη νέων στοχευουσών θεραπειών και η διερεύνηση νέων προσεγγίσεων υιοθετούμενης ανοσοθεραπείας αναμένεται να ανοίξουν νέους ορίζοντες στην αντιμετώπιση των ασθενών αυτών.
Soft Tissue Sarcomas – What’s New
Stefania Kokkali
Abstract
Soft tissue sarcomas are rare tumors of mesenchymal origin. The new World Health Organization classification of soft tissue tumors includes approximately 120 entities (benign, intermediate, malignant). Their management in expert centers has been associated with better outcomes. Diagnosis through biopsy precedes any therapeutic modality and should be made by an expert pathologist, given their rarity and heterogeneity. Molecular methods can help accurate diagnosis of soft tissue sarcoma.
The main treatment of localized soft tissue sarcomas is en bloc surgical resection with tumor-free margins. Adjuvant/neoadjuvant chemotherapy or radiation therapy can be administed, depending on sarcoma histotype, its size and localization, as well as its resectability. Anthracyclines, usually in combination with ifosfamide, constitutes the mainstay of chemotherapy in advanced soft tissue sarcomas. Overall survival of these patients has improved over the last years, as a result of second-line treatment options, such as trabectedin and pazopanib, the emergency of several systemic therapies with activity in specific histotypes (such as larotrectinib in NTRK-rearranged tumors and tazemetostat in epithelioid sarcoma) and their management in specialized centers. Histotype-specific clinical trial design, the progress in the understanding of soft tissue sarcoma biology coupled with the development of targeted treatments and the exploration of new adoptive immunotherapies open new horizons in the treatment of patients with soft tissue sarcomas.
Εισαγωγή
Τα σαρκώματα είναι σπάνιοι όγκοι μεσεγχυματογενούς προέλευσης, οι οποίοι απαρτίζουν το 15% περίπου των καρκίνων στα παιδιά και λιγότερο από 1% των καρκίνων των ενηλίκων. Η προέλευσή τους μπορεί να είναι οποιοδήποτε κύτταρο του συνδετικού ιστού, συμπεριλαμβανομένου του λίπους, των μυών, αγγείων, νεύρων κλπ, ενώ σε κάποιες περιπτώσεις όπως στο συνοβιακό σάρκωμα, το κύτταρο προέλευσης παραμένει αδιευκρίνιστο. Τα σαρκώματα μαλακών μορίων αποτελούν το 80% περίπου των σαρκωμάτων και διακρίνονται, ανάλογα με την εντόπισή τους, σε σαρκώματα των άκρων (τα συχνότερα), του κορμού (θώρακος, κοιλιάς, οπισθοπεριτοναίου και πυέλου) και κεφαλής-τραχήλου. Ιδιαίτερη κατηγορία αποτελούν και τα σπλαγχνικά σαρκώματα.
Ιστολογική Ταξινόμηση και η Σημασία της Μοριακής Βιολογίας
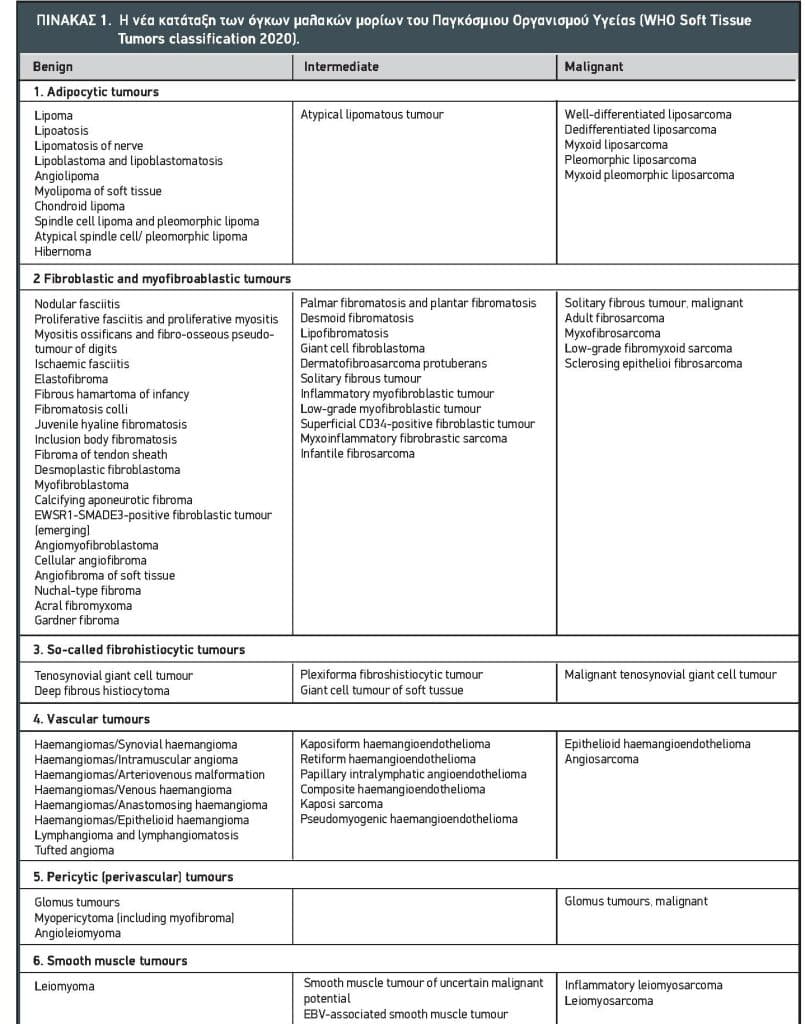
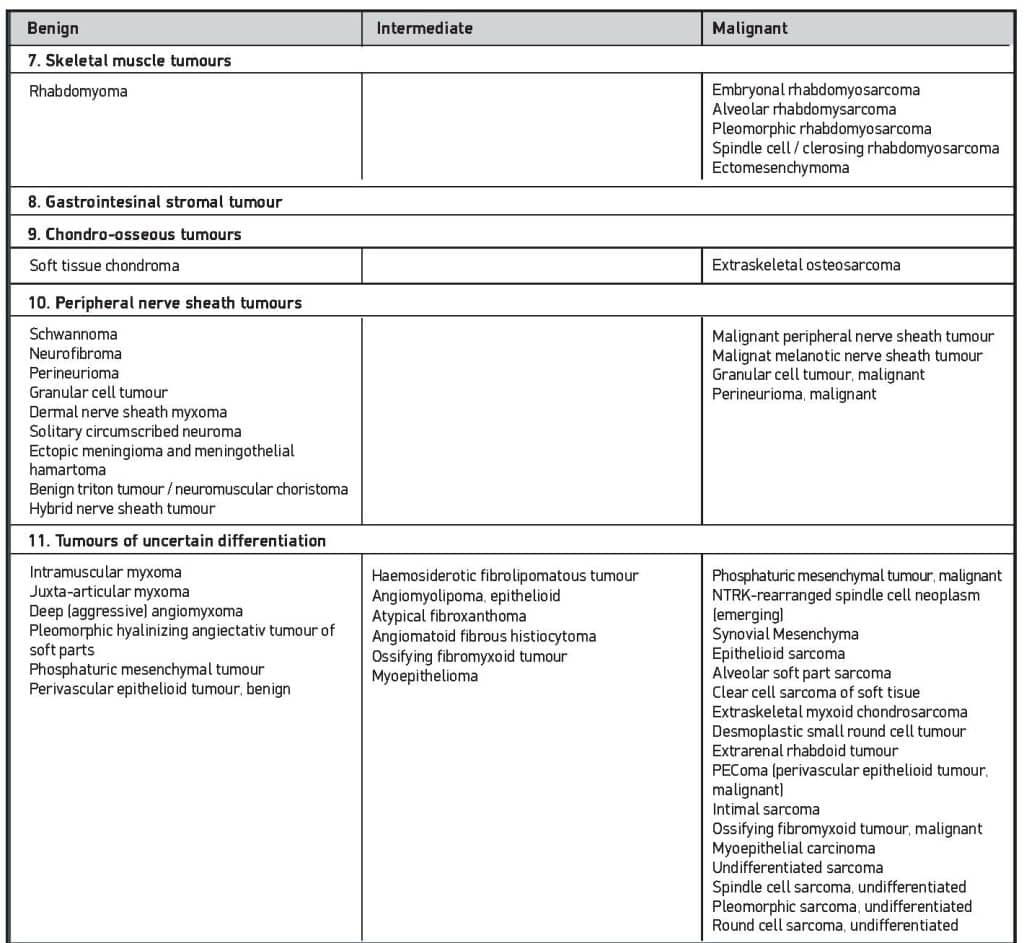
Τα σαρκώματα μαλακών μορίων συνιστούν μία ιδιαίτερα ευρεία και ετερογενή ομάδα όγκων, οι οποίοι χαρακτηρίζονται σε ποσοστό 45% περίπου από μία σαφώς ορισμένη επαναλαμβανόμενη γενετική μεταβολή που συνεισφέρει στην παθογένειά τους1. Αυτές οι μεταβολές μπορούν να ανιχνευτούν χρησιμοποιώντας παραδοσιακές μοριακές μεθόδους όπως PCR και FISH, ενώ σήμερα χρησιμοποιείται περισσότερο η αλληλουχία γονιδιώματος (genome sequencing). Έτσι για παράδειγμα το συνοβιακό σάρκωμα χαρακτηρίζεται από τη διαμετάθεση SYT-SSX, ενώ το κυψελιδικό ραβδομυοσάρκωμα από την διαμετάθεση PAX-FOXO1. Το 2002 αναγνωρίστηκαν περισσότεροι από 50 διαφορετικοί ιστότυποι σαρκωμάτων2, ενώ περαιτέρω ταυτοποίηση βασισμένη στις νέες μεθόδους οδήγησε σε περισσότερες από 100 οντότητες, οι οποίες περιλαμβάνουν περίπου 77 κακοήθεις και 29 ενδιάμεσους υπότυπους1,3. Χάρη στην πρόοδο των τεχνικών ανίχνευσης γενετικών ανωμαλιών, συνεχώς ανακαλύπτονται νέοι υπότυποι, όπως οι όγκοι με αναδιάταξη του γονιδίου BCOR4, οι οποίοι αποτελούν ξεχωριστή κλινική οντότητα. Έτσι προέκυψε η νέα κατάταξη του Παγκόσμιου Οργανισμού Υγείας (Πίνακας 1), η οποία περιλαμβάνει νέες κατηγορίες βάσει μοριακών χαρακτηριστικών, όπως οι όγκοι με διαμεταθέσεις NTRK5. Οι συνηθέστεροι ιστολογικοί τύποι είναι οι στρωματικοί όγκοι του γαστρεντερικού (gastrointestinal stromatic tumor, GIST), το λιποσάρκωμα, το λειομυοσάρκωμα και το αδιαφοροποίητο πλειόμορφο σάρκωμα (πρώην «κακόηθες ινώδες ιστιοκύττωμα», όρος που έχει πλέον καταργηθεί).
Έχει πλέον καταστεί σαφές ότι τα διάφορα σαρκώματα μαλακών μορίων έχουν διαφορετική συμπεριφορά και δεν μπορούν να αντιμετωπιστούν ως ενιαία ομάδα. Ακόμα και στον ίδιο ιστότυπο μπορεί να υπάρχει σημαντική ετερογένεια, με χαρακτηριστικό παράδειγμα το λιποσάρκωμα, το οποίο απαρτίζεται από τις εξής διακριτές υποομάδες: καλώς διαφοροποιημένο (ενίσχυση γονιδίων MDM2 και CDK4), αποδιαφοροποιημένο λιποσάρκωμα (ίδιες γενετικές ανωμαλίες με το καλώς διαφοροποιημένο), μυξοειδές/στρογγυλοκυτταρικό λιποσάρκωμα (διαμετάθεση FUS-DDIT3) και πλειόμορφο λιποσάρκωμα (σύνθετος καρυότυπος). Σύμφωνα λοιπόν με τη σύγχρονη προσέγγιση των σαρκωμάτων μαλακών μορίων βάσει ιστοτύπου («histotype-tailored»), το συνοβιακό σάρκωμα θεωρείται χημειοευαίσθητος όγκος και συχνά πριν τη χειρουργική εξαίρεση ενδείκνυται νεοεπικουρική χημειοθεραπεία. Αντιθέτως, το ινοσάρκωμα αντιμετωπίζεται ως επί το πλείστον με τοπικές θεραπείες, μιας και η συστηματική θεραπεία δεν προσφέρει ιδιαίτερο όφελος. Το κυψελιδικό σάρκωμα μαλακών μορίων, από την άλλη, είναι ευαίσθητο σε αναστολείς τυροσινικής κινάσης και στην ανοσοθεραπεία. Επομένως η αρχική διάγνωση και ταυτοποίηση του ιστοτύπου σαρκώματος είναι υψίστης σημασίας για τον σχεδιασμό του θεραπευτικού πλάνου του ασθενούς.
Με βάση τα παραπάνω, η ιστολογική διάγνωση των σαρκωμάτων πρέπει να τίθεται από παθολογοανατόμο με εμπειρία στα σαρκώματα. Από διάφορες μελέτες επανεκτίμησης σαρκωμάτων από έμπειρους παθολογοανατόμους έχει φανεί ότι η ακριβής διάγνωση μπορεί να αλλάξει σε ποσοστό έως 40%6,7. Οι διάφορες τεχνικές μοριακής βιολογίας είναι ένα σημαντικό εργαλείο για την ακριβή κατάταξη των σαρκωμάτων, μιας και αυξάνουν τη διαγνωστική ακρίβεια τόσο επιβεβαιώνοντας τη διάγνωση ενός συγκεκριμένου ιστοτύπου (μέσω ανεύρεσης της αντίστοιχης μοριακής ανωμαλίας), όσο και αποκλείοντας μία διάγνωση. Επίσης, σε συγκεκριμένες περιπτώσεις έχουν προβλεπτικό ρόλο στην ανταπόκριση σε θεραπεία και εμπλέκονται άμεσα στην επιλογή της κατάλληλης φαρμακευτικής θεραπείας («theranostics»), όπως στην περίπτωση των μεταλλάξεων στα γονίδια c-KIT και PDGFR-α στα GIST8. Ωστόσο, η μοριακή βιολογία δεν μπορεί να υποκαταστήσει τον έμπειρο παθολογοανατόμο, ο οποίος συνδυάζοντας τα μορφολογικά και μοριακά (εφόσον είναι διαθέσιμα) δεδομένα θα θέσει την τελικά διάγνωση. Είναι χαρακτηριστική η πιθανή ύπαρξη αναδιατάξεων του ίδιου γονιδίου σε διαφορετικούς τύπους σαρκωμάτων, όπως του EWSR1 στο σάρκωμα Ewing, στο εξωσκελετικό μυξοειδές χονδροσάρκωμα και σπανίως στο μυξοειδές λιποσάρκωμα9.
Αρχική Διάγνωση και Αντιμετώπιση: Ανάγκη (Προεγχειρητικής) Βιοψίας
Μία από τις σημαντικές εξελίξεις στα σαρκώματα τα τελευταία χρόνια αποτελεί η ένδειξη της (προεγχειρητικής) βιοψίας και η εγκατάλειψη παλαιότερων αντιλήψεων περί κινδύνου διασποράς των κυττάρων του όγκου. Ο λόγος είναι ότι πρέπει το ενδεχόμενο χειρουργείο να σχεδιαστεί σωστά πριν την πραγματοποίησή του, μιας και τα χειρουργικά όρια πλέον διαφοροποιούνται ανάλογα με τον ιστότυπο («histology-tailored surgical margins»). Έτσι, γίνονται πιο εκτεταμένα χειρουργεία για ενδοκοιλιακά λιποσαρκώματα (με ενδεχόμενη αφαίρεση γειτονικών οργάνων), τα οποία υποτροπιάζουν συχνότερα τοπικά, από ότι για λειομυοσαρκώματα, τα οποία δίνουν συχνά πνευμονικές μεταστάσεις10,11. Επιπλέον, σε κάποιους ιστότυπους είναι χρήσιμη ή και απαραίτητη η προεγχειρητική χημειοθεραπεία, όπως στο εμβρυϊκό ραβδομυοσάρκωμα, το PNET (primitive neuroectodermal tumor) και το συνοβιακό σάρκωμα)12.
Έτσι, επί εμφανίσεως κάποιας διόγκωσης στα μαλακά μόρια συνίσταται μαγνητική τομογραφία της περιοχής, η οποία θέτει την υπόνοια σαρκώματος και παραπέμπει σε βιοψία. Η βιοψία επιβάλλεται πριν από οποιαδήποτε παρέμβαση, εκτός από την περίπτωση επιφανειακής μάζας διαμέτρου ≤3 εκ, η οποία μπορεί να εξαιρεθεί κατευθείαν χειρουργικά. Η βιοψία (με χοντρή βελόνη/Tru-Cut ή ανοιχτή βιοψία) πρέπει να διενεργείται από χειρουργό ή επεμβατικό ακτινολόγο με εμπειρία στα σαρκώματα, ώστε η οδός της να αφαιρείται κατά τη μετέπειτα χειρουργική επέμβαση. Σε περίπτωση ανεύρεσης ύποπτης ενδοκοιλιακής ή ενδοθωρακικής μάζας σε απεικονιστικό έλεγχο, η βιοψία διενεργείται συνήθως υπό αξονικό τομογράφο. Οι απεικονιστικές εξετάσεις για τη σταδιοποίηση γενικώς περιλαμβάνουν μία αξονική τομογραφία θώρακος και εξειδικεύονται κατά περίπτωση, μιας και ο τύπος του σαρκώματος καθορίζει και την εντόπιση των μεταστάσεων. Τα σαρκώματα των άκρων για παράδειγμα δίνουν συχνότερα μεταστάσεις στον πνεύμονα13, ενώ τα σπλαγχνικά και οπισθοπεριτοναϊκά σαρκώματα στο ήπαρ14. Το μυξοειδές λιποσάρκωμα μπορεί να δώσει και οστικές μεταστάσεις, ενώ το κυψελιδικό σάρκωμα μαλακών μορίων και εγκεφαλικές15.
Αντιμετώπιση σε Εξειδικευμένα Κέντρα Από Εξειδικευμένους Ιατρούς
Άλλο ένα σημαντικό επίτευγμα στην αντιμετώπιση των σαρκωμάτων μαλακών μορίων είναι η παραπομπή των ασθενών σε ειδικά κέντρα σαρκώματος, όπου γίνεται διεπιστημονική συζήτηση μεταξύ ειδικών χειρουργών, παθολόγων-ογκολόγων, ακτινοθεραπευτών, παθολογοανατόμων και ακτινολόγων, προκειμένου να σχεδιαστεί το θεραπευτικό πλάνο. Στις ΗΠΑ για παράδειγμα, όπως και σε αρκετές χώρες της Ευρώπης και Ασίας, αυτή η τακτική είναι πλέον παγιωμένη. Η Γαλλία έχει πρωτοστατήσει σε αυτή την προσπάθεια και κάθε πιθανή νεοδιάγνωση σαρκώματος βάσει μίας αρχικής ιστολογικής εξέτασης είναι υποχρεωτικό να παραπέμπεται για επανεκτίμηση σε παθολογοανατόμο του εθνικού Δικτύου Παθολογοανατόμων Σαρκωμάτων από το 2009 (http://rreps.sarcomabcb.org/home.htm). Κατόπιν ο ασθενής παραπέμπεται στο δίκτυο των κλινικών ιατρών. Υπάρχουν μελέτες που δείχνουν ότι οι ασθενείς που αντιμετωπίζονται σε εξειδικευμένα κέντρα σαρκωμάτων και τηρούνται οι κατευθυντήριες οδηγίες έχουν καλύτερη έκβαση, με όφελος στην ολική επιβίωση16-18. Στη χώρα μας δυστυχώς δεν υπάρχουν τέτοια κέντρα, ωστόσο βρισκόμαστε στην αρχική φάσης δημιουργίας ενός «δικτύου» ιατρών με εξειδίκευση στο σάρκωμα, σε διάφορα κέντρα του δημοσίου και ιδιωτικού τομέα, υπό την αιγίδα της Ελληνικής Ομάδας Σαρκωμάτων και Σπανίων Όγκων (ΕΟΣΣΟ) (https://eosso.gr/).
Θεραπεία Πρώιμης Νόσου
Η en bloc χειρουργική εκτομή επί υγιών ορίων (R0) αποτελεί την βασική θεραπεία για τα εντοπισμένα σαρκώματα, ενώ υπάρχουν ακόμα κάποιες αβεβαιότητες ως προς τη χρήση περι-εγχειρητικής χημειοθεραπείας και ακτινοθεραπείας. Οι χειρουργικές τεχνικές που εφαρμόζονται σήμερα στα σαρκώματα των άκρων είναι λιγότερο ακρωτηριαστικές σε σχέση με το παρελθόν, ενώ υπάρχει πλέον τάση διαστρωμάτωσης του εύρους των ορίων εκτομής ανάλογα με τον ιστότυπο του σαρκώματος11. Σαρκώματα με μεγαλύτερο κίνδυνο τοπικής υποτροπής, όπως το λιποσάρκωμα, πρέπει να εξαιρούνται με ευρύτερα όρια, κάτι που δεν είναι απαραίτητο σε σαρκώματα που σχετίζονται κυρίως με κίνδυνο απομακρυσμένων μεταστάσεων, όπως το λειομυοσάρκωμα. Ωστόσο, η επάρκεια του αρχικού χειρουργείου έχει βρεθεί ότι συνδέεται με την έκβαση και την επιβίωση των ασθενών με εντοπισμένο σάρκωμα μαλακών μορίων16,19,20, και αυτή αντανακλάται στην εμπειρία του κέντρου σε αυτούς τους σπάνιους όγκους, στα χειρουργικά όρια εκτομής και στην τήρηση των κατευθυντήριων οδηγιών για την αντιμετώπιση αυτών των ασθενών στα πλαίσια διεπιστημονικής συζήτησης21. Σε περίπτωση ατελούς εξαίρεσης, συστήνεται ευρύτερη εκτομή για την επίτευξη αρνητικών χειρουργικών ορίων, ανεξαρτήτως οποιασδήποτε επικουρικής θεραπείας.
Πριν λίγα χρόνια η χημειοθεραπεία θεωρούταν ότι δεν είχε καμία θέση σε εντοπισμένα σαρκώματα μαλακών μορίων. Πλέον έχει καταδειχθεί ότι κάθε περιστατικό πρέπει να συζητείται στα πλαίσια ογκολογικού συμβουλίου πριν από οποιαδήποτε θεραπευτική παρέμβαση, γιατί τόσο η χημειοθεραπεία όσο και η ακτινοθεραπεία έχουν θέση σε αρκετές περιπτώσεις, είτε προ- είτε μετ-εγχειρητικά. Το θεραπευτικό πλάνο εξατομικεύεται για κάθε ασθενή, αναλόγως της ηλικίας και των συννοσηροτήτων του, της ευαισθησίας του ιστοτύπου στην χημειοθεραπεία ή ακτινοθεραπεία, του μεγέθους του όγκου, της εντόπισής του (επιφανειακός ή εν τω βάθει), της δυνατότητας πλήρους εκτομής και του ιστολογικού βαθμού κακοήθειας. Η χρήση χημειοθεραπείας βασίζεται στο ότι σημαντικός αριθμός ασθενών θα αναπτύξει μεταστατική νόσο, ο δε κίνδυνος αυτός αυξάνει όσο μεγαλύτερο είναι το μέγεθος του όγκου και ο βαθμός κακοήθειας. Επιπροσθέτως η χρήση νέο-επικουρικής χημειοθεραπείας στοχεύει στην μείωση του όγκου ώστε να αυξηθούν οι πιθανότητες επίτευξης RO εκτομής. Χημειοευαίσθητοι ιστότυποι θεωρούνται κατά πρώτο το συνοβιακό σάρκωμα και το αδιαφοροποίητο πλειόμορφο σάρκωμα, και κατά δεύτερο το μυξοειδές-στρογγυλοκυτταρικό λιποσάρκωμα και το λειομυοσάρκωμα. Η πολύ ενδιαφέρουσα διεθνής μελέτη ISG-STS 1001 συνέκρινε το σχήμα ανθρακυκλίνης-ιφωσφαμίδης έναντι χημειοθεραπείας προσαρμοσμένης στον ιστότυπο και ανέδειξε υπεροχή του κλασσικού σχήματος, με εξαίρεση την τραβεκτιδίνη στο μυξοειδές λιποσάρκωμα, η οποία βρέθηκε ισοδύναμη του συνδυασμού ανθρακυκλίνης22. Οι περισσότερες μελέτες (νέο)επικουρικής χημειοθεραπείας έχουν συμπεριλάβει ασθενείς με σαρκώματα μαλακών μορίων των άκρων, ενώ σε εξέλιξη βρίσκεται η πρώτη διεθνής προοπτική μελέτη νεοεπικουρικής χημειοθεραπείας σε οπισθοπεριτοναϊκά σαρκώματα (ClinicalTrials.gov/NCT04031677). Έτσι, η μελέτη STRASS ΙΙ θα συγκρίνει την επιβίωση ελεύθερη προόδου νόσου με την χορήγηση 3 κύκλων νέο-επικουρικής χημειοθεραπείας προσαρμοσμένης στον ιστότυπο (σε λειομυοσάρκωμα και αποδιαφοροποιημένο λιποσάρκωμα) ακολουθούμενη από χειρουργείο έναντι χειρουργείου μόνο.
Η περιεγχειρητική ακτινοθεραπεία δίνεται με σκοπό την μείωση του κινδύνου τοπικής υποτροπής, ενώ η επίδρασή της στην ολική επιβίωση των ασθενών είναι αμφιλεγόμενη. Ενδείκνυται σε περιπτώσεις σαρκωμάτων μαλακών μορίων των άκρων αυξημένου κινδύνου τοπικής υποτροπής, βάσει μεγέθους, βάθους και ιστολογικού βαθμού κακοήθειας όγκου, καθώς και σε ακτινοευαίσθητους ιστότυπους όπως το μυξοειδές λιποσάρκωμα. Η προεγχειρητική ακτινοθεραπεία κερδίζει όλο και περισσότερο έδαφος έναντι της μετεγχειρητικής, λόγω μικρότερης χορηγούμενης δόσης και μείωσης κινδύνου μακροπρόθεσμων παρενεργειών. Στα εξαιρέσιμα οπισθοπεριτοναϊκά σαρκώματα η χρήση της ακτινοθεραπείας είναι αμφιλεγόμενη. Πρόσφατα ανακοινώθηκαν τα αποτελέσματα της διεθνούς μελέτης STRASS Ι (EORTC-62092), η οποία συμπεριέλαβε 266 ασθενής με οπισθοπεριτοναϊκά σαρκώματα υψηλού κινδύνου υποτροπής και συνέκρινε τη χορήγηση προεγχειρητικής ακτινοθεραπείας ακολουθούμενης από χειρουργική εξαίρεση έναντι χειρουργείου μόνο. Το τελικό καταληκτικό σημείο ήταν η επιβίωση ελεύθερη υποτροπής στην κοιλιά και φάνηκε ότι μόνο οι ασθενείς με μυξοειδές λιποσάρκωμα έχουν όφελος από την ακτινοθεραπεία23.
Υπάρχουν και νέες προσεγγίσεις νεοεπικουρικής θεραπείας υπό διερεύνηση, όπως ο συνδυασμός χημειοθεραπείας με τραβεκτεδίνη και ακτινοθεραπείας στο μυξοειδές λιποσάρκωμα24 και ο συνδυασμός ανοσοθεραπείας και ακτινοθεραπείας σε πλειόμορφο αδιαφοροποίητο σάρκωμα και αποδιαφοροποιημένο λιποσάρκωμα25. Προς το παρόν έχει καταδειχθεί η ασφάλεια αυτών των συνδυασμών, ενώ υπάρχουν κάποιες πρώιμες ενδείξεις αποτελεσματικότητας.
Θεραπεία Προχωρημένης / Μεταστατικής νόσου
Η συστηματική θεραπεία της μεταστατικής νόσου έχει σημειώσει πρόοδο τα τελευταία χρόνια, παρά το γεγονός ότι τα κύρια φάρμακα στα σαρκώματα μαλακών μορίων παραμένουν οι ανθρακυκλίνες και η ιφωσφαμίδη. Η τραβεκτεδίνη, η οποία προέρχεται από το χιτωνοφόρο Ecteinascidia turbinata στην Καραϊβική θάλασσα, αποτελεί μία σημαντική εξέλιξη στη θεραπεία των σαρκωμάτων μαλακών μορίων, μιας και μπορεί να χορηγηθεί στην 2η ή περαιτέρω γραμμή θεραπείας, με καλό προφίλ ασφάλειας και για μεγάλα χρονικά διαστήματα26. Τα επονομαζόμενα L-σαρκώματα (λειομυοσάρκωμα και λιποσάρκωμα) είναι ιδιαιτέρως ευαίσθητα στο φάρμακο αυτό. Διάφοροι συνδυασμοί του βρίσκονται υπό μελέτη, όπως αυτός με τον αναστολέα PARP olaparib27,28. Ένας πολύ ενδιαφέρον συνδυασμός είναι αυτός της τραβεκτεδίνης και δοξορουβικίνης, ο οποίος δοκιμάστηκε στην πρώτη γραμμή θεραπείας προχωρημένων λειομυοσαρκωμάτων και οδήγησε σε διάμεση επιβίωση ελεύθερη προόδου νόσου ίση με 10,1 μήνες29. Με βάση αυτά τα αποτελέσματα, ο συνδυασμός συγκρίθηκε έναντι της μονοθεραπείας με ανθρακυκλίνη και φάνηκε η υπεροχή του, παρά την αυξημένη τοξικότητα30.
Η κατανόηση της βιολογίας των σαρκωμάτων και η ολοένα και πιο ακριβής κατάταξή τους έχει οδηγήσει στην ανάδειξη φαρμάκων με ιδιαίτερη δράση σε συγκεκριμένους ιστότυπους, όπως οι ταξάνες στο αγγειοσάρκωμα31. Ο αναστολέας των μικροσωληνίσκων εριβουλίνη, άλλο ένα φάρμακο προερχόμενο από τη θάλασσα και συγκεκριμένα ανάλογο του halichondrin B, προϊόν του σπόγγου Halichondria okadai, έχει δείξει όφελος στην ολική επιβίωση σε ασθενείς με λιποσάρκωμα σε μελέτη φάσης III32. Επιπλέον, στη μελέτη φάσης I/II LEADER δοκιμάστηκε ο συνδυασμός εριβουλίνης με τον αναστολέα τυροσινικής κινάσης (TKI) λενβατινίμπη σε λιποσάρκωμα και λειομυοσάρκωμα και βρέθηκε ασφαλής, οδηγώντας σε διάμεση επιβίωση ελεύθερη προόδου νόσου ίση με 8,5 μήνες33. Βάσει αυτών των αποτελεσμάτων, ο συνδυασμός αυτός θα διερευνηθεί περαιτέρω.
Εκτός από τα χημειοθεραπευτικά φάρμακα, υπάρχουν δεδομένα προερχόμενα κυρίως από μικρές μελέτες φάσης 2 ή αναδρομικές μελέτες για την αποτελεσματικότητα στοχευουσών θεραπειών σε συγκεκριμένους ιστοτύπους σαρκωμάτων. Οι αναστολείς τυροσινικής κινάσης αποτελούν την κυριότερη κατηγορία. Το κυψελιδικό σάρκωμα μαλακών μορίων είναι ένα σπάνιος υπότυπος σαρκώματος μαλακών μορίων χωρίς ευαισθησία στη χημειοθεραπεία, που χαρακτηρίζεται από τη διαμετάθεση t(X;17)(p11;q25), με αποτέλεσμα την αυξορρύθμιση μετταγράφων που σχετίζονται με την αγγειογένεση. Οι αντιαγγειογενετικοί παράγοντες σεντιρανίμπη και παζοπανίμπη έχουν δράση σε αυτό το σάρκωμα34-36. Η κριζοτινίμπη είναι αποτελεσματική στον φλεγμονώδη μυοϊνοβλαστικό όγκο με αναδιάταξη του γονιδίου ALK (40-50% των περιπτώσεων) 37,38.
Ο αναστολέας της μεθυλοτρανσφεράσης PRC2 ταζεμετοστάτη αποτελεί μια νέα προσέγγιση στοχευουσών θεραπειών με δράση στην επιγενετική και πρόσφατα εγκρίθηκε από τον Οργανισμό Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) σε «ταχεία» βάση στο προχωρημένο επιθηλιοειδές σάρκωμα39. Σε αυτόν τον σπάνιο τύπο σαρκώματος, χωρίς ιδιαίτερη ευαισθησία στην κλασσική χημειοθεραπεία, η απώλεια της ανασταλτικής πρωτεΐνης INI1 προκαλεί αυξημένη δραστηριότητα του ενζύμου PRC2, με αποτέλεσμα την ογκογενετική μεταλλαγή. Ωστόσο, ο Ευρωπαϊκός Οργανισμός Φαρμάκων (EMA) δεν έχει δώσει έγκριση στο φάρμακο προς το παρόν.
Οι αναστολείς NTRK αποτελούν μία νέα κατηγορία στοχευουσών θεραπειών, οι οποίοι είναι ιδιαιτέρως αποτελεσματικοί σε όγκους με διαμεταθέσεις των γονιδίων NTRK που κωδικοποιούν τους υποδοχείς tropomyosin receptor kinase (Trk), ανεξαρτήτως ιστού προέλευσης. Η μελέτη με σχεδιασμό καλαθιού (basket) NAVIGATE ανέδειξε ανταποκρίσεις διαρκείας στο φάρμακο λαροτρεκτινίμπη στο 80% των ασθενών με διάφορους όγκους με αναδιατάξεις NTRK, συμπεριλαμβανομένου και σαρκωμάτων40. Παρόμοια αποτελέσματα έδωσε και ο αναστολέας NTRK εντρεκτινίμπη σε μια μελέτη αντίστοιχου σχεδιασμού41,42. Τα θεαματικά αυτά αποτελέσματα έχουν οδηγήσει σε έγκριση και των δύο φαρμάκων.
Επιπροσθέτως, εγκρίθηκαν πολύ πρόσφατα δύο νέα φάρμακα στους γαστρεντερικούς στρωματικούς όγκους (GIST). Ο αναστολέας τυροσινικής κινάσης ριπρετινίμπη είναι αποτελεσματικός σε προθεραπευμένους ασθενείς με ιματινίμπη, σουνιτινίμπη και ρεγκοραφενίμπη, όπως έδειξε η μελέτη φάσης ΙΙΙ INVICTUS στην οποία συγκρίθηκε έναντι του εικονικού φαρμάκου43. Στους γαστρεντερικούς στρωματικούς όγκους με μετάλλαξη PDGFRα D842, για τους οποίους δεν υπήρχε καμία αποτελεσματική θεραπείας μιας και η ιματινίμπη και οι άλλοι αναστολείς του KIT δεν είχαν δράση, πλέον υπάρχει ο στοχεύων παράγοντας αβαπριτινίμπη44.
Οι δεσμοειδείς όγκοι είναι ένας ακόμα πολύ ιδιαίτερος υπότυπος σαρκωμάτων στον οποίο ανακοινώθηκαν πολύ ενθαρρυντικά αποτελέσματα από μια νέα κατηγορία φαρμάκων. Πλέον έχει φανεί ότι οι δεσμοειδείς όγκοι αρχικά αντιμετωπίζονται με την τακτική της απλής παρακολούθησης («wait and see»), εκτός από περιπτώσεις συμπτωματικής νόσου ή επαπειλούμενης απώλειας λειτουργικότητας. Επί διαδοχικών προόδων νόσου συστήνεται συστηματική ή τοπική θεραπεία45. Τα διαθέσιμα φάρμακα (πεγκυλιωμένη λιποσωμιακή δοξορουβικίνη, αλκαλοειδή της Vinca, ταξάνες, αντιφλεγμονώδη, ταμοξιφαίνη) βασίζονται σε δεδομένα μικρών και κυρίως αναδρομικών μελετών. Ο αναστολέας της γ-σεκρετάσης νιρογκασεστάτη έχει ιδιαίτερη δράση στους δεσμοειδείς όγκους και μόλις πρόσφατα ανακοινώθηκαν στο ESMO Congress 2022 τα πρώτα θετικά αποτελέσματα της μελέτης φάσης ΙΙΙ DeFi46.
Η ανοσοθεραπεία στα σαρκώματα δεν έχει δείξει όφελος αντίστοιχο άλλων όγκων, όπως ο καρκίνος του νεφρού και το μελάνωμα, και αυτό λόγω του μικροπεριβάλλοντος του όγκου (χαμηλότερη έκφραση PD-L1 και αριθμού λεμφοκυττάρων διηθούντων τον όγκο), του χαμηλότερου φορτίου μεταλλάξεων του όγκου και της ετερόγενειας των σαρκωμάτων. Οι πρώτες μελέτες με αναστολείς PD-1/PD-L1 ως μονοθεραπεία συμπεριέλαβαν μικρό σχετικά αριθμό ασθενών με διάφορους ιστότυπους και δεν έδωσαν αξιόλογα αποτελέσματα, εκτός από κάποιες μεμονωμένες ανταποκρίσεις (αδιαφοροποίητο πλειόμορφο σάρκωμα, κυψελιδικό σάρκωμα μαλακών μορίων κλπ47,48. Κατόπιν ακολούθησαν μελέτες συνδυασμών ανοσοθεραπείας με σχετικά καλύτερα αποτελέσματα. Ο πιο ενδιαφέρων συνδυασμός είναι αυτός των αναστολέων PD-1 και ΤΚΙ49,50. Η νιβολουμάμπη σε συνδυασμό με τη σουνιτινίμπη και η πεμπρολιζουμάμπη σε συνδυασμό με την αξιτινίμπη οδήγησαν σε ποσοστό επιβίωσης ελεύθερης προόδου νόσου στους 6 μήνες ίσο με 50% σε ασθενείς με ποικίλα σαρκώματα μαλακών μορίων. Αξίζει να σημειωθεί ότι οι ασθενείς με κυψελιδικό σάρκωμα μαλακών μορίων είχαν ανταποκρίσεις σε όλες τις μελέτες ανοσοθεραπείας. Η ανάλυση των ασθενών με σάρκωμα που ανταποκρίθηκαν στους αναστολείς PD-1 ανέδειξε έναν νέο προβλεπτικό δείκτη ανταπόκρισης στη θεραπεία: τα Β λεμφοκύτταρα (παρουσία λεμφοειδών τριτογενών δομών) 51. Τέλος, νεότερες προσεγγίσεις υιοθετούμενης ανοσοθεραπείας είναι υπό μελέτη στα σαρκώματα. Αξίζει να σημειωθούν τα πρώιμα ελπιδοφόρα αποτελέσματα δύο τέτοιων θεραπειών αυτόλογων λεμφοκυττάρων με γενετικά τροποποιημένο υποδοχέα TCR ώστε να αναγνωρίζει το αντιγόνο MAGE-A4 και NY-ESO-1 που εκφράζεται από ένα σημαντικό ποσοστό ασθενών με συνοβιακό σάρκωμα52 και μυξοειδές/στρογγυλοκυτταρικό λιποσάρκωμα53,54, αντίστοιχα.
Συμπέρασμα
Τα σαρκώματα μαλακών μορίων αποτελούν μία ετερογενή ομάδα σπάνιων όγκων. Η ακριβής ταυτοποίηση του ιστότυπου είναι σημαντική, όπως και η αντιμετώπιση σε εξειδικευμένα κέντρα, για την βέλτιστη αντιμετώπιση αυτών των ασθενών. Για την εξαγωγή αξιόπιστων συμπερασμάτων χρειάζεται να γίνονται μελέτες ανά ιστότυπο, και όχι μελέτες που συμπεριλαμβάνουν ασθενείς με πολλά διαφορετικά σαρκώματα. Υπό αυτές τις συνθήκες, η διενέργεια μεγάλων τυχαιοποιημένων μελετών είναι πολύ δύσκολη και σίγουρα απαιτείται διεθνής συνεργασία, ιδιαίτερα όταν το 20% των ασθενών με σάρκωμα έχουν έναν εξαιρετικά σπάνιο υπότυπο. Ωστόσο, τα δεδομένα από μελέτες φάσης 2 ή αναδρομικές μελέτες μπορεί να είναι πολύ χρήσιμα σε κάποιες περιπτώσεις και να καθοδηγήσουν το θεραπευτικό αλγόριθμο. Αν και έχουν προκύψει αρκετά δεδομένα από τέτοιες μελέτες για φάρμακα (χημειοθεραπείες και στοχεύσουσες θεραπείες) με ιδιαίτερη δράση σε συγκεκριμένους ιστότυπους, οι νέες εγκρίσεις προς το παρόν είναι λιγοστές. Οι πιο αξιοσημείωτοι νέοι στοχευτικοί παράγοντες είναι η λαροτρεκτινίμπη στους όγκους με αναδιάταξη των γονιδίων NTRK, η ταζεμετοστάτη στο επιθηλιοειδές σάρκωμα, η αβαπριτινίμπη και ριπρετινίμπη στους γαστρεντερικούς στρωματικούς όγκους και η νιρογκασεστάτη στους δεσμοειδείς όγκους.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Ducimetière F, Lurkin A, Ranchère-Vince D, et al. Incidence of sarcoma histotypes and molecular subtypes in a prospective epidemiological study with central pathology review and molecular testing. PLoS One. 2011; 6: e20294.
- Fletcher CDM, Krishnan Unni K, Mertens F. WHO Classification of Tumours of Soft Tissue and Bone. Third Edition. 2002.
- Jo VY, Fletcher CDM. WHO classification of soft tissue tumours: an update based on the 2013 (4th) edition. Pathology. 2014; 46: 95–104.
- Gambarotti M, Benini S, Gamberi G, et al. CIC-DUX4 fusion-positive round-cell sarcomas of soft tissue and bone: a single-institution morphological and molecular analysis of seven cases. Histopathology. 2016; 69: 624–634.
- Choi JH, Ro JY. The 2020 WHO Classification of Tumors of Soft Tissue: Selected Changes and New Entities. Adv Anat Pathol. 2021; 28: 44–58.
- Arbiser ZK, Folpe AL, Weiss SW. Consultative (expert) second opinions in soft tissue pathology. Analysis of problem-prone diagnostic situations. Am J Clin Pathol. 2001; 116: 473–476.
- Ray-Coquard I, Montesco MC, Coindre JM, et al. Sarcoma: concordance between initial diagnosis and centralized expert review in a population-based study within three European regions. Ann Oncol. 2012; 23: 2442–2449.
- Bauer S, George S, von Mehren M, Heinrich MC. Early and Next-Generation KIT/PDGFRA Kinase Inhibitors and the Future of Treatment for Advanced Gastrointestinal Stromal Tumor. Front Oncol. 2021; 11: 672500.
- Fisher C. The diversity of soft tissue tumours with EWSR1 gene rearrangements: a review. Histopathology. 2014; 64: 134–150.
- Dingley B, Fiore M, Gronchi A. Personalizing surgical margins in retroperitoneal sarcomas: an update. Expert Rev Anticancer Ther. 2019; 19: 613–631.
- Cable MG, Randall RL. Extremity Soft Tissue Sarcoma: Tailoring Resection to Histologic Subtype. Surg Oncol Clin N Am. 2016; 25: 677–695.
- Pasquali S, Palmerini E, Quagliuolo V, et al. Neoadjuvant chemotherapy in high-risk soft tissue sarcomas: A Sarculator-based risk stratification analysis of the ISG-STS 1001 randomized trial. Cancer. 2022; 128: 85–93.
- Christie-Large M, James SLJ, Tiessen L, Davies AM, Grimer RJ. Imaging strategy for detecting lung metastases at presentation in patients with soft tissue sarcomas. Eur J Cancer. 2008; 44: 1841–1845.
- Okamoto M, Matsuoka M, Soma T, et al. Metastases of soft tissue sarcoma to the liver: A Historical Cohort Study from a Hospital-based Cancer Registry. Cancer Med. 2020; 9: 6159–6165.
- Gonzalez MR, Bryce-Alberti M, Leon-Abarca JA, Pretell-Mazzini J. Brain Metastases in Patients With Soft-Tissue Sarcomas: Management and Survival-A SEER Population-Based Cohort Study. J Am Acad Orthop Surg Glob Res Rev. 2021; 5.
- Derbel O, Heudel PE, Cropet C, et al. Survival impact of centralization and clinical guidelines for soft tissue sarcoma (A prospective and exhaustive population-based cohort). PLoS One. 2017; 12: e0158406.
- Voss RK, Chiang YJ, Torres KE, et al. Adherence to National Comprehensive Cancer Network Guidelines is Associated with Improved Survival for Patients with Stage 2A and Stages 2B and 3 Extremity and Superficial Trunk Soft Tissue Sarcoma. Ann Surg Oncol. 2017; 24: 3271–3278.
- Rossi CR, Vecchiato A, Mastrangelo G, et al. Adherence to treatment guidelines for primary sarcomas affects patient survival: a side study of the European CONnective TIssue CAncer NETwork (CONTICANET). Ann Oncol. 2013; 24: 1685–1691.
- Jang WY, Kim HS, Han I. Impact of surgical margin on survival in extremity soft tissue sarcoma: A systematic review and meta-analysis. Medicine (Baltimore). 2021; 100: e24124.
- Potter BK, Hwang PF, Forsberg JA, et al. Impact of margin status and local recurrence on soft-tissue sarcoma outcomes. J Bone Joint Surg Am. 2013; 95: e151.
- Ray-Coquard I, Thiesse P, Ranchère-Vince D, et al. Conformity to clinical practice guidelines, multidisciplinary management and outcome of treatment for soft tissue sarcomas. Ann Oncol. 2004; 15: 307–315.
- Gronchi A, Palmerini E, Quagliuolo V, et al. Neoadjuvant Chemotherapy in High-Risk Soft Tissue Sarcomas: Final Results of a Randomized Trial From Italian (ISG), Spanish (GEIS), French (FSG), and Polish (PSG) Sarcoma Groups. J Clin Oncol. 2020; 38: 2178–2186.
- Bonvalot S, Gronchi A, Le Péchoux C, et al. Preoperative radiotherapy plus surgery versus surgery alone for patients with primary retroperitoneal sarcoma (EORTC-62092: STRASS): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2020; 21: 1366–1377.
- Gronchi A, Hindi N, Cruz J, et al. Trabectedin and RAdiotherapy in Soft Tissue Sarcoma (TRASTS): Results of a Phase I Study in Myxoid Liposarcoma from Spanish (GEIS), Italian (ISG), French (FSG) Sarcoma Groups. EClinicalMedicine. 2019; 9: 35–43.
- Keung EZ, Lazar AJ, Torres KE, et al. Phase II study of neoadjuvant checkpoint blockade in patients with surgically resectable undifferentiated pleomorphic sarcoma and dedifferentiated liposarcoma. BMC Cancer. 2018; 18: 913.
- Demetri GD, Chawla SP, von Mehren M, et al. Efficacy and safety of trabectedin in patients with advanced or metastatic liposarcoma or leiomyosarcoma after failure of prior anthracyclines and ifosfamide: results of a randomized phase II study of two different schedules. J Clin Oncol. 2009; 27: 4188–4196.
- Grignani G, D’Ambrosio L, Pignochino Y, et al. Trabectedin and olaparib in patients with advanced and non-resectable bone and soft-tissue sarcomas (TOMAS): an open-label, phase 1b study from the Italian Sarcoma Group. Lancet Oncol. 2018; 19: 1360–1371.
- Merlini A, Centomo ML, Ferrero G, et al. DNA damage response and repair genes in advanced bone and soft tissue sarcomas: An 8-gene signature as a candidate predictive biomarker of response to trabectedin and olaparib combination. Front Oncol. 2022; 12: 844250.
- Pautier P, Floquet A, Chevreau C, et al. A single-arm multicentre phase II trial of doxorubicin in combination with trabectedin in the first-line treatment for leiomyosarcoma with long-term follow-up and impact of cytoreductive surgery. ESMO Open. 2021; 6: 100209.
- Pautier P, Italiano A, Piperno-Neumann S, et al. Doxorubicin alone versus doxorubicin with trabectedin followed by trabectedin alone as first-line therapy for metastatic or unresectable leiomyosarcoma (LMS-04): a randomised, multicentre, open-label phase 3 trial. Lancet Oncol. 2022; 23: 1044–1054.
- Penel N, Bui BN, Bay JO, et al. Phase II trial of weekly paclitaxel for unresectable angiosarcoma: the ANGIOTAX Study. J Clin Oncol. 2008; 26: 5269–5274.
- Schöffski P, Chawla S, Maki RG, et al. Eribulin versus dacarbazine in previously treated patients with advanced liposarcoma or leiomyosarcoma: a randomised, open-label, multicentre, phase 3 trial. Lancet. 2016; 387: 1629–1637.
- Chen TWW, Hsu CL, Hong RL, et al. A Single-Arm Phase Ib/II Study of Lenvatinib Plus Eribulin in Advanced Liposarcoma and Leiomyosarcoma. Clin Cancer Res. 2022; CCR-22-2092.
- Judson I, Morden JP, Kilburn L, et al. Cediranib in patients with alveolar soft-part sarcoma (CASPS): a double-blind, placebo-controlled, randomised, phase 2 trial. Lancet Oncol. 2019; 20: 1023–1034.
- Stacchiotti S, Mir O, Le Cesne A, et al. Activity of Pazopanib and Trabectedin in Advanced Alveolar Soft Part Sarcoma. Oncologist. 2018; 23: 62–70.
- Kim M, Kim TM, Keam B, et al. A Phase II Trial of Pazopanib in Patients with Metastatic Alveolar Soft Part Sarcoma. Oncologist. 2019; 24: 20-e29.
- Schöffski P, Sufliarsky J, Gelderblom H, et al. Crizotinib in patients with advanced, inoperable inflammatory myofibroblastic tumours with and without anaplastic lymphoma kinase gene alterations (European Organisation for Research and Treatment of Cancer 90101 CREATE): a multicentre, single-drug, prospective, non-randomised phase 2 trial. Lancet Respir Med. 2018; 6: 431–441.
- Schöffski P, Wozniak A, Stacchiotti S, et al. Activity and safety of crizotinib in patients with advanced clear-cell sarcoma with MET alterations: European Organization for Research and Treatment of Cancer phase II trial 90101 “CREATE.” Ann Oncol. 2017; 28: 3000–3008.
- Gounder M, Schöffski P, Jones RL, et al. Tazemetostat in advanced epithelioid sarcoma with loss of INI1/SMARCB1: an international, open-label, phase 2 basket study. Lancet Oncol. 2020; 21: 1423–1432.
- Drilon A, Laetsch TW, Kummar S, et al. Efficacy of Larotrectinib in TRK Fusion-Positive Cancers in Adults and Children. N Engl J Med. 2018; 378: 731–739.
- Drilon A, Siena S, Ou SHI, et al. Safety and Antitumor Activity of the Multitargeted Pan-TRK, ROS1, and ALK Inhibitor Entrectinib: Combined Results from Two Phase I Trials (ALKA-372-001 and STARTRK-1). Cancer Discov. 2017; 7: 400–409.
- Demetri GD, De Braud F, Drilon A, et al. Updated Integrated Analysis of the Efficacy and Safety of Entrectinib in Patients With NTRK Fusion-Positive Solid Tumors. Clin Cancer Res. 2022; 28: 1302–1312.
- Dhillon S. Ripretinib: First Approval. Drugs. 2020; 80: 1133–1138.
- Jones RL, Serrano C, von Mehren M, et al. Avapritinib in unresectable or metastatic PDGFRA D842V-mutant gastrointestinal stromal tumours: Long-term efficacy and safety data from the NAVIGATOR phase I trial. Eur J Cancer. 2021; 145: 132–142.
- Desmoid Tumor Working Group. The management of desmoid tumours: A joint global consensus-based guideline approach for adult and paediatric patients. Eur J Cancer. 2020; 127: 96–107.
- LBA2 ‘DeFi: a phase 3, randomized controlled trial of nirogacestat versus placebo for progressing desmoid tumours (DT)’ will be presented by Bernd Kasper during Presidential Symposium 1 on Saturday, 10 September, 16:30 to 18:00 CEST in Paris Auditorium. Annals of Oncology, Volume 33 Supplement 7, September 2022.
- D’Angelo SP, Mahoney MR, Van Tine BA, et al. Nivolumab with or without ipilimumab treatment for metastatic sarcoma (Alliance A091401): two open-label, non-comparative, randomised, phase 2 trials. Lancet Oncol. 2018; 19: 416–426.
- Tawbi HA, Burgess M, Bolejack V, et al. Pembrolizumab in advanced soft-tissue sarcoma and bone sarcoma (SARC028): a multicentre, two-cohort, single-arm, open-label, phase 2 trial. Lancet Oncol. 2017; 18: 1493–1501.
- Wilky BA, Trucco MM, Subhawong TK, et al. Axitinib plus pembrolizumab in patients with advanced sarcomas including alveolar soft-part sarcoma: a single-centre, single-arm, phase 2 trial. Lancet Oncol. 2019; 20: 837–848.
- Martin-Broto J, Hindi N, Grignani G, et al. Nivolumab and sunitinib combination in advanced soft tissue sarcomas: a multicenter, single-arm, phase Ib/II trial. J Immunother Cancer. 2020; 8: e001561.
- Petitprez F, de Reyniès A, Keung EZ, et al. B cells are associated with survival and immunotherapy response in sarcoma. Nature. 2020; 577: 556–560.
- Gyurdieva A, Zajic S, Chang YF, et al. Biomarker correlates with response to NY-ESO-1 TCR T cells in patients with synovial sarcoma. Nat Commun. 2022; 13: 5296.
- Banks LB, D’Angelo SP. The Role of Immunotherapy in the Management of Soft Tissue Sarcomas: Current Landscape and Future Outlook. J Natl Compr Canc Netw. 2022; 20: 834–844.
- D’Angelo SP, Druta M, Van Tine BA, et al. Primary efficacy and safety of letetresgene autoleucel (lete-cel; GSK3377794) pilot study in patients with advanced and metastatic myxoid/round cell liposarcoma (MRCLS). JCO. 2022; 40(16_suppl): 11500.
CMJ 2022; 5: 301-309