Progress for the Effective Prevention and Treatment of Recurrent Clostridium Difficile Infection
Η λοίμωξη από το Clostridiumdifficile (CDI) εξακολουθεί να είναι η κύρια αιτία νοσηρότητας και θνητότητας κι εξακολουθεί να είναι η συνηθέστερη αιτία της νοσοκομειακής διάρροιας στον αναπτυσσόμενο κόσμο1,2. Η αντιμετώπιση των ασθενών με υποτροπιάζουσα CDI εξακολουθεί να αποτελεί σημαντική πρόκληση. Η ελαττωμένη αποτελεσματικότητα της μετρονιδαζόλης και η αυξημένη συχνότητα της πολλαπλώς υποτροπιάζουσας νόσου έχουν οδηγήσει την έρευνα σε νέες προσεγγίσεις αναφορικά με την πρόληψη και τη θεραπεία της υποτροπιάζουσας CDI1-3.
Από επιδημιολογικής απόψεως, οι περισσότερες περιπτώσεις CDI παρουσιάζονται κατά τη διάρκεια ή ολίγον μετά τη χρήση αντιμικροβιακού φαρμάκου1-3 αν και ο κίνδυνος μπορεί να παρατείνεται πλέον των 90 ημερών1-3. Η κλινδαμυκίνη, άλλες μακρολίδες, κεφαλοσπορίνες τρίτης γεννεάς, πενικιλλίνες και φλουοροκινολόνες είναι τα αντιβιοτικά πλέον συχνά συνοδευόμενα με CDI4,5. Η χρήση αυτών των ευρέος φάσματος αντιβιοτικών προκαλεί την αυξημένη ευαισθησία του ασθενούς στην CDI και ελαττωμένη ανοσία, ιδιαιτέρως σε ιδρυματικούς ασθενείς (νοσοκομεία και οίκους ευγηρίας).
Υποτροπιάζουσα CDI: Η υποτροπιάζουσα CDI μπορεί να οριστεί ως η επανεμφάνιση συμπτωμάτων μετά την ολοκλήρωση της πορείας της θεραπείας και η οποία έχει ως αποτέλεσμα την πλήρη αντιμετώπιση αυτών των συμπτωμάτων. Οι Ευρωπαϊκές οδηγίες ορίζουν την υποτροπή ως συμπτώματα παρατηρούμενα εντός 8 εβδομάδων μετά από την υποχώρηση του προηγούμενου επεισοδίου μετά τη συμπλήρωση της αρχικής θεραπείας6. Πάντως, σε άλλες μελέτες δίδονται διαφορετικοί ορισμοί. Ο Louie και συνεργάτες7 και Cornely και συνεργάτες8 ορίζουν την κλινική υποτροπή ως επανεμφάνιση περισσότερων των 3 διαρροϊκών κοπράνων το 24ωρο εντός 4 εβδομάδων μετά την παύση της θεραπείας, την ανεύρεση τοξίνης του C. difficile στα κόπρανα και ανάγκης για νέα θεραπεία της CDI. Ο Heimann και συνεργάτες9 την ορίζουν ως άνω αλλά μεταξύ 14 και 21 εβδομάδων μετά την παύση της θεραπείας της CDI. Ο Lubbert και συνεργάτες10 δεν χρειάζονται την παρουσία θετικού αποτελέσματος της τοξίνης αλλά διάρροια υποτροπιάζουσα εντός 11 έως 60 ημερών συνεχούς παρακολούθησης. Συμβάματα εντός 0 έως 10 ημέρες της συνεχούς παρακολούθησης δε συνυπολογίζεται ως υποτροπή επειδή η κανονική φαρμακευτική θεραπεία της CDI φτάνει τις 10 ημέρες, ενώ συμβάματα παρατηρούμενα μετά 60 ημέρες υπολογίζονται ως νέος δείκτης συμβάματος. Μετά το πρώτο επεισόδιο, υποτροπές της νόσου παρατηρούνται περίπου στο 15-35% των ασθενών10. Μετά την πρώτη υποτροπή, ο κίνδυνος νέας λοίμωξης αυξάνεται στο 45-60%1,8. Η υποτροπιάζουσα νόσος προκαλείται είτε από υποτροπή της λοιμώξεως, με το αυτό στέλεχος από το μολυσμένο περιβάλλον ή κακή υγιεινή των χεριών ή υποτροπή από διαφορετικό στέλεχος. Η αντίσταση στη βανκομυκίνη ή μετρονιδαζόλη δεν θεωρείται ως παράγοντας υποτροπής στη CDI, αλλά αυτά τα αντιβιοτικά μπορεί να συμβάλλουν στη συνέχιση της εντερικής δυσβιώσεως. Η υποτροπιάζουσα λοίμωξη είναι πλέον συχνή στα άτομα ηλικίας >65ετών, γυναίκες, αυτούς με πρόσφατη χρήση αντιβιοτικού, ταυτόχρονη χρήση αναστολέων αντλίας πρωτονίων (PPIs) και πολύ σοβαρή αρχική νόσο11. Ως παράγοντες κινδύνου που έχουν αναγνωριστεί είναι η παρουσία συνοσηροτήτων, αντινεοπλασματική χημειοθεραπεία, ανεπαρκής απάντησηIg αντισώματος στην τοξίνη Α μετά το αρχικό επεισόδιο, χρόνια νεφρική νόσος, υπογαμμασφαιριναιμία, ανοσοανεπάρκεια και αναστολείς αντλίας πρωτονίων (PPIs)11-13. Επιπλέον, σε άτομα μολυνθέντα με το C. difficile, έχει βρεθεί ότι τα χαμηλά επίπεδα της βιταμίνης D είναι ανεξάρτητος δείκτης πτωχής εκβάσεως και συνοδεύεται με υψηλότερη υποτροπή14.
Θεραπεία: Η θεραπεία της αρχικής CDI υποτροπής συμπεριλαμβάνει την επανάληψη χορηγήσεως είτε της μετρονιδαζόλης ή βανκομυκίνης από το στόμα για 10-14 ημέρες. Το ποσοστό επιτυχούς θεραπείας φθάνει μόνο το 50%12. Η χρήση της μετρονιδαζόλης δεν συνιστάται πέραν της πρώτης υποτροπής της CDI λόγω του κινδύνου νευροτοξικότητας από τον μεταβολισμό της αζόλης. Η δεύτερη υποτροπή μπορεί να θεραπεύεται με την φιδαξομυκίνη ή διαλεπτυνομένου σχήματος βανκομυκίνης5.
Η φιδαξομυκίνη έχει στενό φάσμα αντιμικροβιακής δραστηριότητας και φαίνεται ότι είναι τουλάχιστον αποτελεσματική όπως η από του στόματος βανκομυκίνη για την πρώτη σειρά θεραπείας της CDI με λιγότερες υποτροπές σε ασθενείς μη μολυνθέντες με υψηλής μολυσματικότητας στέλεχος.
Η ετερόλογη μεταμόσχευση κοπράνωνείναι μια υπό έρευνα θεραπεία η οποία έχει υψηλή αποτελεσματικότητα στη θεραπεία και πρόληψη της υποτροπής της CDI. Αυτή γενικά χρησιμοποιείται μόνο σε ασθενείς με σοβαρά, ανθεκτική CDI ή σε ασθενείς που έχουν πολλαπλές υποτροπές. Πάντως, χρειάζονται περισσότερες τυχαιοποιημένες, ελεγχόμενες μελέτες και η μακράς διαρκείας ασφάλεια δεν είναι γνωστή.
Προσφάτως εισήχθηκε στην αντιμετώπιση της υποτροπιάζουσας CDI λοίμωξης η θεραπεία με μονοκλωνικά αντισώματα και δη με Βεζλοτοξουμάμπη. Η έγκριση για την βεζλοτοξουμάμπη βασίστηκε στα αποτελέσματα δύο τυχαιοποιημένων, διπλών-τυφλών, placebo-ελεγχόμενων μελετών (MODIFY I και II) που συμπεριελάμβαναν 2655 ασθενείς, μερικοί των οποίων είχαν υποβληθεί σε θεραπεία με ακτοξουμάμπη, φάρμακο που εξουδετερώνει την τοξίνη Α και βρέθηκε σημαντική ελάττωση της συχνότητας υποτροπής σε ασθενείς με παράγοντες κινδύνου για υποτροπή που έλαβαν μια απλή έγχυση βεζλοτοξουμάμπης παραλλήλως με την κανονική αντιβιοτική θεραπεία για την CDI (MODIFY I 22% έναντι 33% placebo και MODIFY II 19% έναντι 33% placebo). Η υποτροπή οριζόταν ως νέο επεισόδιο εντός 12 εβδομάδων της αρχικής εγχύσεως της βεζλοτοξουμάμπης. Η έκβαση της θεραπείας κατά το διάστημα των 12 εβδομάδων μετά την έγχυση ήταν σημαντικά υψηλότερη με την βεζλοτοξουμάμπη έναντι placebo στην MODIFY I (67% έναντι 52%), αλλά όχι στην MODIFY I (60% έναντι 55%). Η αποτελεσματικότητα της βεζλοτοξουμάμπης δεν εξαρτάται από την εκλογή της αντιβακτηριακής θεραπείας. Ναυτία, πυρετός και κεφαλαλγία είναι οι πλέον συχνές ανεπιθύμητες ενέργειες με την βεζλοτοξουμάμπη16.
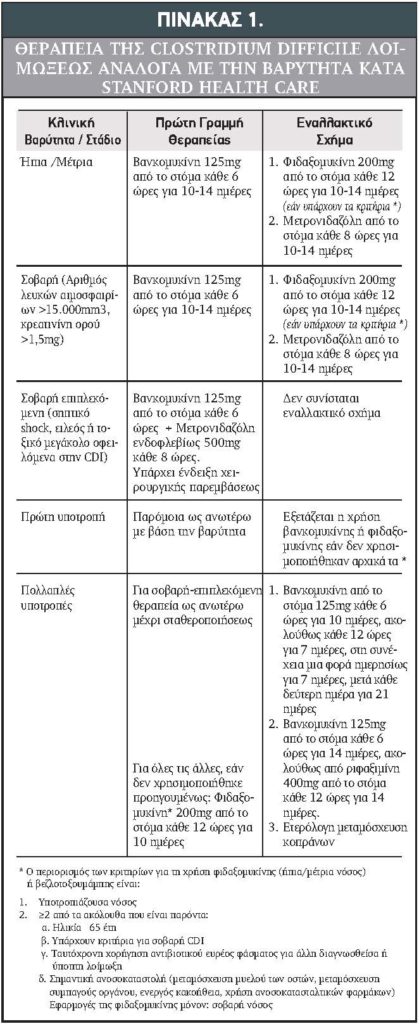
Στον Πίνακα 1 αναφέρεται περιληπτικά η αντιμετώπιση των ασθενών με Clostridium difficile λοίμωξη17.
Συμπέρασμα
Η CDI είναι η πλέον συχνή αιτία της νοσοκομειακής διάρροιας. Κατά τη θεραπεία των ασθενών υπάρχουν σημαντικά διλήμματα και η νόσος προκαλεί αυξημένη νοσηρότητα και σε ακραίες περιπτώσεις μπορεί να έχει ως αποτέλεσμα το θάνατο. Η υποτροπιάζουσα CDI μετά την αρχική θεραπεία προκαλεί σημαντική νοσηρότητα και μεγάλο κόστος στη συνολική θεραπεία. Κατά τα τελευταία έτη έχει επιτευχθεί σημαντική πρόοδος στην πρόληψη και θεραπεία της υποτροπιάζουσας CDI.
Η βεζλοτοξουμάμπη 10mg/Kg ενδοφλεβίως x1 μπορεί να χρησιμοποιηθεί ως επιπρόσθετη θεραπεία για την πρόληψη της υποτροπής σε οποιοδήποτε στάδιο της νόσου και εάν υπάρχουν τα κριτήρια θα πρέπει να εξετάζεται κατά ισχυρό τρόπο ως μέρος της θεραπείας για υποτροπιάζουσα διάρροια.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- McDonald LC, Gerding DL, Johnson S, et al. Clinical practices guidelines for Clostridium difficile infection in adults and children: 2017 update by the Infectious Diseases Society of America (IDSA) and Society for Health Care Epidemiology (SHEA). Clin Infect Dis 2018; xx(00): 1-48.
- Barreto TW, Link W.Clostridium difficile: Prevention and treatment. Am Fam Physician 2018; 97: 196-199.
- Ma GK, Brensinger CM, Wu Q, Lewis JD. Increasing incidence of multiple recurrent Clostridium difficile infection in the United States. Ann Intern Med 2017; 167: 152-158.
- Gerding DN, File TM, McDonald LC. Diagnosis and treatment of Clostridium difficile infection. Infect Dis Clin Pract 2016; 24: 3-10.
- Leffler DA, Lamont JT. Clostridium difficile infection. N Engl J Med 2015; 372: 1539-1548.
- Debast SB, Bauer MP, Kuijper EJ. European Society of Clinical Microbiology and Infectious Diseases update of the treatment guidance document of Clostridium difficile infection. Clin Microbiol Infect 2014; 20: 1-26.
- Louie TTJ, Miller MA, Mullane KMK, et al. Fidaxomicin versus vancomycin for Clostridium difficile infection. N Engl J Med 2011; 364: 422-431.
- Cornely OA, Crook DW, Esposito R, et al. OPT-80-004 Clinical Study Group. Fidaxomicin versus vancomycin for infection from Clostridium difficile in Europe, Canada, and the USA: A double-blind, non-inferiority, randomized controlled trial. Lancet Infect Dis 2012; 12: 281-289.
- Heimann SM, Vehreschild JJ, Cornely OA, et al. Economic burden of Clostridium difficile associated diarrhea: a cost-of-ilness study from German tertiary care hospital. Infection 2015; 43: 707-714.
- Lubbert C, Zimmermann L, Borchert J, et al. Epidemiology and recurrence rates of Clostridium difficile infections in Germany: a secondary data analysis. Infect Dis Ther 2016; 5: 545-555.
- Lessa FC, Winston LG, McDonald LC. Emerging infections Program C. difficile Surveillance Team Burden Clostridium difficile infection in the United States. N Engl J Med 2015; 372: 825-834.
- Hopkins RJ, Wilson RB. Treatment of reccurent Clostridium difficile colitis: a narrative review. Gastroenterol Rep 2018; 6: 21-28.
- Ramsay I, Brown NM, Enoch DA. Recent progress for the effective prevention and treatment of recurrent Clostridium difficile infection. Infect Dis Res Treatm 2018; 11: 1-4.
- Cole ShA, Stahl ThJ. Persistent and recurrent Clostridium difficile colitis. Clin Colon Rectal Surg 2015; 28: 65-69.
- O’Horo JC, Jindai K, Kunzer B, et al. Treatment of recurrent Clostridium difficile infection: a systematic review. Infection 2014; 42: 43-59.
- Anonymous. Bezlotoxumab (Zinplava) for prevention of recurrent Clostridium difficile infection. JAMA 2017; 318: 659-660.
- Stanford Antimicrobial Safety and Sustainability Program. SHC Clinical Pathway: Guidelines for the treatment of Clostridium difficile infection. 2017 Update