Εισαγωγή
Ο καρκίνος του προστάτη αποτελεί τη συχνότερα διαγιγνωσκόμενη κακοήθεια στον ανδρικό πληθυσμό, με περισσότερες από 1,4 εκατομμύρια νέες διαγνώσεις ετησίως, σε παγκόσμιο επίπεδο. Ο επιπολασμός της νόσου αυξάνεται με την πάροδο της ηλικίας (από 5% στους άνδρες < 30 ετών σε περίπου 60% στους άνδρες άνω των 79 ετών)1,2.
Η υποψία καρκίνου στον προστάτη βασίζεται αφ’ ενός στις τιμές του ειδικού προστατικού αντιγόνου (Prostate Specific Antigen, PSA) ορού και αφ’ ετέρου στη δακτυλική εξέταση. Το PSA δεν αποτελεί ειδική της πάθησης δοκιμασία και μπορεί να ανιχνεύεται αυξημένο και σε άλλες καταστάσεις ή παθήσεις. Στο 18% των περιπτώσεων η νόσος αναγνωρίζεται μόνο από μια ύποπτη δακτυλική εξέταση, ανεξάρτητα από τα επίπεδα του PSA3. Η διάγνωση της νόσου γίνεται με την ιστολογική επιβεβαίωση, μετά από διορθική βιοψία, η οποία συνήθως είναι υπερηχοτομογραφικά καθοδηγούμενη. O συνδυασμός μιας ύποπτης δακτυλικής εξέτασης με αυξημένα επίπεδα PSA διπλασιάζουν την πιθανότητα ανεύρεσης θετικής για κακοήθεια βιοψίας προστάτη4.
Η σταδιοποίηση του καρκίνου του προστάτη αποτελεί απαραίτητο εργαλείο για την ομαδοποίηση των ασθενών ανάλογα με τα μοναδικά χαρακτηριστικά της νόσου, με σκοπό τη βέλτιστη θεραπευτική αντιμετώπιση των ασθενών. Η σταδιοποίηση κατά ΤΝΜ που ευρύτατα χρησιμοποιείται σήμερα, είναι αυτή της Ευρωπαϊκής Ουρολογικής Εταιρείας (EAU) από το 20175:
- T (Tumour)- Βασίζεται μόνο στη δακτυλική εξέταση
- Tx: O πρωτοπαθής όγκος δεν δύναται να εκτιμηθεί
- Τ0: Καμία ένδειξη πρωτοπαθούς όγκου
- Τ1: Όγκος μη ψηλαφητός-μη αναγνωριζόμενος κλινικά
- T1a: Τυχαίο ιστολογικό εύρημα σε ποσοστό <5% του παρασκευάσματος διουρηθρικής προστατεκτομής
- Τ1b: Τυχαίο ιστολογικό εύρημα σε ποσοστό >5% του παρασκευάσματος διουρηθρικής προστατεκτομής
- Τ1c: Όγκος που διαγνώσθηκε σε βιοψία, η οποία πραγματοποιήθηκε λόγω αυξημένης τιμής PSA
- T2: Όγκος ψηλαφητός και περιορισμένος εντός του προστατικού παρεγχύματος
- Τ2a: Όγκος εντοπιζόμενος στο ήμισυ ή λιγότερο ενός προστατικού λοβού
- Τ2b: Όγκος εντοπιζόμενος σε πάνω από το ήμισυ ενός προστατικού λοβού
- Τ2c: Ο όγκος εντοπίζεται και στους δυο λοβούς
- Τ3: Όγκος που επεκτείνεται πέρα από την προστατική κάψα
- Τ3a: ετερόπλευρη ή αμφοτερόπλευρη εξωκαψική επέκταση
- Τ3b: Ο όγκος διηθεί τις σπερματοδόχες κύστεις
- Τ4: Όγκος που επεκτείνεται σε γειτονικά όργανα εκτός των σπερματοδόχων κύστεων: έξω σφιγκτήρα, ορθό, ανελκτήρα του πρωκτού ή/και πυελικό τοίχωμα
- Ν (Nodes) – Επιχώριοι (πυελικοί) Λεμφαδένες
- Νx: Οι πυελικοί λεμφαδένες δε δύνανται να εκτιμηθούν
- Ν0 : Χωρίς μεταστάσεις στους πυελικούς λεμφαδένες
- Ν1: Μεταστάσεις στους πυελικούς λεμφαδένες
- Μ (Metastasis) – Απομακρυσμένες Μεταστάσεις
- Μ0: Χωρίς απομακρυσμένες μεταστάσεις
- Μ1: Aπομακρυσμένες μεταστάσεις, a) σε λεμφαδένες πέραν των πυελικών, b) στα οστά, c) σε άλλες εστίες
Παράλληλα, ο καρκίνος του προστάτη σταδιοποιείται βάσει των ιστολογικών του χαρακτηριστικών, με το Gleason score, που αποτελεί μια πενταβάθμια κλίμακα1-5 του αρχιτεκτονικού προτύπου του όγκου, με το 5 να ορίζει το δυσμενέστερο πρότυπο6,7. Κατά συνέπεια, συνδυάζοντας το στάδιο ΤΝΜ, το Gleason score και το PSA, δημιουργούνται επιπλέον τρεις ομαδοποιήσεις: χαμηλού κινδύνου, μετρίου, και υψηλού κινδύνου εντοπισμένος καρκίνος του προστάτη όσον αφορά τον κίνδυνο για υποτροπή μετά τη θεραπευτική προσέγγιση8.
Θεραπευτική Αντιμετώπιση
Το προσδόκιμο επιβίωσης ενός ασθενούς και η κλινική του κατάσταση αποτελούν βασικούς παράγοντες στη λήψη θεραπευτικών αποφάσεων για τη νόσο, καθώς αυτή εμφανίζεται κατά κύριο λόγο σε ηλικιωμένους άνδρες με συννοσηρότητες. Σε ασθενείς με εντοπισμένη νόσο, προσδόκιμο επιβίωσης άνω των 10 ετών θεωρείται όριο για την ύπαρξη οφέλους για οποιαδήποτε θεραπευτική παρέμβαση9.
Active Surveillance/Watchfull Waiting
Η ενεργός παρακολούθηση (Active Surveillance, AS) έχει ως στόχο την αποφυγή μιας “άσκοπης” θεραπευτικής παρέμβασης σε ασθενείς με εντοπισμένο καρκίνο. Ο προσυμπτωματικός έλεγχος (screening) για τον καρκίνο του προστάτη, που βασίζεται στον περιοδικό έλεγχο των τιμών PSA ορού, έχει οδηγήσει στη μείωση τόσο της συχνότητας διάγνωσης καρκίνου προχωρημένου σταδίου, όσο και της ειδικής για τη νόσο θνητότητας10. Παρά ταύτα, η ανεύρεση υψηλών τιμών PSA οδηγεί, στις περισσότερες περιπτώσεις, στην πραγματοποίηση διορθικής βιοψίας και στην ανεύρεση καρκίνου, ο οποίος ενδέχεται να είναι κλινικά μη σημαντικός και να μην είχε διαγνωσθεί αν δεν είχε ακολουθηθεί αυτή η διαδικασία. Αυτή η υπερδιάγνωση (overdiagnosis), συνηθέστατα ακολουθείται από υπερθεραπεία (overtreatment) που περιλαμβάνει την εφαρμογή θεραπευτικών παρεμβάσεων στους ασθενείς με κλινικά μη σημαντική νόσο, οι οποίοι πιθανόν δεν θα εμφάνιζαν κανένα σύμπτωμα από τη νόσο στη διάρκεια της ζωής τους, μπορεί όμως να παρουσιάσουν επιπλοκές από την ακολουθούμενη θεραπευτική παρέμβαση11.
Οι ασθενείς υπό AS, παρακολουθούνται συστηματικά με έλεγχο των τιμών PSA, κλινική εξέταση, απεικονιστικές εξετάσεις και περιοδικές βιοψίες προστάτη, ώστε εάν παρατηρηθούν ενδείξεις εξέλιξης της νόσου, να υποβληθούν σε ριζική θεραπεία12. Δεν υπάρχει διεθνής ομοφωνία για την εφαρμογή της AS. Σύμφωνα με μια συστηματική ανασκόπηση του 2021, εφαρμόζονται 375 διαφορετικά πρωτόκολλα AS, που έχουν ως στόχο τον περιορισμό της υπερθεραπείας και των επιπλοκών της από το ουροποιητικό και το γαστρεντερικό και την επίπτωσή της στη στυτική λειτουργία13. Σύμφωνα με το πρωτόκολλο PRIAS (Prostate Cancer Research International: Active Surveillance), εντάσσονται σε AS ασθενείς με Gleason score 6, PSA<10ng/ml και νόσο σε έως δύο τεμαχίδια βιοψίας. Παράλληλα, προτείνεται έλεγχος PSA κάθε 3 μήνες, δακτυλική εξέταση κάθε 6 μήνες κατά τα πρώτα 2 έτη, και επανάληψη της βιοψίας σε 1,4,7,10 έτη μετά την αρχική14. Η ενεργός παρακολούθηση αποτελεί αποδεκτή μέθοδο αντιμετώπισης του καρκίνου του προστάτη χαμηλού κινδύνου, αφού σχετίζεται με ικανοποιητική ειδική για τη νόσο επιβίωση (CSS) και συνολική επιβίωση (OS), παρά ταύτα, περισσότερο από το 1/3 των ασθενών τελικά θα υποβληθούν σε ριζική θεραπεία15.
Η επαγρύπνηση (Watchfull Waiting, WW) αποτελεί διαφορετικό πλάνο συντηρητικής διαχείρισης της νόσου και μπορεί να εφαρμοσθεί σε ασθενείς με ασυμπτωματικό καρκίνο και προσδόκιμο επιβίωσης <10 ετών, οι οποίοι δεν είναι υποψήφιοι για ριζική θεραπευτική παρέμβαση, λόγω συνυπαρχόντων προβλημάτων υγείας. Οι ασθενείς αυτοί παρακολουθούνται για την τυχόν εξέλιξη-επέκταση της νόσου και αντιμετωπίζονται ανάλογα με τα συμπτώματα τους, με σκοπό τη βελτίωση της ποιότητας ζωής16. Η εφαρμογή WW βασίζεται σε παλαιότερα βιβλιογραφικά δεδομένα, και κυρίως τη μελέτη SPCG-4, σύμφωνα με την οποία υπάρχει, μακροχρονίως, σαφές συγκριτικό πλεονέκτημα της ριζικής προστατεκτομής έναντι της WW, που όμως καθίσταται εμφανές μόνο μετά την πάροδο 10 ετών17.
Ριζική Προστατεκτομή
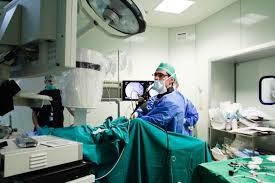
Ο στόχος της ριζικής προστατεκτομής είναι η εξάλειψη της νόσου και η όσο το δυνατόν διατήρηση της λειτουργικότητας των οργάνων της πυέλου18. Η επέμβαση περιλαμβάνει την εκτομή του προστάτη (μαζί με την κάψα του) και των σπερματοδόχων κύστεων και, τελικά, την κυστεο-ουρηθρική αναστόμωση. Η ριζική προστατεκτομή μπορεί να πραγματοποιηθεί είτε με την ανοικτή προσπέλαση (οπισθοηβική ή διαπερινεϊκή) είτε με την λαπαροσκοπική (LRP) ή την ρομποτικά υποβοηθούμενη τεχνική (RARP). Η επέμβαση συνδυάζεται, πολλές φορές, με πυελική λεμφαδενεκτομή, η οποία προσφέρει πολύτιμες πληροφορίες για το στάδιο και την πρόγνωση της νόσου και πραγματοποιείται με βάση τα προεγχειρητικά χαρακτηριστικά της νόσου που συνοψίζονται σε νομογράμματα ειδικά για τη λεμφαδενεκτομή, όπως αυτό του Briganti19. Κυριότερες επιπλοκές της επέμβασης αποτελούν η ακράτεια των ούρων και η στυτική δυσλειτουργία. Η διαθέσιμη βιβλιογραφία δεν αναδεικνύει πλεονέκτημα κάποιας από τις προαναφερθείσες μεθόδους, όσον αφορά τα ογκολογικά και λειτουργικά αποτελέσματα, με τη λαπαροσκοπική και τη ρομποτική μέθοδο να σχετίζονται με μικρότερη διάρκεια νοσηλείας και μικρότερη απώλεια αίματος20. Πρόσφατη ανασκόπηση της Cochrane, στην οποία συγκρίθηκαν οι 3 προαναφερθείσες τεχνικές ριζικής προστατεκτομής, επίσης κατέληξε στα ίδια συμπεράσματα21. Επομένως, σύμφωνα και με τις κατευθυντήριες οδηγίες της Ευρωπαϊκής Ουρολογικής Εταιρείας (EAU), δεν είναι δυνατόν να συστηθεί κάποια μέθοδος ως αναμφισβήτητα πλεονεκτική έναντι των άλλων. Για τη βελτίωση των λειτουργικών αποτελεσμάτων μετεγχειρητικά έχουν περιγραφεί διάφορες χειρουργικές τεχνικές, όπως η διατήρηση των αγγειονευρωδών δεματίων (nerve-sparing technique), με την οποία μπορεί να επιτευχθεί η διατήρηση της στυτικής λειτουργίας. Άλλες τεχνικές, όπως η διατήρηση του κυστικού αυχένα ή/και η αναστροφή του βλεννογόνου του, καθώς και η διατήρηση επαρκούς μήκους της ουρήθρας έχουν επίσης περιγραφεί με σκοπό τη διατήρηση της μετεγχειρητικής εγκράτειας των ούρων, με αντικρουόμενα, παρά ταύτα, αποτελέσματα.
Ακτινοθεραπεία
Η μέθοδος αποτελεί ριζική θεραπευτική προσέγγιση για τον καρκίνο του προστάτη. Οι εξελίξεις στις ακτινοθεραπευτικές τεχνικές έχουν οδηγήσει σε μεγιστοποίηση της δόσης που φέρεται στο όργανο-στόχο, με σκοπό τον έλεγχο της νόσου, με ταυτόχρονη αποφυγή ακτινοβόλησης των παρακείμενων υγιών ιστών. Σήμερα, είναι ευρέως αποδεκτό ότι οι τεχνικές ΙMRT (Intensity Modulated Radiotherapy) και VMAT (Volumetric aArt Radiation Therapy) με ΙGRT (Image Guided Radiotherapy) αποτελούν τις καλύτερες μεθόδους εξωτερικής ακτινοβόλησης του προστάτη22,23. Αναφερόμενο πλεονέκτημα της VMAT έναντι της IMRT είναι ο συντομότερος χρόνος θεραπείας, συνήθως κατά 2-3 λεπτά ανά συνεδρία. Γενικά, και οι δύο μέθοδοι επιτρέπουν μία πλέον σύνθετη κατανομή της φερόμενης δόσης, με την οποία επιτυγχάνεται μεγαλύτερη προστασία του ορθού. Η τελευταία μπορεί επίσης να επιτευχθεί και με τη χρήση βιοδιασπώμενων υλικών, συνήθως γέλης ή μπαλονιού, ώστε να αυξηθεί η απόσταση μεταξύ προστάτη-ορθού και, άρα, να μειωθεί η φερόμενη στο ορθό ακτινοβολία24.
Η εξωτερική ακτινοβολία για τον καρκίνο του προστάτη συνδυάζεται με ολικό ανδρογονικό αποκλεισμό (Androgen Deprivation Therapy, ADT), αφού μελέτες έχουν καταδείξει υπεροχή του συνδυασμού έναντι της ακτινοβολίας ως μονοθεραπείας25,26,27. Προτεινόμενη διάρκεια του θεραπευτικού συνδυασμού είναι για μεν τους καρκίνους ενδιαμέσου κινδύνου οι 6 μήνες, για δε εκείνους υψηλού κινδύνου τα 3 έτη.
Παρενέργειες της εξωτερικής ακτινοβολίας είναι κυρίως η κόπωση, η μετακτινική κυστίτιδα, η πρωκτίτιδα, η ακράτεια ούρων και η στυτική δυσλειτουργία28.
Βραχυθεραπεία
Η μέθοδος αυτή χρησιμοποιεί ραδιενεργούς σπόρους οι οποίοι εμφυτεύονται στον προστάτη. Διακρίνεται σε βραχυθεραπεία χαμηλής (low-dose) και υψηλής δόσης (high-dose), με την πρώτη να περιλαμβάνει μόνιμη και τη δεύτερη προσωρινή εμφύτευση των ραδιενεργών υλικών, μέσω βελονών ή καθετήρων29,30. Στη βραχυθεραπεία χαμηλής δόσης συνήθως εμφυτεύονται ισότοπα Ι-125 αλλά και Pd-103 και Cesium-131, ενώ σε εκείνη υψηλής δόσης Iridium-192. Σημαντική διαφορά μεταξύ των 2 τεχνικών είναι η διάρκεια απόδοσης της ακτινοβολίας (εβδομάδες ή/και μήνες στην χαμηλής δόσης έναντι λεπτών στην υψηλής δόσης βραχυθεραπεία) και κατ’ επέκταση η ανάγκη προστασίας των γύρω ιστών (μηδενική στη βραχυθεραπεία υψηλής δόσης). Η βραχυθεραπεία μπορεί να συνδυασθεί με ακτινοθεραπεία, ενώ δεν υπάρχουν δεδομένα που να συγκρίνουν τη μέθοδο αυτή με τη ριζική προστατεκτομή. Η βραχυθεραπεία προσφέρεται σε ασθενείς με χαμηλού και ενδιάμεσου κινδύνου καρκίνο του προστάτη, με περιορισμένα δεδομένα για την αποτελεσματικότητα της, μέχρι σήμερα30. Οι παρενέργειες από τη χρήση της βραχυθεραπείας αφορούν το γαστρεντερικό και ουροποιητικό σύστημα και είναι παρόμοιες με αυτές της ακτινοβολίας.
Με βάση τα σημερινά δεδομένα, όπως συνοψίζονται στις κατευθυντήριες οδηγίες της EAU, όλες οι προαναφερθείσες μέθοδοι είναι αποδεκτές και επιφέρουν, σε βάθος 12 ετών παρακολούθησης, παρόμοια ειδική της νόσου επιβίωση (CSS) και συνολική επιβίωση (OS) στον εντοπισμένο καρκίνο του προστάτη χαμηλού και ενδιαμέσου κινδύνου31.
Ορμονική Θεραπεία
Η καταστολή των κυκλοφορούντων ανδρογόνων (ανδρογονικός αποκλεισμός) μπορεί να επιτευχθεί με διάφορους τρόπους:
– Αμφοτερόπλευρη ορχεκτομή, με την οποία επιτυγχάνονται επίπεδα ευνουχισμού εντός 12 ωρών. Ως επίπεδα ευνουχισμού παραδοσιακά θεωρούνται οι τιμές τεστοστερόνης ορού <50ng/dl22, που και σήμερα χρησιμοποιούνται στις μελέτες, παρά ταύτα τιμές της ορμόνης <20ng/dl, αντιπροσωπεύουν καλύτερα την πραγματικότητα32.
– Οιστρογόνα, όπως η διαιθυλοστιλβεστρόλη, που επίσης οδηγούν σε καταστολή της τεστοστερόνης. Παρόλα αυτά, επειδή είναι δυνατόν να προκαλέσουν σοβαρές επιπλοκές όπως θρομβεμβολικά επεισόδια, δεν αποτελούν κύρια θεραπευτική επιλογή33.
– LHRH αγωνιστές (LHRH ανάλογα). Είναι συνθετικά ανάλογα της LHRH και χορηγούνται ως depot ενέσεις, συνήθως ανά 3μηνο. Αποτελούν την κύρια μορφή ανδρογονικού αποκλεισμού. Η αρχική χορήγησή τους έχει ως αποτέλεσμα την παροδική αύξηση των επιπέδων των ορμονών LH & FSH, γεγονός που οδηγεί στο λεγόμενο «testosterone surge» ή «flare-up» φαινόμενο, το οποίο διαρκεί 1 εβδομάδα περίπου και το οποίο μπορεί να οδηγήσει σε σοβαρές επιπλοκές, όπως συμπίεση του νωτιαίου μυελού, αύξηση του οστικού πόνου, αποφρακτική ουροπάθεια κ.α. Η συγχορήγηση με αντιανδρογόνα μειώνει, αλλά δεν εξαλείφει πλήρως τον κίνδυνο εμφάνισης του φαινομένου34. Η χρόνια χορήγηση των LHRH αναλόγων οδηγεί σε υπορρύθμιση (down-regulation) των υποδοχέων LHRH με συνέπεια την καταστολή της παραγωγής τεστοστερόνης και την επίτευξη ευνουχισμού σε 2-4 εβδομάδες. Οι σήμερα χρησιμοποιούμενοι LHRH αγωνιστές (goserelin, leuprolide, buserelin) θεωρούνται παρόμοιας αποτελεσματικότητας, παρότι δεν υπάρχουν μελέτες άμεσης σύγκρισής τους.
– LHRH ανταγωνιστές. Είναι ουσίες που συνδέονται με συναγωνιστικό ανταγωνισμό με τους LHRH υποδοχείς, καταστέλλοντας έτσι άμεσα την παραγωγή FSH & LH και τελικά της τεστοστερόνης δίχως το φαινόμενο flare-up. Τα επίπεδα ευνουχισμού εμφανίζονται σε 3 ημέρες. Ο συχνότερα χρησιμοποιούμενος LHRH ανταγωνιστής είναι το degarelix, το οποίο βρέθηκε εξίσου αποτελεσματικό με την λευπρολίδη στην καταστολή της τεστοστερόνης σε επίπεδα ευνουχισμού, σε μελέτη φάσεως ΙΙΙ35. Πρόσφατα, ένας νέος LHRH ανταγωνιστής, το relugolix, που χορηγείται από το στόμα, έλαβε έγκριση από τους οργανισμούς FDA και EMA, με βάση τα αποτελέσματα της μελέτης φάσεως ΙΙΙ HERO36. Επί του παρόντος, δεν υπάρχουν μακροχρόνια (πέραν των 12 μηνών) δεδομένα που να τεκμηριώνουν την υπεροχή των LHRH ανταγωνιστών έναντι των LHRH αγωνιστών, όσον αφορά τα καρδιαγγειακά συμβάματα, τη libido, τη στυτική δυσλειτουργία κ.λπ.)37.
– Αντιανδρογόνα. Διακρίνονται σε στεροειδή (οξική κυπροτερόνη, οξική μεγεστρόλη, οξική μεδροξυπρογεστερόνη) και μη στεροειδή αντιανδρογόνα (φλουταμίδη, νιλουταμίδη, μπικαλουταμίδη). Οι παράγοντες αυτοί ανταγωνίζονται τα ανδρογόνα στο επίπεδο του ανδρογονικού υποδοχέα (AR), με τον οποίο συνδέονται άμεσα, αναστέλλοντας την εξαρτώμενη από τον υποδοχέα μετάδοση σημάτων (AR-mediated signalling) και τα επακόλουθα γεγονότα. Στην πράξη, οι πρώτης γενεάς μη στεροειδείς παράγοντες δεν αναστέλλουν πλήρως τη δραστηριότητα του AR, μάλιστα έχουν και ιδιότητες αγωνιστή σε καρκινικά κύτταρα που τον υπερεκφράζουν. Αντίθετα, τα νεώτερης γενεάς αντιανδρογόνα (ARTA), όπως η ενζαλουταμίδη, η απαλουταμίδη και η νταρολουταμίδη διατηρούν την ικανότητα του ανταγωνισμού του AR σε συνθήκες υπερέκφρασής του38. Μελέτες φάσεως ΙΙΙ έδειξαν ότι τα νεώτερης γενεάς αντιανδρογόνα είναι αποτελεσματικά σε διάφορες μορφές προχωρημένου καρκίνου του προστάτη, για τις οποίες και έχουν λάβει έγκριση από το FDA: η ενζαλουταμίδη και η απαλουταμίδη για χρήση τόσο στον μη μεταστατικό ανθεκτικό στον ευνουχισμό (nmCRPC), όσο και στον μεταστατικό ευαίσθητο στον ευνουχισμό καρκίνο του προστάτη (mCSPC), η δε νταρολουταμίδη στον nmCRPC. Παράλληλα, στη θεραπεία του καρκίνου του προστάτη έχει εισαχθεί και η αμπιρατερόνη, η οποία είναι αναστολέας του CYP17A, ενός ενζύμου ιδιαίτερα σημαντικού για τη σύνθεση των ανδρογόνων. Η χορήγηση αμπιρατερόνης οδηγεί σε αναστολή της σύνθεσης ανδρογόνων από τις γονάδες, τα επινεφρίδια και τα καρκινικά προστατικά κύτταρα, αλλά και σε αναστολή της σύνθεσης γλυκοκορτικοειδών, που καταλήγει σε έλλειμμά τους αλλά και σε περίσσεια αλατοκορτικοειδών. Για το λόγο αυτό και για την αποφυγή πρόκλησης υπεραλδοστερονισμού, το φάρμακο συγχορηγείται με πρεδνιζόνη39. Η αμπιρατερόνη έχει λάβει έγκριση από το FDA και τον EMA για χορήγηση τόσο στον μεταστατικό ορμονοευαίσθητο (mCSPC) όσο και στον μεταστατικό ανθεκτικό στον ευνουχισμό καρκίνο του προστάτη (mCRPC). Οι συχνότερες ανεπιθύμητες ενέργειες της χορήγησης αμπιρατερόνης, που είναι αποτέλεσμα της μειωμένης σύνθεσης κορτικοστεροειδών και της επακόλουθης αύξησης της ACTH, περιλαμβάνουν την κατακράτηση υγρών, την υπέρταση και την υποκαλιαιμία).
Νέοι Θεραπευτικοί Παράγοντες
- PARP αναστολείς. Οι παράγοντες αυτοί αναστέλλουν το ένζυμο PARP (Poly Adenosine Diphosphate Ribose Polymerase) και στοχεύουν εναντίων καρκινικών κυττάρων με μεταλλάξεις των γονιδίων BRCA (Breast Cancer Susceptibility Genes) 1 και 2, τα οποία είναι ογκοκατασταλτικά γονίδια που φυσιολογικά συμβάλλουν στην αποκατάσταση των βλαβών του DNA, μέσω ενεργοποίησης της επιδιόρθωσης των λεγόμενων double strand breaks (DSBs) και έναρξης του ομόλογου ανασυνδυασμού (homologous recombination, HR). Οι γενετικές μεταλλάξεις των γονιδίων BRCA έχει δειχθεί ότι προδιαθέτουν στην ανάπτυξη επιθετικού καρκίνου και μειωμένη επιβίωση. Η χορήγηση του PARP αναστολέα olaparib στους ασθενείς με εξελισσόμενο καρκίνο του προστάτη υπό αμπιρατερόνη ή ενζαλουταμίδη, οι οποίοι ταυτόχρονα είχαν μεταλλάξεις των γονιδίων BRCA, οδήγησε σε σημαντική παράταση της ελεύθερης προόδου της νόσου επιβίωσης (PFS) (PROfound trial). Η olaparib αλλά και ο νεότερος αναστολέας rucaparib έχουν εγκριθεί από το FDA (2020) για χρήση στη θεραπεία του μεταστατικού καρκίνου προστάτη40, 41.
- Αναστολείς της Ανοσίας Σημείου (Immune Checkpoint Inhibitors). Αυτοί οι φαρμακευτικοί παράγοντες αναστέλλουν τα μόρια CTLA4, PD-1 (Programmed Cell Death Protein 1), PD-L1 (Programmed Death-Ligand 1) που αποτελούν ρυθμιστές της ισορροπίας του ανοσοποιητικού συστήματος και χρησιμοποιούνται με ένδειξη τον μεταστατικό καρκίνο προστάτη. Οι ευρύτερα χρησιμοποιούμενοι από τους παράγοντες αυτούς είναι οι pembrolizumab και nivolumab (PD-1 inhibitors), atezolizumab και avelumab (PD-L1 inhibitors) και ipilimumab (CTL4 inhibitor)42.
- Ραδιοϊσότοπα. H ραδιοφαρμακευτική θεραπεία χρησιμοποιείται με σκοπό την καταστροφή των καρκινικών κυττάρων, μέσω της εκπομπής ραδιενέργειας προερχόμενης από ραδιονουκλεοτίδια όπως το 223Ra και το 177Lu. Απαραίτητη προϋπόθεση για τη χρήση ραδιοϊσοτόπων είναι η στοχοθέτηση του όγκου μέσω της χρήσης απεικόνισης με τεχνικές PET. Ένδειξη χρήσης των παραγόντων αυτών αποτελεί ο μεταστατικός καρκίνος του προστάτη43.
Τέλος, εκτός από τις καθιερωμένες ριζικές πρακτικές που προαναφέρθηκαν, υπάρχουν και άλλες τοπικές θεραπευτικές επιλογές για τον εντοπισμένο καρκίνο του προστάτη, όπως η κρυοθεραπεία, το HIFU (Intensity Focused Ultrasound), η τοπική φωτοδυναμική θεραπεία και η εφαρμογή ραδιοσυχνοτήτων (radiofrequency ablation). Με βάση τα μέχρι σήμερα διαθέσιμα συγκριτικά δεδομένα, οι θεραπείες αυτές πρέπει να εφαρμόζονται μόνο στα πλαίσια κλινικών μελετών44.
Χημειοθεραπεία στον Καρκίνο του Προστάτη
Σε ασθενείς με μεταστατικό καρκίνο, η χημειοθεραπεία αποτελεί θεραπευτική επιλογή πρώτης γραμμής. Οι παράγοντες που χρησιμοποιούνται είναι οι ταξάνες (δοσεταξέλη, καμπαζιταξέλη). Ο μηχανισμός δράσης τους, παρότι όχι πλήρως αποσαφηνισμένος, σχετίζεται με τη διαταραχή της έκφρασης γονιδίων που είναι υπεύθυνα για τη σηματοδότηση των ανδρογόνων45. Αρκετές μελέτες έχουν επιβεβαιώσει το όφελος επιβίωσης των ασθενών από τη χρήση δοσεταξέλης στον προχωρημένο καρκίνο του προστάτη, όπως η STAMPEDE, η CHAARTED και η GETUG-AFU-1546,47,48. H δοσεταξέλη χορηγείται σε συνδυασμό με πρεδνιζόνη, σε έως και 10 κύκλους 3 εβδομαδιαίων δόσεων, πολλές δε παράμετροι πριν τη θεραπεία (performance status, PSA, αλκαλική φωσφατάση, αριθμός μεταστάσεων, ύπαρξη ηπατικών μεταστάσεων κ.α) έχει αποδειχθεί ότι καθορίζουν την επιβίωση μετά από αυτήν49. Η καμπαζιταξέλη έχει δραστικότητα σε όγκους ανθεκτικούς μετά τη χορήγηση δοσεταξέλης, μη εμφανίζοντας υπεροχή έναντι εκείνης σε επίπεδο θεραπείας πρώτης γραμμής50. Η χρήση της εδραιώθηκε βάσει των αποτελεσμάτων της μελέτης φάσεως ΙΙΙ TROPIC στους ασθενείς με πρόοδο της νόσου, κατά τη διάρκεια ή μετά τη διάρκεια χημειοθεραπείας με δοσεταξέλη51. Η καμπαζιταξέλη χορηγείται σε σχήματα έως 10 κύκλων, σε συνδυασμό με πρεδνιζόνη και οι σοβαρότερες ανεπιθύμητες ενέργειες από τη χορήγηση της είναι η ουδετεροπενία και η σήψη52.
Sipuleucel-T
To sipuleucel-T αποτελεί ενέσιμη μορφή ανοσοθεραπείας, αποτελώντας πρώτης γραμμής θεραπεία στον μεταστατικό καρκίνο του προστάτη. Είναι ένα αυτόλογο, κυτταρικό, ανοσολογικό προϊόν που ενεργοποιεί την Τ- κυτταρική ανοσία έναντι της όξινης προστατικής φωσφατάσης που εκφράζεται στα καρκινικά κύτταρα, μέσω αντιγονο-παρουσιαστικών κυττάρων53. Η μελέτη IMPACT (φάσης ΙΙΙ) κατέδειξε τη θεραπευτική του αξία σε ασθενείς με μεταστατικό καρκίνο προστάτη54, όμως πρέπει να τονιστεί ότι αυτή η θεραπευτική επιλογή δεν είναι διαθέσιμη προς χρήση, στην Ευρωπαϊκή ήπειρο.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Haas GP, Delongchamps N, Brawley OW, et al. The worldwide epidemiology of prostate cancer: perspectives from autopsy studies. Can J Urol 2008; 15: 3866-3871.
- Bell KJ, Del Mar C, Wright G, et al. Prevalence of incidental prostate cancer: A systematic review of autopsy studies. Int J Cancer 2015; 137: 1749-1757.
- Richie JP, Catalona WJ, Ahmann FR, et al. Effect of patient age on early detection of prostate cancer with serum prostate-specific antigen and digital rectal examination. Urology 1993; 42: 365-374.
- Gosselaar C, Roobol MJ, Roemeling S, et al. The role of the digital rectal examination in subsequent screening visits in the European randomized study of screening for prostate cancer (ERSPC), Rotterdam. Eur Urol 2008;54(3):581-8.
- Bertero L, Massa F, Metovic J, et al. Eighth Edition of the UICC Classification of Malignant Tumours: an overview of the changes in the pathological TNM classification criteria-What has changed and why? Virchows Arch 2018; 472: 519-531.
- Epstein JI, Allsbrook WC Jr, Amin MB, et al. ISUP Grading Committee. The 2005 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma. Am J Surg Pathol 2005; 29: 1228-1242.
- Epstein JI, Egevad L, Amin MB, et al. Grading Committee. The 2014 International Society of Urological Pathology (ISUP) Consensus Conference on Gleason Grading of Prostatic Carcinoma: Definition of Grading Patterns and Proposal for a New Grading System. Am J Surg Pathol 2016; 40: 244-252.
- Preisser F, Cooperberg MR, Crook J, et al. Intermediate-risk Prostate Cancer: Stratification and Management. Eur Urol Oncol 2020; 3: 270-280.
- Adolfsson J, Tribukait B, Levitt S. The 20-Yr outcome in patients with well- or moderately differentiated clinically localized prostate cancer diagnosed in the pre-PSA era: the prognostic value of tumour ploidy and comorbidity. Eur Urol 2007; 52: 1028-1035.
- Boniol M, Boyle P, Autier P, et al. Critical role of prostate biopsy mortality in the number of years of life gained and lost within a prostate cancer screening program. BJU Int2012; 110: 1648–1652.
- Loeb S, Bjurlin MA, Nicholson J, et al. Overdiagnosis and overtreatment of prostate cancer. Eur Urol 2014; 65: 1046-1055.
- Bruinsma SM, Roobol MJ, Carroll PR, et al. Movember Foundation’s Global Action Plan Prostate Cancer Active Surveillance (GAP3) consortium. Expert consensus document: Semantics in active surveillance for men with localized prostate cancer – results of a modified Delphi consensus procedure. Nat Rev Urol 2017; 14: 312-322.
- Peter-Paul M, Willemse, Niall F, et al. Systematic Review of Active Surveillance for Clinically Localised Prostate Cancer to Develop Recommendations Regarding Inclusion of Intermediate-risk Disease, Biopsy Characteristics at Inclusion and Monitoring, and Surveillance Repeat Biopsy Strategy. Eur Urol 2022; 81: 337-346.
- Bul M, Zhu X, Valdagni R, et al. Active surveillance for low-risk prostate cancer worldwide: the PRIAS study. Eur Urol 2013; 63: 597-603.
- Tosoian JJ, Mamawala M, Epstein JI, et al. Intermediate and Longer-Term Outcomes From a Prospective Active-Surveillance Program for Favorable-Risk Prostate Cancer. J Clin Oncol 2015; 33: 3379-3385.
- Albertsen PC. Observational studies and the natural history of screen-detected prostate cancer. Curr Opin Urol 2015; 25: 32-37.
- Bill-Axelson A, Holmberg L, Garmo H, et al. Radical Prostatectomy or Watchful Waiting in Prostate Cancer – 29-Year Follow-up. N Engl J Med 2018; 379: 2319-2329.
- Gandaglia G, Ploussard G, Valerio M, et al. A Novel Nomogram to Identify Candidates for Extended Pelvic Lymph Node Dissection Among Patients with Clinically Localized Prostate Cancer Diagnosed with Magnetic Resonance Imaging-targeted and Systematic Biopsies. Eur Urol 2019; 75: 506-514.
- Allan, C., Ilic D. Laparoscopic versus Robotic-Assisted Radical Prostatectomy for the Treatment of Localised Prostate Cancer: A Systematic Review. Urol Int 2016; 96: 373-378.
- Coughlin GD, Yaxley JW, Chambers SK, et al. Robot-assisted laparoscopic prostatectomy versus open radical retropubic prostatectomy: 24-month outcomes from a randomised controlled study. Lancet Oncol 2018; 19: 1051-1060.
- Ilic D, Evans SM, Allan CA, et al. Laparoscopic and robotic-assisted versus open radical prostatectomy for the treatment of localised prostate cancer. Cochrane Database Syst Rev 2017; 9: CD009625.
- Wortel RC, Incrocci L, Pos FJ, et al. Late Side Effects After Image Guided Intensity Modulated Radiation Therapy Compared to 3D-Conformal Radiation Therapy for Prostate Cancer: Results From 2 Prospective Cohorts. Int J Radiat Oncol Biol Phys 2016; 95: 680-689.
- Zapatero A, Roch M, Büchser D, et al. Reduced late urinary toxicity with high-dose intensity-modulated radiotherapy using intra-prostate fiducial markers for localized prostate cancer. Clin Transl Oncol 2017; 9: 1161-1167.
- Miller LE, Efstathiou JA, Bhattacharyya SK, et al. Association of the Placement of a Perirectal Hydrogel Spacer With the Clinical Outcomes of Men Receiving Radiotherapy for Prostate Cancer: A Systematic Review and Meta-analysis. JAMA Netw Open 2020; 3: e208221.
- Bolla M, Van Tienhoven G, Warde P, et al. External irradiation with or without long-term androgen suppression for prostate cancer with high metastatic risk: 10-year results of an EORTC randomised study. Lancet Oncol 2010;11(11):1066-73.
- Pilepich MV, Winter K, Lawton CA, et al. Androgen suppression adjuvant to definitive radiotherapy in prostate carcinoma–long-term results of phase III RTOG 85-31. Int J Radiat Oncol Biol Phys 2005; 61: 1285-1290.
- D’Amico AV, Chen MH, Renshaw AA, et al. Androgen suppression and radiation vs radiation alone for prostate cancer: a randomized trial. JAMA 2008; 299: 289-295.
- de Crevoisier R, Bayar MA, Pommier P, et al. Daily Versus Weekly Prostate Cancer Image Guided Radiation Therapy: Phase 3 Multicenter Randomized Trial. Int J Radiat Oncol Biol Phys 2018; 102: 1420-1429.
- Viani GA, Arruda CV, Assis Pellizzon AC, et al. HDR brachytherapy as monotherapy for prostate cancer: A systematic review with meta-analysis. Brachytherapy 2021; 20: 307-314.
- Morton G, McGuffin M, Chung HT, et al. Prostate high dose-rate brachytherapy as monotherapy for low and intermediate risk prostate cancer: Efficacy results from a randomized phase II clinical trial of one fraction of 19 Gy or two fractions of 13.5 Gy. Radiother Oncol 2020; 146: 90-96.
- EAU Prostate Cancer Guidelines. Edn. presented at the EAU Annual Congress Amsterdam 2022. ISBN 978-94-92671-16-5.
- Oefelein, M.G., et al. Reassessment of the definition of castrate levels of testosterone: implications for clinical decision making. Urology 2000; 56: 1021-1024.
- Klotz L, McNeill I, Fleshner N. A phase 1-2 trial of diethylstilbestrol plus low dose warfarin in advanced prostate carcinoma. J Urol 1999 ;161: 169-172.
- Collette L, Studer UE, Schröder FH, et al. Why phase III trials of maximal androgen blockade versus castration in M1 prostate cancer rarely show statistically significant differences. Prostate 2001; 48: 29-39.
- Klotz L, Boccon-Gibod L, Shore ND, et al. The efficacy and safety of degarelix: a 12-month, comparative, randomized, open-label, parallel-group phase III study in patients with prostate cancer. BJU Int 2008; 102: 1531-1538.
- Shore ND, Saad F, Cookson MS, et al. Oral Relugolix for Androgen-Deprivation Therapy in Advanced Prostate Cancer. N Engl J Med 2020; 382: 2187-2196.
- Cirne F, Aghel N, Petropoulos JA, et al. The cardiovascular effects of gonadotropin-releasing hormone antagonists in men with prostate cancer. Eur Heart J Cardiovasc Pharmacother 2022; 8: 253-262.
- Tran C, Ouk S, Clegg N et al. Development of a second-generation antiandrogen for treatment of advanced prostate cancer. Science 2009; 324:787-790.
- Castellan P, Marchioni M, Castellucci R, et al. Abiraterone acetate for early-stage metastatic prostate cancer: patient selection and special considerations. Ther Clin Risk Manag 2018; 14: 2341-2347.
- Abida W, Patnaik A, Campbell D, et al. TRITON2 investigators. Rucaparib in Men With Metastatic Castration-Resistant Prostate Cancer Harboring a BRCA1 or BRCA2 Gene Alteration. J Clin Oncol 2020; 38: 3763-3772.
- de Bono J, Mateo J, Fizazi K, et al. Olaparib for Metastatic Castration-Resistant Prostate Cancer. N Engl J Med 2020; 382: 2091-2102.
- Venkatachalam S, McFarland TR, Agarwal N, et al. Immune Checkpoint Inhibitors in Prostate Cancer. Cancers (Basel) 2021;13(9):2187.
- Deshayes E, Roumiguie M, Thibault C, et al. Radium 223 dichloride for prostate cancer treatment. Drug Des Devel Ther 2017; 11: 2643-2651.
- MacLennan S, Williamson PR, Bekema H, et al. COMPACTERS Study Group. A core outcome set for localised prostate cancer effectiveness trials. BJU Int 2017;120: E64-E79.
- Fitzpatrick J.M., de Wit R. (2014). Taxane mechanisms of action: potential implications for treatment sequencing in metastatic castration-resistant prostate cancer. Eur Urol 2014; 65:1198–1204.
- Sweeney C.J., Chen Y.H., Carducci M., et al. (2015) Chemohormonal therapy in metastatic hormone-sensitive prostate cancer. N Engl J Med 2015; 373: 737–746.
- Gravis G., Fizazi K., Joly F., et al. (2013) Androgen-deprivation therapy alone or with docetaxel in non-castrate metastatic prostate cancer (GETUG-AFU 15): a randomised, open-label, phase 3 trial. Lancet Oncol 2013; 14:149–158.
- James ND, Sydes MR, Clarke NW, et al. (2016. b) Addition of docetaxel, zoledronic acid, or both to first-line long-term hormone therapy in prostate cancer (STAMPEDE): survival results from an adaptive, multiarm, multistage, platform randomised controlled trial. Lancet 2016; 387: 1163–1177.
- Armstrong AJ, Garrett-Mayer E, de Wit R, et al. Prediction of survival following first-line chemotherapy in men with castration-resistant metastatic prostate cancer. Clin Cancer Res 2010; 16: 203-211.
- Oudard S, Fizazi K, Sengeløv L, et al. Cabazitaxel Versus Docetaxel As First-Line Therapy for Patients With Metastatic Castration-Resistant Prostate Cancer: A Randomized Phase III Trial-FIRSTANA. J Clin Oncol 2017; 35: 3189-3197.
- de Bono JS, Oudard S, Ozguroglu M, et al; TROPIC Investigators. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet 2010; 376: 1147-1154.
- Di Lorenzo G, DʼAniello C, Buonerba C, et al. Peg-filgrastim and cabazitaxel in prostate cancer patients. Anticancer Drugs 2013; 24: 84-89.
- Anassi E, Ndefo UA. Sipuleucel-T (provenge) injection: the first immunotherapy agent (vaccine) for hormone-refractory prostate cancer. P T. 2011; 36: 197-202.
- Kantoff PW, Higano CS, Shore ND, et al; IMPACT Study Investigators. Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N Engl J Med 2010; 363: 411-422.
CMJ 2022; 4: 244-250