Περίληψη
Εισαγωγή-Σκοπός: Η χρόνια νεφρική νόσος σχετίζεται με αυξημένη ολική θνησιμότητα, ενώ τα καρδιαγγειακά νοσήματα αποτελούν την κύρια αιτία θνησιμότητας σε αυτή την ομάδα των ασθενών. Η νευροπάθεια του αυτονόμου νευρικού συστήματος (ΚΑΝ) αποτελεί προγνωστικό παράγοντα θνησιμότητας σε ικανό αριθμό παθολογικών καταστάσεων. Στην παρούσα προοπτική μελέτη εξετάσαμε την προγνωστική αξία της ύπαρξης διαβήτη, των δεικτών λειτουργίας της αριστερής κοιλίας και της δραστηριότητας του καρδιακού αυτόνομου νευρικού συστήματος σε σχέση με την ολική και καρδιαγγειακή θνησιμότητα σε ασθενείς με χρόνια νεφρική ανεπάρκεια τελικού σταδίου (ΧΝΑ).
Μέθοδοι: Η ΧΝΑ ορίστηκε ως ρυθμός σπειραματικής διήθησης <15 mL/min/1.73m2. Συνολικά συμπεριλήφθηκαν 133 ασθενείς με ΧΝΑ. Το 39% των συμμετεχόντων έπασχε από σακχαρώδη διαβήτη, ενώ 58 άτομα (47.2%) είχαν κατά την εισαγωγή στη μελέτη καρδιαγγειακή νόσο. Μετρήθηκε το κλάσμα εξώθησης (ΚΕΑΚ) και ο δείκτης μάζας της αριστερής κοιλίας (LVMI) με τη χρήση Doppler υπερηχογραφήματος δύο διαστάσεων. Η παρουσία ΚΑΝ αξιολογήθηκε με τις κλασσικές δοκιμασίες κατά Ewing.
Αποτελέσματα: Συνολικά 123/133 (92.5%) από τους συμμετέχοντες ολοκλήρωσαν τη μελέτη και η μέση διάρκεια παρακολούθησης ήταν 4.9±2.6 έτη. Κατά την παρακολούθηση καταγράφηκαν 69 θάνατοι. Οι 36 (52%) εξ αυτών οφείλονταν σε καρδιαγγειακά αίτια, οι 21 (30%) σε μη καρδιαγγειακά αίτια, ενώ σε 12 ασθενείς (17%) η αιτία θανάτου ήταν άγνωστη. Τα ποσοστά επιβίωσης στα 3, 5 και 7 έτη ήταν 77.2%, 57.4% και 33.7%, αντίστοιχα. Η πολυπαραγοντική ανάλυση έπειτα από διόρθωση ως προς την περίμετρο της μέσης, τη συνήθεια του καπνίσματος, την ύπαρξη διαβήτη και το ιστορικό καρδιαγγειακής νόσου κατά την ένταξη στη μελέτη, έδειξε ότι ανεξάρτητοι παράγοντες κινδύνου για αυξημένη ολική και καρδιαγγειακή θνητότητα ήταν η ηλικία, τα τριγλυκερίδια, το ΚΕΑΚ και η παρουσία ΚΑΝ.
Συμπέρασμα: Σε ασθενείς με ΧΝΑ, η ύπαρξη ΚΑΝ, το μειωμένο ΚΕΑΚ, η μεγάλη ηλικία και τα αυξημένα τριγλυκερίδια είναι ανεξάρτητοι προγνωστικοί παράγοντες αυξημένης ολικής και καρδιαγγειακής θνητότητας.
The Importance of Cardiac Autonomic Neuropathy in All-Cause and Cardiovascular Mortality in Patients with Renal Failure
Anastasios Tentolouris1, Ioanna Eleftheriadou1, Chris Kapelios1, Dimitrios Doulgerakis1, Ioannis Moyssakis2, Stamatia Chorepsima1, Spyridon Michail3, Nikolaos Tentolouris1
1Diabetes Center, First Department of Propaedeutic and Internal Medicine, Medical School, National and Kapodistrian University of Athens, Laiko General Hospital & 2Department of Cardiology, Laiko General Hospital & 3Department of Nephrology, Laiko General Hospital
Abstract
Introduction-Aim: Chronic renal disease is associated with increased cardiovascular (CV) mortality. Cardiac autonomic neuropathy (CAN) is predictive of mortality in other morbid conditions. We prospectively evaluated the prognostic value of indices of left ventricular (LV) function, CAN and diabetes in all-cause and CV mortality of patients with renal failure (RF).
Methods: A total of 133 patients with RF were recruited. Diabetes was present in 39% of patients, whereas 58 (47.2%) had a history of CV disease at baseline. LV ejection fraction (LVEF) and LV mass index (LVMI) were evaluated by complete two-dimensional and Doppler echocardiograms, while CAN was assessed using the battery of the four standardized tests proposed by Ewing et al.
Results: A total of 123/133 (92.5%) completed the study and were followed for a mean of 4.9±2.6 years. Mean LVEF was 50.9±6.9%, mean LVMI 159.8 g/m2 and 70 (57.9%) patients had CAN. A total of 69 deaths were recorded during follow-up; 36 deaths were classified as CV, 21 as non-CV, while cause of death was unidentified in 12 patients. The cumulative survival rates at 3, 5 and 7 years were 77.2%, 57.4% and 33.7%, respectively. Multivariate analysis after adjustment for waist circumference, current smoking, history of diabetes and coronary artery disease, demonstrated that the only independent predictors of all-cause mortality during follow-up were age, serum triglycerides, LVEF and presence of CAN. After adjusting for potential confounders, independent risk factors for CV mortality were the same as for all-cause mortality: age, serum triglycerides, LVEF and presence of CAN.
Conclusion: Presence of CAN and LVEF are independent risk factors for all-cause and CV mortality in patients with RF, while other risk factors identified were age and serum triglycerides.
1. Εισαγωγή
Η χρόνια νεφρική νόσος (ΧΝΝ) αποτελεί παγκόσμιο πρόβλημα υγείας με σημαντικές κοινωνικές και οικονομικές επιπτώσεις. Περίπου 16% του πληθυσμού στην Ευρώπη και 13% στις Ηνωμένες Πολιτείες πάσχουν από ΧΝΝ1. Τα τελευταία έτη η αυξημένη συχνότητα των καρδιαγγειακών συμβαμάτων και η αυξημένη ολική θνησιμότητα των ασθενών με ΧΝΝ έχει προσελκύσει το ενδιαφέρον της επιστημονικής κοινότητας2. Η χρόνια νεφρική ανεπάρκεια (ΧΝΑ), που απαιτεί αιμοκάθαρση ή μεταμόσχευση νεφρού, είναι η αναμενόμενη έκβαση της ΧΝΝ. Ωστόσο, η πλειονότητα των ασθενών με νεφρική ανεπάρκεια, ανεξαρτήτως σταδίου, καταλήγουν λόγω καρδιαγγειακής νόσου αρκετά χρόνια πριν την αιμοκάθαρση ή την μεταμόσχευση νεφρού3.
Πολυάριθμες μελέτες έχουν προσπαθήσει να αναγνωρίσουν τους παράγοντες κινδύνου που σχετίζονται με την αυξημένη νοσηρότητα και θνησιμότητα στους ασθενείς με ΧΝΝ, και ιδιαίτερα στους ασθενείς με ΧΝΑ (εκτιμώμενος ρυθμός σπειραματικής διήθησης [eGFR] <15 mL/min/1,73 m2)4. Η υψηλή συστολική (ΣΑΠ) και η χαμηλή διαστολική (ΔΑΠ) αρτηριακή πίεση, η αυξημένη πίεση παλμού, η υπερτροφία της αριστερής κοιλίας (ΥΑΚ) και η αναιμία έχουν αναγνωρισθεί ως ανεξάρτητοι παράγοντες καρδιαγγειακής νοσηρότητας και θνησιμότητας στους ασθενείς με ΧΝΑ5,6.Η ΧΝΝ συνδέεται, επίσης, με χειρότερη λειτουργία του αυτόνομου νευρικού συστήματος. Η μεταβλητότητα του καρδιακού ρυθμού έχει χρησιμοποιηθεί ως δείκτης της νευροπάθειας του καρδιακού αυτονόμου νευρικού συστήματος (ΚΑΝ) και μελέτες που έχουν πραγματοποιηθεί με ασθενείς με ΧΝΑ αναφέρουν ότι η μείωση της μεταβλητότητας του καρδιακού ρυθμού αποτελεί προγνωστικό παράγοντα θνησιμότητας σε αυτήν την ομάδα των ασθενών7. Οι αποτιτανώσεις στις στεφανιαίες αρτηρίες, τα χαμηλά επίπεδα λευκωματίνης ορού και φετουίνης-α, καθώς και η αυξημένη αρτηριακή σκληρία έχουν επιπλέον συσχετιστεί με αυξημένη θνησιμότητα σε ασθενείς που υποβάλλονται σε εξωνεφρική κάθαρση8-10. Ωστόσο, πρόσφατες μελέτες έχουν δείξει ότι τόσο η μεταβλητότητα του καρδιακού ρυθμού όσο και διάφοροι δείκτες φλεγμονής ή οξειδωτικού στρες, αναιμίας, δυσλειτουργίας του ενδοθηλίου ή αποτιτάνωσης των αρτηριών έχουν περιορισμένη χρησιμότητα ως προγνωστικά εργαλεία σε ασθενείς με ΧΝΝ11.
Επιπρόσθετα εργαλεία ικανά για τη βελτίωση της αξιολόγησης του κινδύνου σε αυτόν τον πληθυσμό είναι σαφώς επιθυμητά. Ο σκοπός της μελέτης μας ήταν η προοπτική αξιολόγηση της προγνωστικής αξίας των δεικτών της λειτουργίας της αριστερής κοιλίας και της ΚΑΝ στην καρδιαγγειακή και ολική θνησιμότητα σε ασθενείς με ΧΝΑ, οι οποίοι βρίσκονται είτε στο στάδιο είτε στο προστάδιο της εξωνεφρικής κάθαρσης.
2. Υλικά και Μέθοδοι
2.1 Συμμετέχοντες
Συνολικά 133 ασθενείς με ΧΝΑ συμπεριλήφθηκαν στη μελέτη. Οι ασθενείς επιλέχθηκαν διαδοχικά από τα εξωτερικά ιατρεία της Νεφρολογικής Κλινικής και από το Κέντρο Αιμοκάθαρσης του Νοσοκομείου μας. Όλοι οι ασθενείς έδωσαν γραπτή συγκατάθεση έπειτα από ενημέρωση πριν από τη συμμετοχή τους στη μελέτη. Η μελέτη διεξήχθη σύμφωνα με τις αρχές της Διακήρυξης του Ελσίνκι και έχει εγκριθεί από την Επιτροπή Δεοντολογίας του Νοσοκομείου.
Όλοι οι ασθενείς υποβλήθηκαν σε πλήρη φυσική εξέταση κατά την έναρξη της μελέτης. Ειδικά ερωτηματολόγια χρησιμοποιήθηκαν για την αξιολόγηση του ατομικού ιστορικού, τις τρέχουσες παθήσεις και τη χρήση φαρμάκων. Οι συμμετέχοντες ταξινομήθηκαν σε νυν καπνιστές, πρώην καπνιστές ή μη καπνιστές σύμφωνα με τη συνήθεια του καπνίσματος. Μετρήθηκε το ύψος και το βάρος και υπολογίσθηκε ο δείκτης μάζας σώματος. Η περίμετρος της μέσης μετρήθηκε με ταινία κατά την όρθια στάση, στο μέσο της απόστασης μεταξύ της χαμηλότερης πλευράς και της λαγονίου ακρολοφίας. Η αρτηριακή πίεση μετρήθηκε, χρησιμοποιώντας κατάλληλο μέγεθος περιχειρίδας, τρεις φορές με διαστήματα 5 λεπτών με τον συμμετέχοντα να βρίσκεται σε καθιστή θέση. Η μέση τιμή των τελευταίων δύο μετρήσεων χρησιμοποιήθηκε στη στατιστική ανάλυση. Ως αρτηριακή υπέρταση ορίστηκε η ΣΑΠ >140 mmHg και/ή ΔΑΠ >90 mmHg, σύμφωνα με τις τρέχουσες κατευθυντήριες οδηγίες12, ή η λήψη αντιυπερτασικής αγωγής. Η παρουσία σακχαρώδους διαβήτη επιβεβαιώθηκε από τα ιατρικά αρχεία και τη χρήση αντιδιαβητικών φαρμάκων. Τα άτομα χωρίς διαβήτη είχαν επίπεδα γλυκόζης νηστείας ορού <126 mg/dl και επίπεδα γλυκοζυλιωμένης αιμοσφαιρίνης (ΗbA1c) <6,5%. Ως καρδιαγγειακή νόσος ορίστηκε η στεφανιαία νόσος και/ή η αγγειακή εγκεφαλική νόσος και/ή η περιφερική αρτηριακή νόσος. Ως στεφανιαία νόσος ορίστηκε το ιστορικό χρόνιας στηθάγχης ή εμφράγματος του μυοκαρδίου, η διενέργεια διαδερμικής αγγειοπλαστικής των στεφανιαίων ή χειρουργείου παράκαμψης των στεφανιαίων αρτηριών. Ως περιφερική αρτηριακή νόσος ορίστηκε η παρουσία διαλείπουσας χωλότητας, το ιστορικό επαναγγείωσης στις αρτηρίες των κάτω άκρων ή ο κνημοβραχιόνιος δείκτης <0,90. Ως αγγειακή εγκεφαλική νόσος ορίστηκε το ιστορικό αγγειακού εγκεφαλικού επεισοδίου.
2.2 Βιοχημικές και ανοσολογικές μετρήσεις
Η αιμοληψία πραγματοποιήθηκε νωρίς το πρωί έπειτα από 8-10 ώρες νηστείας. Τα λιπίδια του ορού [ολική χοληστερόλη, υψηλής πυκνότητας λιποπρωτεΐνη (HDL-χοληστερόλη), τριγλυκερίδια], η αλβουμίνη και η κρεατινίνη μετρήθηκαν σε αναλυτή Technicon RA-XT (Technicon Ltd, Dublin, Ireland). Τα επίπεδα χαμηλής πυκνότητας λιποπρωτεΐνης (LDL-χοληστερόλη) υπολογίστηκαν χρησιμοποιώντας την εξίσωση του Friedewald. Η γλυκόζη του ορού μετρήθηκε με τη μέθοδο της γλυκόζης οξειδάσης-υπεροξειδάσης (Zafiropoulos, Athens, Hellas). Τα επίπεδα της HbA1c προσδιορίστηκαν χρησιμοποιώντας αναλυτή DCA (DCA 2000+, Bayer HealthCare LLC, Elkhart, IN 46514 USA). Ο eGFR υπολογίστηκε σύμφωνα με την εξίσωση τροποποίηση της δίαιτας σε νεφρική νόσο (MDRD)13. Η παραθορμόνη μετρήθηκε με ραδιοανοσοδοκιμασία (CIS Bio International, Gif-sur-Yvette, France; c.v. 4.9 ± 2.1%).
2.3 Εκτίμηση της υπερτροφίας της αριστερής κοιλίας
Χρησιμοποιήθηκε υπερηχοκαρδιογράφημα δυο διαστάσεων και Doppler για την καταγραφή με το σύστημα υπερήχων Hewlett Packard Sonos 1000 (Hewlett Packard, USA). Μετρήθηκαν οι διαστάσεις της αριστερής κοιλίας, το πάχος του μεσοκοιλιακού διαφράγματος και το πάχος του οπίσθιου τοιχώματος της αριστερής κοιλίας σύμφωνα με τις κατευθυντήριες οδηγίες της Αμερικανικής Εταιρείας Υπερηχων14. Επίσης, μετρήθηκε το κλάσμα εξώθησης της αριστερής κοιλίας (ΚΕΑΚ) (μέθοδος του Simpson), ενώ χρησιμοποιώντας το ιστικό Doppler της μιτροειδούς βαλβίδας υπολογίστηκαν: το κύμα Ε (πλήρωση στην πρώιμη διαστολή), το κύμα Α (πλήρωση κατά τη διάρκεια της κολπικής συστολής), και ο ισοογκωτικός χρόνος χάλασης (IVRT). Οι μέσες τιμές πέντε καρδιακών κύκλων χρησιμοποιήθηκαν για την ανάλυση. Στη συνέχεια μετρήθηκε η μάζα της αριστερής κοιλίας, έγινε διόρθωση για την επιφάνεια σώματος και υπολογίσθηκε ο δείκτης μάζας της αριστερής κοιλίας (LVMI)14,15. Μετρήθηκε επίσης ο δείκτης μυοκαρδιακής απόδοσης (δείκτης Tei) της αριστερής κοιλίας, που αποτελεί ένα συνδυασμό της συστολικής και διαστολικής λειτουργίας της αριστερής κοιλίας και ορίζεται ως το άθροισμα του χρόνου ισοογκωτικής συστολής και του IVRT διά του χρόνου εξωθήσεως της αριστερής κοιλίας16.
2.4 Εκτίμηση της λειτουργίας του αυτόνομου νευρικού συστήματος της καρδιάς
Η λειτουργία του καρδιακού αυτόνομου νευρικού συστήματος εκτιμήθηκε με τη χρήση των τεσσάρων κλασικών δοκιμασιών των Ewing et al17. Η απόκριση του καρδιακού ρυθμού σε βαθιά αναπνοή (έξι αναπνοές το λεπτό) εκτιμήθηκε με υπολογισμό του λόγου των μεγαλύτερων RR διαστημάτων κατά τη διάρκεια της εκπνοής προς τα βραχύτερα RR διαστήματα κατά τη διάρκεια της εισπνοής (λόγος Ε/Ι). Η απόκριση του καρδιακού ρυθμού κατά την έγερση από την ύπτια θέση (δοκιμασία έγερσης) υπολογίστηκε ως ο λόγος του μεγαλύτερου RR διαστήματος (περίπου στον 30ο καρδιακό χτύπο) προς το βραχύτερο RR διάστημα (περίπου στον 15ο καρδιακό χτύπο) έπειτα από την έγερση (λόγος 30:15). Η απόκριση του καρδιακού ρυθμού κατά τη δοκιμασία Valsalva εκτιμήθηκε με υπολογισμό του λόγου του μεγαλύτερου RR διαστήματος μετά τον χειρισμό Valsalva προς το βραχύτερο RR διάστημα κατά τη διάρκεια ή λίγο μετά το χειρισμό (λόγος Valsalva). Όλοι οι υπολογισμοί έγιναν με καταγραφή των RR διαστημάτων αυτόματα στο ηλεκτροκαρδιογράφημα, χρησιμοποιώντας υπολογιστή και το σύστημα αξιολόγησης VariaCardio TF5 (Medical Research Limited, Leeds, UK)18. Οι δοκιμασίες διεξήχθησαν από τις 07.00 ως τις 09.00 η ώρα, σε περιβάλλον με σταθερή θερμοκρασία 22-24°C. Οι συμμετέχοντες προσέρχονταν έπειτα από 8 έως 10 ώρες νηστείας, έχοντας αποφύγει τη λήψη καφέ και το κάπνισμα πριν από την εξέταση. Όλες οι δοκιμασίες του καρδιακού ρυθμού αξιολογήθηκαν σύμφωνα με δημοσιευμένες τιμές ανά ηλικά19. Ως ορθοστατική υπόταση ορίσθηκε η πτώση της ΣΑΠ >20 mmHg. Πτώση της ΣΑΠ 11-20 mmHg θεωρήθηκε οριακή, ενώ πτώση της ΣΑΠ <10 mmHg θεωρήθηκε φυσιολογική απόκριση19. Κάθε δοκιμασία αξιολογήθηκε ως φυσιολογική (βαθμός 0), ως οριακή (βαθμός 1) ή ως παθολογική (βαθμός 2). Το συνολικό σκορ υπολογίσθηκε ως το άθροισμα των επιμέρους τεσσάρων βαθμολογιών (ελάχιστο σκορ 0/8, ανώτερο σκορ 8/8). Η ΚΑΝ διαγνώστηκε όταν τουλάχιστον δύο από τις τέσσερις δοκιμασίες ήταν παθολογικές (βαθμός 2)17,20.
2.5 Στατιστική ανάλυση
Η στατιστική ανάλυση πραγματοποιήθηκε με τη χρήση του στατιστικού πακέτου IBM SPSS (software version 22.0, Armonk, NY, USA). Αρχικά, έγινε έλεγχος κανονικότητας των μεταβλητών. Περιγραφικά οι μεταβλητές παρουσιάζονται ως μέση τιμή ± τυπική απόκλιση ή ως διάμεσος τιμή και ενδο-τεταρτημοριακό εύρος. Για τη σύγκριση ποσοτικών μεταβλητών με κανονική κατανομή χρησιμοποιήθηκε το independent samples t-test. Για τη σύγκριση ποσοτικών μεταβλητών με μη κανονική κατανομή χρησιμοποιήθηκε το Mann-Whitney U 2-independent samples t-test. Οι ποιοτικές μεταβλητές συγκρίθηκαν με τη δοκιμασία Χ2. Οι συσχετίσεις μεταξύ συνεχών μεταβλητών εξετάστηκαν με τη χρήση των συντελεστών Pearson ή Spearman, σύμφωνα με τις συγκεκριμένες ενδείξεις. Η προγνωστική αξία κάθε μεταβλητής όσο αφορά την ολική και την καρδιαγγειακή θνησιμότητα εξετάσθηκε με τo μοντέλο αναλογικού κινδύνου Cox. Ως επίπεδο στατιστικής σημαντικότητας ορίσθηκαν οι τιμές p <0,05.
3. Αποτελέσματα
3.1 Χαρακτηριστικά κατά την έναρξη
Δέκα ασθενείς χάθηκαν κατά τη διάρκεια της παρακολούθησης. Συνολικά 123 από τους 133 (92,5%) ολοκλήρωσαν τη μελέτη και συμπεριλήφθηκαν στην τελική ανάλυση. Δεν παρατηρήθηκαν σημαντικές διαφορές στα αρχικά χαρακτηριστικά των ασθενών που ολοκλήρωσαν τη μελέτη και σε αυτούς που χάθηκαν στην παρακολούθηση.
Η μέση ηλικία του πληθυσμού ήταν 59,5±14,6 έτη και 64,2% ήταν άνδρες. Σακχαρώδη διαβήτη εμφάνιζε το 39% των ασθενών, ενώ 58 άτομα (47,2%) είχαν ιστορικό καρδιαγγειακής νόσου κατά την έναρξη. Η μέση τιμής ΣΑΠ ήταν 144,3±31,7 mmHg, η μέση τιμή αιμοσφαιρίνης ήταν 10,7±1,6 g/dL και η μέση τιμή του eGFR ήταν 10,7±1,6 ml/min/1.73m². Τα δημογραφικά και κλινικά χαρακτηριστικά του πληθυσμού της μελέτης φαίνονται στον Πίνακα 1.
Πίνακας 1. Tα χαρακτηριστικά των συμμετεχόντων κατά την έναρξη
| ν | 123 |
| Ηλικία (έτη) | 59.5 ± 14.6 |
| Άνδρες/ Γυναίκες, ν (%) | 79/44 (64.2/35.8) |
| Δείκτης Μάζας Σώματος (Kg/m2) | 25.1 ± 4.9 |
| Περίμετρος μέσης (εκ) | 90.6 ± 14.1 |
| Συστολική Αρτηριακή Πίεση (mmHg) | 144.3 ± 31.7 |
| Διαστολική Αρτηριακή Πίεση (mmΗg) | 80.7 ± 13.2 |
| Νυν καπνιστές, ν (%) | 36 (29.3) |
| Παρουσία διαβήτη, ν (%) | 48 (39.0) |
| Στεφανιαία νόσος, ν (%) | 28 (22.8) |
| Αγγειακή εγκεφαλική νόσος, ν (%) | 10 (8.1) |
| Περιφερική αρτηριακή νόσος, ν (%) | 42 (34.0) |
| Οποιαδήποτε καρδιαγγειακή νόσος, ν (%) | 58 (47.2) |
| Εξωνεφρική κάθαρση, ν (%) | 63 (51.2) |
| Διαβητική νεφροπάθεια, ν (%) | 47 (38.2) |
| Ρυθμός σπειραματικής διήθησης (ml/min/1.73m2) | 7.5 (5.8-10.1) |
| Αιμοσφαιρίνη (g/dl) | 10.7 ± 1.6 |
| Ολική χοληστερόλη (mg/dl) | 200.2 ± 48.2 |
| LDL χοληστερόλη (mg/dl) | 120.2 ± 40.3 |
| HDL χοληστερόλη (mg/dl) | 39.9 ± 14.2 |
| Τριγλυκερίδια (mg/dl) | 179 (122-242) |
| Αλβουμίνη (mg/dl) | 4.26 ± 0.57 |
| Γλυκόζη (mg/dl) | 109.6 ± 49.6 |
| Παραθορμόνη (ng/l) | 225.5 (96.0-351.2) |
Αγωγή, ν (%) | |
| B-αναστολείς | 18 (14.6) |
| ΑΜΕΑ/ΑΥΑΙΙ | 29 (23.6) |
| Αναστολείς διαύλων ασβεστίου | 66 (53.7) |
| Διουρητικά | 36 (29.3) |
| Ινσουλίνη | 34 (70.8)* |
Τα δεδομένα παρουσιάζονται ως μέση τιμή ± τυπική απόκλιση, διάμεσος (25η-75η θέση) ή ως ν (%). * Το ποσοστό χρήσης ινσουλίνης υπολογίσθηκε στους ασθενείς που πάσχουν από διαβήτη. LDL: χαμηλής πυκνότητας λιποπρωτεΐνη, HDL: υψηλής πυκνότητας λιποπρωτεΐνη, ΑΜΕΑ αναστολέας μετατρεπτικού ενζύμου, ΑΥΙΙ: αναστολέας υποδοχέων αγγειοτασίνης ΙΙ.
Οι υποκείμενες νεφρικές παθήσεις οι οποίες οδήγησαν σε ΧΝΑ ήταν η διαβητική νεφροπάθεια (38,2%), η αγγειακή/υπερτασική νεφροπάθεια (10,6%), οι σπειραματονεφρίτιδες (8,9%), οι αποφρακτικές νεφροπάθειες (8,1%), η πολυκυστική νεφρική νόσος (5,7%), καθώς και δευτεροπαθείς σπειραματοπάθειες από νόσους του κολλαγόνου (4,9%) και το πολλαπλούν μυέλωμα (3,3%). Σε 25 ασθενείς (20,3%) δεν ήταν γνωστή η αιτία της ΧΝΑ.
3.2 Υπερηχοκαρδιογράφημα
Οι μέσες υπερηχογραφικές μετρήσεις των ασθενών της μελέτης παρουσιάζονται στον Πίνακα 2. Η μέση τιμή του ΚΕΑΚ ήταν 50,9±6,9%, η μέση τιμή του LVMI ήταν 159,8 g/m2, και πιο συγκεκριμένα, 159,5±9,9 g/m2 ήταν για τους άνδρες και 160,4±9,9 g/m2 για τις γυναίκες. Όταν η ΥΑΚ ορίστηκε ως LVMI >115 g/m2 στους άντρες και >95 g/m2 στις γυναίκες, το 93,5% των ανδρών και το 100% των γυναικών είχα YAK.
3.3 Καρδιακή αυτόνομη λειτουργία
Εβδομήντα ασθενείς (57,9%) πληρούσαν τα κριτήρια διάγνωσης της ΚΑΝ. Μόνο 40 ασθενείς (33,1%) είχαν φυσιολογική δοκιμασία βαθιάς αναπνοής, ενώ 69 (56,1%) είχαν φυσιολογική δοκιμασία έγερσης. Δεδομένα για τη δοκιμασία Valsalva και τη βαθιά αναπνοή έλειπαν σε δύο ασθενείς λόγω κακής συμμόρφωσης κατά την εκτέλεση των δοκιμασιών. Τα αποτελέσματα των δοκιμασιών του καρδιακού αυτόνομου νευρικού συστήματος φαίνονται λεπτομερώς στον Πίνακα 2.
Πίνακας 2. Μετρήσεις υπερηχοκαρδιογραφικής μελέτης και καρδιακού αυτόνομου νευρικού συστήματος
| Μεσοκοιλιακό διάφραγμα (mm) | 12.6 ± 1.2 |
| Οπίσθιο τοίχωμα αριστερής κοιλίας (mm) | 12.2 ± 1.2 |
| Κλάσμα εξώθησης αριστερής κοιλίας (%) | 50.9 ± 6.9 |
| Δείκτης μάζας αριστερής κοιλίας (g/m2) | 159.8 ± 35.6 |
| Λόγος πλήρωσης αριστερής κοιλίας κατά την πρώιμη διαστολική φάση προς την πλήρωση κατά το κολπικό λάκτισμα (λόγος E/A) | 0.84 ± 0.21 |
| Λόγος E/I * (φυσιολογικό/οριακό/παθολογικό) | 40/17/64 (33.1/14.0/52.9) |
| Λόγος 30:15 (φυσιολογικό/οριακό/παθολογικό) | 31/24/68 (25.2/19.5/55.3) |
| Λόγος Valsalva* (φυσιολογικό/οριακό/παθολογικό) | 34/17/70 (28.1/14.0/57.9) |
| Διαφορά ΣΑΠ κατά την έγερση (φυσιολογικό/οριακό/παθολογικό) | 69/23/31 (56.1/18.7/25.2) |
| Συνολικό σκορ | 5 (3–6) |
| Παρουσία ΚΑΝ, ν (%) | 70 (57.9) |
Τα δεδομένα παρουσιάζονται ως μέση τιμή ± τυπική απόκλιση, διάμεσος (25η-75η θέση) ή ως ν (%). * Μη διαθέσιμο σε 2 ασθενείς λόγω κακής συμμόρφωσης. ΣΑΠ: Συστολική αρτηριακή πίεση, ΚΑΝ: νευροπάθεια του καρδιακού αυτονόμου νευρικού συστήματος
Το συνολικό σκορ της ΚΑΝ συσχετιζόταν σημαντικά με το ΚΕΑΚ (r=0,199, p=0,034), το LVMI (r =-0.245, p=0,009) και τα τριγλυκερίδια του ορού (r=0,237, p=0,01). Ωστόσο, δεν παρατηρήθηκε συσχέτιση μεταξύ της ΚΑΝ και της περιμέτρου της μέσης (r=0,066, p=0,475). Περιέργως τα αποτελέσματα των δοκιμασιών του καρδιακού αυτόνομου νευρικού συστήματος δεν διέφεραν μεταξύ των ασθενών που υποβάλλονταν σε εξωνεφρική κάθαρση και αυτών που δεν υποβάλλονταν.
3.4 Έκβαση
Η μέση παρακολούθηση των ασθενών ήταν 4,9±2,6 έτη (διάμεσος 5,7, εύρος 0,1-9,0 έτη), παραθέτοντας ένα σύνολο 606,4 ασθενο-ετών. Πενήντα πέντε από τους 60 (91,6%) ασθενείς που βρίσκονταν ένα στάδιο πριν την εξωνεφρική κάθαρση άρχισαν αιμοκάθαρση μετά από μια μέση διάρκεια 0,9±1,1 ετών, ενώ 16 (13,0%) ασθενείς μεταμοσχεύθηκαν μετά από μια μέση διάρκεια 3.1±2,2 ετών. Καταγράφηκαν συνολικά 69 θάνατοι κατά τη διάρκεια της παρακολούθησης. Από αυτούς οι 36 χαρακτηρίστηκαν ως θάνατοι οφειλόμενοι σε καρδιαγγειακά συμβάματα, οι 21 ως θάνατοι οφειλόμενοι σε μη καρδιαγγειακά αίτια, ενώ σε 12 ασθενείς δεν αναγνωρίσθηκε η αιτία θανάτου.
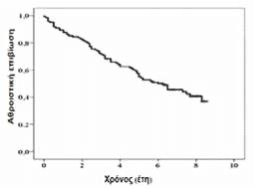
Τα αθροιστικά ποσοστά επιβίωσης στα 3, 5 και 7 έτη ήταν 77,2%, 57,4% και 33,7%, αντίστοιχα (Εικόνα 1).
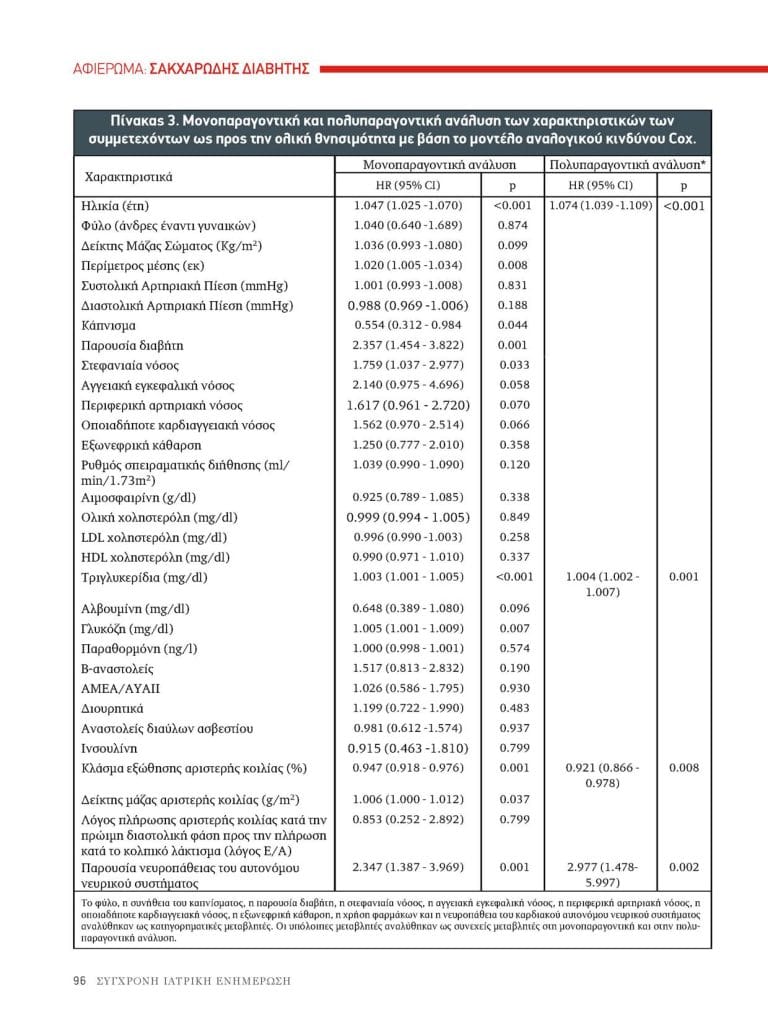
Στη μονοπαραγοντική ανάλυση η ηλικία, η περίμετρος μέσης, η συνήθεια του καπνίσματος, το ιστορικό σακχαρώδους διαβήτη, το ιστορικό στεφανιαίας νόσου, η συγκέντρωση γλυκόζης και τριγλυκεριδίων ορού, το ΚΕΑΚ, ο LVMI και η παρουσία ΚΑΝ, αναγνωρίστηκαν ως προγνωστικοί δείκτες της ολικής θνησιμότητας κατά την διάρκεια της παρακολούθησης (Πίνακας 3). Μετά από διόρθωση για την περίμετρο μέσης, τη συνήθεια του καπνίσματος, το ιστορικό διαβήτη και στεφανιαίας νόσου, οι μόνοι ανεξάρτητοι προγνωστικοί παράγοντες της ολικής θνησιμότητας ήταν η ηλικία, τα επίπεδα τριγλυκεριδίων ορού, το ΚΕΑΚ και η παρουσία ΚΑΝ (Πίνακας 3).
Πίνακας 3. Moνοπαραγοντική και πολυπαραγοντική ανάλυση των χαρακτηριστικών των συμμετεχόντων ως προς την ολική θνησιμότητα με βάση το μοντέλο αναλογικού κινδύνου Cox.
Το φύλο, η συνήθεια του καπνίσματος, η παρουσία διαβήτη, η στεφανιαία νόσος, η αγγειακή εγκεφαλική νόσος, η περιφερική αρτηριακή νόσος, η οποιαδήποτε καρδιαγγειακή νόσος, η εξωνεφρική κάθαρση, η χρήση φαρμάκων και η νευροπάθεια του καρδιακού αυτονόμου νευρικού συστήματος αναλύθηκαν ως κατηγορηματικές μεταβλητές. Οι υπόλοιπες μεταβλητές αναλύθηκαν ως συνεχείς μεταβλητές στη μονοπαραγοντική και στην πολυπαραγοντική ανάλυση.
Με βάση την μέση τιμή του ΚΕΑΚ ο πληθυσμός της μελέτης χωρίσθηκε σε δύο ομάδες (≤50% και >50%). Τα αθροιστικά ποσοστά επιβίωσης κατά τη διάρκεια παρακολούθησης ήταν 30% για τους ασθενείς με ΚΕΑΚ ≤50% και 55,4% για τους ασθενείς με ΚΕΑΚ >50% (log-rank test: p=0.004) (Εικόνα 2), και 32,9% έναντι 60,8% για ασθενείς με ΚΑΝ έναντι ασθενών χωρίς ΚΑΝ (p=0.001) (Εικόνα 3).
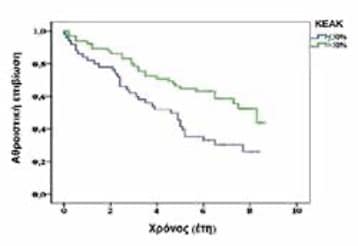
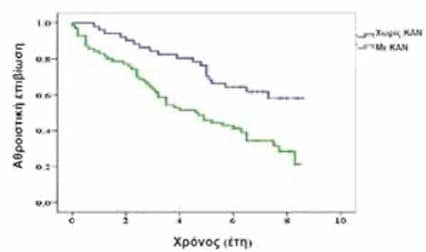
H μονοπαραγοντική ανάλυση έδειξε ότι η ηλικία, η περίμετρος μέσης, το ιστορικό σακχαρώδους διαβήτη, το ιστορικό στεφανιαίας νόσου, το ιστορικό καρδιαγγειακής νόσου, τα επίπεδα γλυκόζης και τριγλυκεριδίων, το ΚΕΑΚ και η παρουσία ΚΑΝ μπορούσαν να προβλέψουν το θάνατο από καρδιαγγειακά αίτια κατά τη διάρκεια παρακολούθησης (Πίνακας 4). Μετά από διόρθωση ως προς την περίμετρο μέσης, το ιστορικό διαβήτη και στεφανιαίας νόσου, οι ανεξάρτητοι παράγοντες κινδύνου για καρδιαγγειακή θνησιμότητα ήταν οι ίδιοι όπως για την ολική θνησιμότητα: η ηλικία, τα τριγλυκερίδια του ορού, το ΚΕΑΚ και η παρουσία ΚΑΝ (Πίνακας 4).
4. Συζήτηση
Το σημαντικότερο νέο εύρημα της μελέτης μας είναι ότι η παρουσία ΚΑΝ αποτελεί ανεξάρτητο παράγοντα κινδύνου για την καρδιαγγειακή και ολική θνησιμότητα σε ασθενείς με ΧΝΑ. Οι υπόλοιποι παράγοντες κινδύνου που αναγνωρίσθηκαν ήταν η ηλικία, το ΚΕΑΚ και η συγκέντρωση των τριγλυκεριδίων. Τα ευρήματά μας πιθανώς υποδηλώνουν ότι οι ανωμαλίες της καρδιακής νεύρωσης προηγούνται των άλλων παθολογικών διεργασιών που σχετίζονται με την καρδιαγγειακή νοσηρότητα και θνησιμότητα και περιπλέκουν τα τελικά στάδια της ΧΝΝ.
Η ΚΑΝ αρχικά αναγνωρίσθηκε και μελετήθηκε εκτενώς σε ασθενείς με σακχαρώδη διαβήτη21. Η παρουσία της ΚΑΝ σε αυτή την ομάδα ασθενών έχει συσχετισθεί με σιωπηλή ισχαιμία του μυοκαρδίου22, συστολική και διαστολική δυσλειτουργία του μυοκαρδίου, ακόμη και εν απουσία στεφανιαίας νόσου23, ενδο – και περι-εγχειρητική καρδιαγγειακή αστάθεια21, αγγειακό εγκεφαλικό επεισόδιο24, εξέλιξη της νεφροπάθειας25 και εμφάνιση ελκών στα κάτω άκρα26. Η ΚΑΝ έχει επίσης αναγνωριστεί ως παράγοντας κινδύνου για αυξημένη θνησιμότητα σε ασθενείς με σακχαρώδη διαβήτη22. Επιπλέον, η ΚΑΝ συσχετίζεται με κακή καρδιοαναπνευστική λειτουργία27, καθώς και με υψηλότερα τριγλυκερίδια και μεγαλύτερη περίμετρο μέσης, συστατικά που αποτελούν μέρος του μεταβολικού συνδρόμου, σε μια μεγάλη μελέτη ατόμων με διαταραγμένη ανοχή γλυκόζης28,29. Σύμφωνα με τα προαναφερθέντα δεδομένα, στη μελέτη μας η ΚΑΝ συσχετίστηκε με τα τριγλυκερίδια του ορού (r=0,237, p=0,01), ωστόσο, δεν παρατηρήθηκε σημαντική συσχέτιση μεταξύ της ΚΑΝ και της περιμέτρου της μέσης (r=0,066, p=0,475). Η δυσλιπιδαιμία άλλωστε, και ιδιαίτερα τα αυξημένα τριγλυκερίδια, έχουν ενοχοποιηθεί ως πιθανοί μηχανισμοί της εξέλιξης της περιφερική νευροπάθειας σε άτομα με σακχαρώδη διαβήτη30. Έχει φανεί ότι τα αυξημένα τριγλυκερίδια προβλέπουν ανεξάρτητα τη συχνότητα εμφάνισης της νεφροπάθειας σε ασθενείς με διαβήτη31, ενισχύοντας περαιτέρω τον ισχυρισμό ότι υφίσταται συσχέτιση μεταξύ της ΚΑΝ και των λιπιδίων του ορού, καθώς και της νεφρική λειτουργίας.
Η ΚΑΝ έχει εξεταστεί, σε μικρότερο βαθμό βέβαια, και σε διάφορες άλλες νοσηρές καταστάσεις. Εκτός από συγγενείς παθήσεις, όπως είναι η οικογενής δυσαυτονομία και η νόσος Ehlers-Danlos32,33, έχει συσχετισθεί με χρόνια αποφρακτική πνευμονοπάθεια34, κίρρωση του ήπατος35, αρτηριακή υπέρταση και υπερουριχαιμία36. Σε ασθενείς με χρόνια καρδιακή ανεπάρκεια λόγω ισχαιμικής ή ιδιοπαθούς διατατικής μυοκαρδιοπάθειας, η παρουσία της ΚΑΝ, όπως προσδιορίζεται από μειωμένη πρόσληψη της μετα-ιωδοβενζυλγουανιδίνης σεσημασμένης με ιώδιο-123 (Ι-123-MIBG) ή από παθολογικές μετρήσεις της μεταβλητότητας του καρδιακού ρυθμού, έχει φανεί ότι προβλέπει την ολική θνησιμότητα και τον αιφνίδιο θάνατο37. Οι διαταραχές του αυτονόμου νευρικού συστήματος μάλιστα φάνηκαν να υποστρέφουν μετά από μακροχρόνια κυκλοφορική υποστήριξη με συσκευή υποβοήθησης της αριστερής κοιλίας σε ασθενείς με καρδιακή ανεπάρκεια τελικού σταδίου38. Το εύρημα αυτό, καθώς και άλλα από μελέτες που αναφέρουν βελτίωση της λειτουργίας του καρδιακού αυτονόμου νευρικού συστήματος με διάφορες παρεμβάσεις σε άτομα με διαβήτη (αυστηρός γλυκαιμικός έλεγχος39, χορήγηση α-λιποϊκού οξέως, βιταμίνης Ε, και C-πεπτιδίου24, αναστολέων του μετατρεπτικού ενζύμου ή καρδιοεκλεκτικών β-αποκλειστών χωρίς συμπαθητικομιμητική δραστηριότητα21), συνεπάγονται προοπτικές για θεραπευτικές εξελίξεις στον τομέα διαχείρισης της ΚΑΝ.
Η συσχέτιση μεταξύ της ΚΑΝ και της νεφρικής νόσου είναι γνωστή για περισσότερο από 40 έτη40. Οι παθοφυσιολογικοί μηχανισμοί που συμβάλλουν στην παθογένεια της δυσλειτουργίας του αυτόνομου νευρικού συστήματος στη ΧΝΝ είναι ανεξάρτητοι από την παρουσία διαβήτη και εμπλέκουν κυρίως την ουραιμία41. Για το λόγο αυτό, η μείωση των επιπέδων της ουραιμίας, είτε μέσω της εντατικής εξωνεφρικής κάθαρσης ή μέσω της μεταμόσχευσης νεφρού, έχει αποδειχθεί ότι βελτιώνει την λειτουργία του καρδιακού αυτονόμου νευρικού συστήματος42,43. Σε κάθε περίπτωση και σύμφωνα με τα αποτελέσματα της παρούσας μελέτης, οι παθολογικές δοκιμασίες του καρδιακού αυτόνομου νευρικού συστήματος είναι εξαιρετικά συχνές μεταξύ των ασθενών με ΧΝΑ που υποβάλλονται σε αιμοκάθαρση44. Η παρουσία της ΚΑΝ έχει συσχετιστεί με αυξημένη συχνότητα εμφάνισης αρρυθμιών και αιφνίδιου καρδιακού θανάτου στους ασθενείς που βρίσκονται σε εξωνεφρική κάθαρση45,46. Εξάλλου, η ΚΑΝ έχει επίσης συσχετισθεί με την νυκτερινή υποξαιμία, την καρδιακή υπερτροφία και την καρδιακή αναδιαμόρφωση στην ίδια ομάδα ασθενών47, διαπιστώσεις οι οποίες είναι σύμφωνες με τις δικές μας. Ωστόσο, η προγνωστική αξία της ΚΑΝ στην μακροπρόθεσμη πρόβλεψη της ολικής και της καρδιαγγειακής θνησιμότητας σε ασθενείς με ΧΝΑ δεν ήταν γνωστή ως σήμερα.
Περιορισμό της μελέτης μας αποτελεί ο μικρός αριθμός ασθενών, ενώ πλεονεκτήματα είναι η μακρά διάρκεια παρακολούθησης, οι μέθοδοι που χρησιμοποιήθηκαν για τη διάγνωση της ΚΑΝ και της λειτουργίας της αριστερής, καθώς και το μεγάλο ποσοστό παραμονής των ασθενών στη μελέτη.
Τα αποτελέσματά μας μπορεί να οδηγήσουν στη χρησιμοποίηση των δοκιμασιών της λειτουργίας του καρδιακού αυτόνομου νευρικού συστήματος για τη διαστρωμάτωση του κινδύνου σε ασθενείς με ΧΝΑ. Επιπλέον, το γεγονός ότι η επαρκής εξωνεφρική κάθαρση έχει αποδειχθεί ότι βελτιώνει την ΚΑΝ μπορεί να οδηγήσει στην εντατικοποίηση της θεραπείας νεφρικής υποκατάστασης σε αυτούς τους ασθενείς. Τέλος, τα δεδομένα μας υποδηλώνουν ότι η ΚΑΝ δεν αποτελεί μία απλή συννοσηρότητα της ΧΝΑ, αλλά έχει σημαντική συμβολή στην καρδιαγγειακή θνησιμότητα που την συνοδεύει και πρέπει να υποκινήσει την έρευνα σε αυτόν τον τομέα, με στόχο την αποσαφήνιση της παθοφυσιολογίας και τη διερεύνηση πιθανών θεραπευτικών επιλογών.
Συμπερασματικά, η ΚΑΝ αποδείχθηκε ότι αποτελεί ανεξάρτητο παράγοντα κινδύνου για την καρδιαγγειακή και ολική θνησιμότητα σε ασθενείς με ΧΝΑ. Τα ευρήματα αυτά υποδεικνύουν ότι οι δοκιμασίες εξέτασης του καρδιακού αυτόνομου συστήματος θα μπορούσαν να χρησιμοποιηθούν για τη διαστρωμάτωση του κινδύνου και την προσαρμογή της θεραπείας στους ασθενείς με ΧΝΑ.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Covic A, Kothawala P, Bernal M, et al. Systematic review of the evidence underlying the association between mineral metabolism disturbances and risk of all-cause mortality, cardiovascular mortality and cardiovascular events in chronic kidney disease. Nephrol Dial Transplant 2009; 24: 1506-1523.
- Daly C. Is early chronic kidney disease an important risk factor for cardiovascular disease? A background paper prepared for the UK Consensus Conference on early chronic kidney disease. Nephrol Dial Transplant 2007; 22 Suppl 9: ix19-25.
- Sarnak MJ, Levey AS, Schoolwerth AC, et al. Kidney disease as a risk factor for development of cardiovascular disease: a statement from the American Heart Association Councils on Kidney in Cardiovascular Disease, High Blood Pressure Research, Clinical Cardiology, and Epidemiology and Prevention. Circulation 2003; 108: 2154-2169.
- Block GA, Klassen PS, Lazarus JM, et al. Mineral metabolism, mortality, and morbidity in maintenance hemodialysis. J Am Soc Nephrol 2004; 15: 2208-2218.
- Glassock RJ, Pecoits-Filho R, Barberato SH. Left ventricular mass in chronic kidney disease and ESRD. Clin J Am Soc Nephrol 2009; 4 Suppl 1: S79-91.
- Mehdi U, Toto RD. Anemia, diabetes, and chronic kidney disease. Diabetes Care 2009; 32: 1320-1326.
- Drawz PE, Babineau DC, Brecklin C, et al. Heart rate variability is a predictor of mortality in chronic kidney disease: a report from the CRIC Study. Am J Nephrol 2013; 38: 517-528.
- Coen G, Pierantozzi A, Spizzichino D, et al. Risk factors of one year increment of coronary calcifications and survival in hemodialysis patients. BMC Nephrol 2010; 11:10.
- Blacher J, Guerin AP, Pannier B, et al. Impact of aortic stiffness on survival in end-stage renal disease. Circulation 1999; 99: 2434-2439.
- Hermans MM, Brandenburg V, Ketteler M, et al. Association of serum fetuin-A levels with mortality in dialysis patients. Kidney Int 2007; 72: 202-207.
- De Serres SA, Varghese JC, Levin A. Biomarkers in native and transplant kidneys: opportunities to improve prediction of outcomes in chronic kidney disease. Curr Opin Nephrol Hypertens 2012; 21: 619-627.
- Mancia G, Fagard R, Narkiewicz K, et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J 2013; 34: 2159-2219.
- Levey AS, Bosch JP, Lewis JB, et al. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Modification of Diet in Renal Disease Study Group. Ann Intern Med 1999; 130: 461-470.
- Lang RM, Bierig M, Devereux RB, et al. Recommendations for chamber quantification. Eur J Echocardiogr 2006; 7: 79-108.
- 15 Devereux RB, Reichek N. Echocardiographic determination of left ventricular mass in man. Anatomic validation of the method. Circulation. 1977; 55: 613-618
- Tei C, Ling LH, Hodge DO, et al. New index of combined systolic and diastolic myocardial performance: a simple and reproducible measure of cardiac function–a study in normals and dilated cardiomyopathy. J Cardiol 1995; 26: 357-366.
- Ewing DJ, Martyn CN, Young RJ, et al. The value of cardiovascular autonomic function tests: 10 years experience in diabetes. Diabetes Care 1985; 8: 491-498.
- Howorka K, Pumprla J, Schabmann A. Optimal parameters of short-term heart rate spectrogram for routine evaluation of diabetic cardiovascular autonomic neuropathy. J Auton Nerv Syst 1998; 69: 164-172.
- Kahn R. Proceedings of a consensus development conference on standardized measures in diabetic neuropathy. Autonomic nervous system testing. Diabetes Care 1992; 15: 1095-1103.
- Tesfaye S, Boulton AJ, Dyck PJ, et al. Diabetic neuropathies: update on definitions, diagnostic criteria, estimation of severity, and treatments. Diabetes Care 2010; 33: 2285-2293.
- Vinik AI, Ziegler D. Diabetic cardiovascular autonomic neuropathy. Circulation 2007; 115: 387-397.
- Vinik AI, Maser RE, Mitchell BD, et al. Diabetic autonomic neuropathy. Diabetes Care 2003; 26: 1553-1579.
- Sacre JW, Franjic B, Jellis CL, et al. Association of cardiac autonomic neuropathy with subclinical myocardial dysfunction in type 2 diabetes. JACC Cardiovasc Imaging 2010; 3: 1207-1215.
- Spallone V, Ziegler D, Freeman R, et al. Cardiovascular autonomic neuropathy in diabetes: clinical impact, assessment, diagnosis, and management. Diabetes Metab Res Rev 2011; 27: 639-653.
- 25 Brotman DJ, Bash LD, Qayyum R, et al. Heart rate variability predicts ESRD and CKD-related hospitalization. J Am Soc Nephrol 2010; 21: 1560-1570.
- 26. Yun JS, Cha SA, Lim TS, et al. Cardiovascular autonomic dysfunction predicts diabetic foot ulcers in patients with type 2 diabetes without diabetic polyneuropathy. Medicine (Baltimore) 2016; 95: e3128.
- 27. Carnethon MR, Prineas RJ, Temprosa M, et al. The association among autonomic nervous system function, incident diabetes, and intervention arm in the Diabetes Prevention Program. Diabetes Care 2006; 29: 914-919.
- 28. Chang CJ, Yang YC, Lu FH, et al. Altered cardiac autonomic function may precede insulin resistance in metabolic syndrome. Am J Med 2010; 123: 432-438.
- 29. Laitinen T, Lindstrom J, Eriksson J, et al. Cardiovascular autonomic dysfunction is associated with central obesity in persons with impaired glucose tolerance. Diabet Med 2011; 28: 699-704.
- 30. Wiggin TD, Sullivan KA, Pop-Busui R, et al. Elevated triglycerides correlate with progression of diabetic neuropathy. Diabetes 2009; 58: 1634-1640.
- 31. Russo GT, De Cosmo S, Viazzi F, et al. Plasma Triglycerides and HDL-C Levels Predict the Development of Diabetic Kidney Disease in Subjects With Type 2 Diabetes: The AMD Annals Initiative. Diabetes Care 2016; 39: 2278-2287.
- 32. Rubin BY, Anderson SL. The molecular basis of familial dysautonomia: overview, new discoveries and implications for directed therapies. Neuromolecular Med 2008; 10: 148-156.
- 33. De Wandele I, Rombaut L, Leybaert L, et al. Dysautonomia and its underlying mechanisms in the hypermobility type of Ehlers-Danlos syndrome. Semin Arthritis Rheum 2014; 44: 93-100.
- 34. Rasheedy D, Taha HM. Cardiac autonomic neuropathy: The hidden cardiovascular comorbidity in elderly patients with chronic obstructive pulmonary disease attending primary care settings. Geriatr Gerontol Int 2016; 16: 329-335.
- 35. Dumcke CW, Moller S. Autonomic dysfunction in cirrhosis and portal hypertension. Scand J Clin Lab Invest 2008; 68: 437-447.
- 36. Liao XP, Zhu HW, Zeng F, et al. The association and interaction analysis of hypertension and uric acid on cardiovascular autonomic neuropathy. J Endocrinol Invest 2015; 38: 1075-1082.
- 37. Anastasiou-Nana MI, Terrovitis JV, Athanasoulis T, et al. Prognostic value of iodine-123-metaiodobenzylguanidine myocardial uptake and heart rate variability in chronic congestive heart failure secondary to ischemic or idiopathic dilated cardiomyopathy. Am J Cardiol 2005; 96: 427-431.
- 38. Drakos SG, Athanasoulis T, Malliaras KG, et al. Myocardial sympathetic innervation and long-term left ventricular mechanical unloading. JACC Cardiovasc Imaging 2010; 3: 64-70.
- 39. Maser RE, Lenhard MJ. An overview of the effect of weight loss on cardiovascular autonomic function. Curr Diabetes Rev 2007; 3: 204-211.
- 40. Ewing DJ, Winney R. Autonomic function in patients with chronic renal failure on intermittent haemodialysis. Nephron 1975; 15: 424-429.
- 41. Elming MB, Hornum M, Feldt-Rasmussen B, et al. Cardiac autonomic neuropathy in patients with uraemia is not related to pre-diabetes. Dan Med Bull 2011; 58: A4244.
- 42. Laaksonen S, Voipio-Pulkki L, Erkinjuntti M, et al. Does dialysis therapy improve autonomic and peripheral nervous system abnormalities in chronic uraemia? J Intern Med 2000; 248: 21-26.
- 43. Yildiz A, Sever MS, Demirel S, et al. Improvement of uremic autonomic dysfunction after renal transplantation: a heart rate variability study. Nephron 1998; 80: 57-60.
- 44. Sahin M, Kayatas M, Urun Y, et al. Performing only one cardiovascular reflex test has a high positive predictive value for diagnosing autonomic neuropathy in patients with chronic renal failure on hemodialysis. Ren Fail 2006; 28: 383-387.
- 45. Jassal SV, Coulshed SJ, Douglas JF, et al. Autonomic neuropathy predisposing to arrhythmias in hemodialysis patients Am J Kidney Dis. 1997; 30: 219-223.
- 46. Ranpuria R, Hall M, Chan CT, et al. Heart rate variability (HRV) in kidney failure: measurement and consequences of reduced HRV. Nephrol Dial Transplant 2008; 23: 444-449.
- 47. Zoccali C, Mallamaci F, Tripepi G, et al. Autonomic neuropathy is linked to nocturnal hypoxaemia and to concentric hypertrophy and remodelling in dialysis patients. Nephrol Dial Transplant 2001; 16: 70-77.











Άφησε σχόλιο