Περίληψη
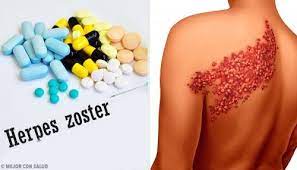
Ο έρπης ζωστήρας αποτελεί σημαντική αιτία νοσηρότητας σε άτομα άνω των 50 ετών καθώς και σε ανοσοκατεσταλμένους, που μειώνει την ποιότητα ζωής τους και ταυτόχρονα επιβαρύνει τα συστήματα υγείας. Η κλινική εικόνα της νόσου και οι χαρακτηριστικές εκδηλώσεις της, την καθιστούν εύκολη στην διάγνωση, ωστόσο οι θεραπευτικές επιλογές που υπάρχουν αν και ασφαλείς και σχετικά αποτελεσματικές δεν εγγυόνται πλήρως ίαση ή αποφυγή επιπλοκών. Η μεθερπητική νευραλγία, το πλέον σύνηθες κατάλοιπο της νόσου, δύναται να συνοδεύσει τον ασθενή για μήνες ή και για χρόνια και να μειώσει σημαντικά την ποιότητα ζωής του. Επομένως, βάρος πρέπει να δοθεί στην πρόληψη της νόσου, η οποία μπορεί εύκολα και αποτελεσματικά να επιτευχθεί με τα διαθέσιμα εμβόλια κατά του VZV. Υπάρχουν δυο διαφορετικά εγκεκριμένα εμβόλια κατά του ιού του έρπητα ζωστήρα: το εμβόλιο που περιέχει ζωντανό εξασθενημένο ιό και το ανασυνδυασμένο εμβόλιο τα οποία έλαβαν έγκριση από τον ΕΜΑ το 2007 και 2018 αντίστοιχα. Τα δεδομένα από την μέχρι στιγμής χρήση τους αποδεικνύουν την αποτελεσματικότητα στην πρόληψη της νόσου και των επιπλοκών της, ενώ ταυτόχρονα επιβεβαιώνουν την ασφάλεια τους. Ο συγκεκριμένος εµβολιασµός έχει ενταχθεί στο Εθνικό Πρόγραµµα Εµβολιασµών και το εµβόλιο αποζημιώνεται πληρως για τα άτοµα ηλικίας 60 – 75 ετών. Η συστηματικότερη ενημέρωση του κοινού και του υγειονομικού προσωπικού κρίνεται απαραίτητη στην προσπάθεια ευαισθητοποίησης και εμβολιασμού των ευάλωτων ομάδων του πληθυσμού.
Herpes Zoster: Treatment and Prevention
Abstract
Herpes zoster (HZ) is an important cause of morbidity in people over 50 years old, as well as, in immunocompromised patients, which greatly reduces the quality of life and poses a burden to health systems worldwide. The defining symptoms of HZ and its characteristic manifestations facilitate its diagnosis, however, the available therapeutic options, although safe and relatively effective, do not guarantee a full recovery nor avoidance of complications. Postherpetic neuralgia, the most common complication of the disease, can accompany the patient for months or even years and thus significantly impair his quality of life. Therefore, emphasis should be placed on disease prevention, which can be easily and effectively achieved with the existing VZV vaccines. There are currently two vaccines commercially available: the vaccine containing the live attenuated virus and the recombinant vaccine which were approved by the EMA in 2007 and 2018 respectively. The data from their usage so far have proved their effectiveness in preventing the disease and its complications, while at the same time have confirmed their safety. VZV vaccination has been included in the Greek National Vaccination Program and the vaccine is fully reimbursed for people aged 60-75 years. Spreading this information to the public and to health workers is important and necessary in the effort to raise awareness and vaccination rates among vulnerable groups.
Επιδημιολογία / Παθοφυσιολογία
Ο ιός του έρπητα ζωστήρα (VZV-varicella zoster) ανήκει στην διευρυμένη οικογένεια των ερπητοιών, έχει νευροτρόπο και δερματοτρόπο δράση, και αποτελεί μια σημαντική αιτία νοσηρότητας για τα ανεπτυγμένα συστήματα υγείας ανά τον κόσμο. Σύμφωνα με τα νεότερα δεδομένα που αφορούν την επιδημιολογική εικόνα της νόσου του έρπητα ζωστήρα, η επίπτωση του στον γενικό πληθυσμό στην Ευρώπη είναι περίπου 7/1000. Η επίπτωση αυξάνει με την ηλικία, φθάνοντας μέχρι και τα 10.7 περιστατικά/1000 κατοίκους στην ηλικιακή ομάδα των μεγαλύτερων των 80 ετών και ακόμα δείχνει να είναι υψηλότερη στις γυναίκες. (7.65 περιστατικά ανά 1000 κατοίκους έναντι 5.55 για τους άνδρες)1. Σε παγκόσμια κλίμακα, τα 2/3 των περιπτώσεων έρπητα ζωστήρα παρατηρούνται σε άτομα άνω των 50 ετών. Περίπου το 1-4% των ασθενών έχει ανάγκη νοσηλείας εκ των οποίων το 30% είναι ανοσοκατεσταλμένοι ενώ η θνητότητα υπολογίζεται στο 0,04%2.
Η πρωτοπαθης λοίμωξη λαμβάνει χώρα συνήθως στην παιδική ηλικία με τη μορφή της ανεμευλογίας δίδοντας κυρίως δερματικά και γενικευμένα συστηματικά συμπτώματα. Σε χώρες όπου ο εμβολιασμός για την ανεμευλογιά δεν είναι διαδεδομένος περίπου το 90% των παιδιών προσβάλλεται από τον ιό πριν την ηλικία των 10 ετών3. Η μετάδοση πραγματοποιείται κατά βάση με επαφή/εισπνοή επιμολυσμένων σταγονιδίων, τα οποία μολύνουν αρχικά τα επιθηλιακά κύτταρα της άνω αναπνευστικής οδού και κατά συνέπεια βρίσκουν δίοδο για την συστηματική διασπορά τους4. Αφού παρέλθει η αρχική λοίμωξη, ο ιός του VZV παραμένει σε λανθάνουσα κατάσταση στα αισθητικά γάγγλια των κρανιακών νεύρων και της σπονδυλικής στήλης. Η γαγγλιακή αυτή προσβολή αποτελεί την αιτία των αισθητηριακών διαταραχών, συμπεριλαμβανομένου της μεθερπητικής νευραλγίας, που σχετίζονται με επανενεργοποίηση της λανθάνουσας μορφής του ιού, η οποία με τη σειρά της οδηγεί στην εκδήλωση της κλινικού συνδρόμου του έρπητα ζωστήρα. Στις περιπτώσεις αυτές, τα ιικά σωματίδια μεταναστεύουν από τα γάγγλια και ακολουθώντας την πορεία του νεύρου, μεταφέρονται κατά μήκος των νευραξόνων, στο αντίστοιχο δερμοτόμιο, οπού πολλαπλασιάζονται στα επιθηλιακά κύτταρα του δέρματος δίνοντας την χαρακτηριστική κλινική εικόνα του έρπητα ζωστήρα.
Οι αναζωπυρώσεις αυτές δύναται να συμβούν σε καταστάσεις ανοσοκαταστολής5. Συγκεκριμένα, ασθενείς με επηρεασμένη κυτταρική ανοσία διατρέχουν αυξημένο κίνδυνο επανενεργοποίησης του ιού6. Η κατηγορία αυτή περιλαμβάνει τους ηλικιωμένους, όλους τους μεταμοσχευμένους (με μυελό των οστών ή άλλα συμπαγή όργανα), ασθενείς με αιματολογικές κακοήθειες καθώς και χημειοθεραπευόμενους, ανθρώπους που ζουν με HIV καθώς και ασθενείς με αυτοάνοσες παθήσεις υπό ανοσοκατασταλτική αγωγή, π.χ. φλεγμονώδεις νόσους εντέρου και σκλήρυνση κατά πλάκας. Ενδεικτικά, η επίπτωση του έρπητα ζωστήρα εκτιμάται στο 40% κατά το πρώτο έτος μετά από μεταμόσχευση καρδιάς, ενώ η συνολική επίπτωση φθάνει το 9,1% (95% CI:7.6%-10.8%) σε όλους τους μεταμοσχευμένους με συμπαγή όργανα7. Όσον αφορά την λοίμωξη με τον ιό του HIV, η συνολική επίπτωση αγγίζει το 2.3% (95% CI:1.56%–3.05%) σε ασθενείς που ακολουθούν αντιρετροική θεραπεία8, ενώ η παρουσία της νόσου αποτελεί μία από τις συνήθης πρώτές εκδηλώσεις της νόσου, υποδηλώνοντας πρωτολοίμωξη και ορομετατροπή9. Πλέον συνηθισμένη και άξια αναφοράς είναι και η εκδήλωση της νόσου σε ασθενείς που λαμβάνουν ανοσοκατασταλτική θεραπεία για την ρευματοειδή αρθρίτιδα με τον κίνδυνο νόσησης να είναι μεγαλύτερος για όσους λαμβάνουν τριπλό σχήμα κυρίως συνδυασμου ανοσοτροποποιητικών φαρμάκων10. Οι νεότερες θεραπείες με αναστολείς JAK κινασών σχετίζονται επίσης με αυξημένη επίπτωση έρπητα ζωστήρα11, ωστόσο η συνέχιση τους ύστερα από θεραπεία της επανενεργοποίησης φαίνεται να είναι σχετικά ασφαλής12. Εκτιμάται πως το 20-30% των ατόμων με HIV θα εμφανίσουν την λοίμωξη από τον ιό κάποια στιγμή στην ζωή τους ενώ το 50% των ατόμων άνω 85 χρονών έχουν περάσει τουλάχιστον ένα επεισόδιο έρπητα ζωστήρα13.
Κλινική Εικόνα / Διάγνωση
Η χαρακτηριστική κλινική εικόνα λοίμωξης από τον ιό του έρπητα ζωστήρα περιλαμβάνει αρχικά κεφαλαλγία, κακουχία και ίσως πυρετό. Έπεται η εμφάνιση κνησμού και πόνου στις προσβεβλημένες περιοχές του δέρματος, ενώ η εμφάνιση φλυκταινώδους εξανθήματος παρατηρείται μετά από 3-6 ημέρες. Ασθενείς ηλικίας άνω των 50 ετών που θα προσβληθούν από τον ιό, θα αναπτύξουν χρόνιο πόνο – μεθερπητική νευραλγίαν- σε ποσοστό της τάξης του 10-20%14, που ορίζεται ως πόνος διάρκειας μεγαλύτερης των 3 μηνών που έπονται της εκδήλωσης του εξανθήματος. Νεότερες επιδημιολογικές μελέτες ανεβάζουν την επίπτωση της επιπλοκής σε ποσοστά κοντά στο 30%15, επομένως γίνεται κατανοητή η σημασία της στην κλινική πορεία της νόσου. Ο κίνδυνος εκδήλωσης, επίσης, δείχνει να αυξάνεται με την ηλικία14,15. Η μεθερπητική νευραλγία μπορεί να διαρκέσει από μήνες έως και χρόνια και πρόκειται για μια δύσκολά αντιμετωπίσιμη κλινική οντότητα, η οποία είναι σημαντικό να διαχωριστεί και να διακριθεί κλινικά από τον πόνο που οφείλεται σε τοπική βλάβη του δέρματος. Το νευροπαθητικό άλγος οφείλεται εξ’ ορισμού σε φλεγμονή των αισθητικών νεύρων και περιλαμβάνει σημεία όπως είναι ο πρόδρομος πόνος και το αίσθημα καύσους στην περιοχή κατανομής της βλάβης. Χαρακτηριστικές είναι ακόμη η απτική αλλοδυνία και οι παραισθησίες στα προσβεβλημένα αλλά και στα παρακείμενα δερμοτόμια.
Άλλοι τύποι λοίμωξης από τον ιό, αποτελούν η οφθαλμική μορφή της νόσου, η οποία οφείλεται σε προσβολή του τρίδυμου νεύρου (V) και επέκταση της οποίας στον αμφιβληστροειδή χιτώνα ενδεχομένως να οδηγήσει σε παροδική απώλεια όρασης καθώς και ο ωτικός έρπητας ζωστήρας, ο οποίος εκδηλώνεται με το σύνδρομο Ramsey-Hunt που σχετίζεται με παράλυση του προσωπικού νεύρου (VII) και των επιμέρους κλάδων του. Σπανίως ακόμα, ο ιός δύναται να εξαπλωθεί στο κεντρικό νευρικό σύστημα (ΚΝΣ) προκαλώντας μηνιγγίτιδα ή μηνιγγοεγκεφαλίτιδα με ή χωρίς την συνοδεία εξανθήματος. Μία ιδιαίτερα σπάνια επιπλοκή της λοίμωξης είναι η προσβολή των αγγείων του ΚΝΣ που μπορεί να οδηγήσει σε εγκεφαλικό ισχαιμικό επεισόδιο. Χαρακτηριστικά αξίζει να αναφερθεί πως στους ενήλικες, μετά από λοίμωξη με έρπητα ζωστήρα, ο κίνδυνος εμφράκτου αυξάνεται κατά 30% ετησίως16.
Γίνεται αντιληπτό πως λόγω της χαρακτηριστικής κλινικής εικόνας και την χαρακτηριστική κατανομή των βλαβών στο δέρμα, η διάγνωση του έρπητα ζωστήρα είναι κατά βάση κλινική και δεν απαιτεί εργαστηριακή επιβεβαίωση. Βέβαια, διάχυτη προσβολή πολλαπλών δερμοτομίων καθώς και οργάνων δύναται να συμβεί, ιδίως σε περιπτώσεις βαθιάς ανοσοκαταστολής, ωστόσο κάτι τέτοιο είναι αρκετά σπάνιο. Αν υπάρχει αμφιβολία, η λήψη δείγματος από τις δερματικές βλάβες μπορεί να αναλυθεί μέσω αλυσιδωτής αντίδρασης πολυμεράσης (PCR) και να αναδείξει το DNA του ιού ώστε να επιβεβαιωθεί η λοίμωξη.
Θεραπεία / Αντιμετώπιση
H θεραπεία έναντι της λοίμωξης από VZV στηρίζεται στην αντιική αγωγή για την ταχύτερη αντιμετώπιση του ιού και την πρόληψη των επιπλοκων, στα κορτικοστεροειδή για την περίπτωση του Ramsey-Hunt και των αγγειιτίδων και φυσικά στη διαχείριση του άλγους προκαλούμενο από τη μεθερπητική νευραλγία.
Έναρξη συστηματικής αντιικής αγωγή συνιστάται σε άτομα άνω των 50 ετών και σε ανοσοκατεσταλμένους ασθενείς καθώς και στις πιο περίπλοκες νευρολογικές μορφές της νόσου, όπως σε άτομα με οφθαλμικό έρπητα ή Ramsey-Hunt. Ιδανικά, η αντιική αγωγή πρέπει να χορηγείται εντός 72 ωρών από την εμφάνιση του εξανθήματος.Τα αντιικά τα οποία χρησιμοποιούνται ανήκουν στην κατηγορία των νουκλεοσιδίκών αναλόγων και είναι η ακικλοβίρη, η βαλασικλοβίρη και η φαμσικλοβίρη. Η φαμσικλοβίρη φαίνεται να υπερτερεί της ακικλοβίρης όσον αφορά τη μείωση του άλγους. Επίσης, έχει το πλεονέκτημα της μικρότερης συχνότητας δοσολογίας σε από του στόματος χορήγηση. Η ακικλοβίρη ωστόσο είναι η μόνη που διατίθεται για παρεντερική χορήγηση. Η χορήγηση ενδοφλέβιας ακικλοβίρης θα πρέπει να αποφεύγεται σε ασθενείς με νεφρική νόσο. Οι κατευθυντήριες οδηγίες στη χώρα μας αναφέρουν ότι η ενδεδειγμένη δοσολογία ακικλοβίρης είναι ίση με 5-10 mg/kg, τρεις φορές την ημέρα, για 7-14 ημέρες.
Όσον αφορά την αναλγησία σε περίπτωση μεθερπητικής νευραλγίας, αυτή συμπεριλαμβάνει τη χρήση αντιεπιληπτικών, όπως είναι η γκαμπαπεντίνη ή η πρεγκαμπαλίνη και τρικυκλικών αντικαταθλιπτικών είτε κατά την οξεία φάση είτε για χρόνια χρήση σε περίπτωση παραμονής των συμπτωμάτων. Η τοπική εφαρμογή επιθεμάτων καψαϊκίνης είναι επίσης συνήθης τακτική αντιμετώπισης της καυσαλγίας. Τα ΜΣΑΦ δεν δείχνουν να έχουν θέση στη αντιμετώπιση του νευροπαθητικού άλγους17.
Πρόληψη / Εμβολιασμός
Η πρόληψη έναντι του έρπητα ζωστήρα βασίζεται στον εμβολιασμό του γενικού πληθυσμού και στην προφύλαξη της ομάδας ατόμων που εκτέθηκαν στον ιό και δεν έχουν εμβολιαστική κάλυψη.
O εμβολιασμός έναντι του VZV ξεκινά από την παιδική ηλικία με τον εμβολιασμό των παιδιών σε ηλικία μεγαλύτερη του ενός έτους. Τα διαθέσιμα εμβόλια έναντι του VZV είναι είτε το αυτοτελές εμβόλιο έναντι του VZV είτε σε συνδυασμό με το εμβόλιο MMR (MMRV). Αποτελούνται από ζώντες εξασθενημένους ιούς και χορηγούνται σε παιδιά 12-15 μηνών η πρώτη δόση και σε ηλικία 4-6 ετών η δεύτερη. Υπάρχουν δεδομένα σύμφωνα με τα οποία το MMRV συσχετίζεται με αυξημένη πιθανότητα εμφάνισης πυρετικών σπασμών σε σχέση με τη χορήγηση του συνδυασμού MMR και V και για το λόγο αυτό καλό είναι να μην χορηγείται σε παιδιά με ιστορικό πυρετικών σπασμών , εντούτοις όταν χορηγείται σε παιδιά 4-6 ετών δεν φαίνεται να αυξάνει την πιθανότητα εμφάνισης πυρετικών σπασμών και υπερτερεί σε σχέση με το συνδυασμό όταν η πρώτη δόση χορηγείται σε ηλικία 48 μηνών και άνω. Ο εμβολιασμός των ενηλίκων και των παιδιών ηλικίας άνω των 13 ετών που δεν έχουν ανοσία συνίσταται σε 2 δόσεις με μεσοδιάστημα 4-8 εβδομάδων. Στην ομάδα εκείνη του πληθυσμού που έλαβε μια μόνο δόση συστήνεται μια επαναληπτική – catch up – δόση με μεσοδιάστημα 3 μηνών σε παιδιά <13 ετών και 4 εβδομάδων σε παιδιά>13 ετών όταν η 2η δόση χορηγείται σε ηλικία μεγαλύτερη από 7 ετών.
Υπάρχουν δυο διαφορετικά εγκεκριμένα εμβόλια κατά του ιού του έρπητα ζωστήρα: το εμβόλιο που περιέχει ζωντανό εξασθενημένο ιό και το ανασυνδυασμένο εμβόλιο τα οποία εγκρίθηκαν από τον ΕΜΑ το 2007 και 2018 αντίστοιχα.
Έως και το 2018 το Varicella-Zoster-Live (ZLV, Zostavax) αποτελούσε το μοναδικό διαθέσιμο εμβόλιο για τον εμβολιασμό του ενήλικου πληθυσμού. Αποτελείται από ζώντες εξασθενημένους ιούς σε συγκέντρωση έως και 16 φορές μεγαλύτερη από το παιδικό εμβόλιο έναντι της ανεμευλογιάς και χορηγείται ενδομυικά ή και υποδόρια με 1 άπαξ δόση. Σε ηλικία>60 ετών, η χορήγηση του συγκεκριμένου σκευάσματος φαίνεται ότι μειώνει την πιθανότητα λοίμωξης από έρπητα ζωστήρα σε ποσοστό 51% και της εμφάνισης μεθερπητικής νευραλγίας σε ποσοστό 66.5%18. Η αποτελεσματικότητά του μειώνεται σημαντικά σε διάστημα 3 ετών ή όταν χορηγείται σε ηλικία>70 ετών19, ενώ η αναγκαιότητα χορήγησης ενισχυτικής δόσης δεν έχει αποσαφηνιστεί πλήρως. Επαναληπτικός εμβολιασμός 10 έτη μετά την πρώτη δόση είναι πλήρως ασφαλής και δύναται να ενισχύσει την εξειδικευμένη ανοσία. Αντενδείκνυται η χορήγησή του σε άτομα σε ανοσοκαταστολή καθώς και στην κύηση. Τοπικές αντιδράσεις στο σημείο της έγχυσης είναι συνηθισμένες και φθάνουν έως και το 74%, ωστόσο σοβαρότερες ανεπιθύμητες ενέργειες δεν έχουν καταγραφεί με αυξημένη συχνότητα ύστερα από τον εμβολιασμό20.
Το 2017 ο FDA ενέκρινε το ανασυνδυασμένο εμβόλιο RZV (Shingrix) το οποίο εμπεριέχει την ανοσογόνο γλυκοπρωτείνη Ε του ιού σε συνδυασμό με τον παράγοντα ενίσχυσης- adjuvant AS01B που προάγει την διαμεσολαβούμενη από CD4 λεμφοκύτταρα ανοσολογική απόκριση έναντι του ιού(2). Χορηγείται σε δύο δόσεις με μεσοδιάστημα 2-6 μηνών μεταξύ των δόσεων. Σύμφωνα με τα στοιχεία που υπάρχουν από τυχαιοποιημένες μελέτες μέχρι στιγμής, η αποτελεσματικότητα του εμβολίου στην πρόληψη της λοίμωξης ανέρχεται περί το 90-95% ανεξαρτήτως ηλικίας και στο 91% για την πρόληψη της μεθερπητικής νευραλγίας21. Σε άτομα άνω των 60 ετών που έχουν εμβολιαστεί και με τις 2 δόσεις του εμβολίου η ανοσία διατηρείται εώς και για 9 έτη22. Η αναγκαιότητα για επανεμβολιασμό δεν έχει διευκρινιστεί. Το ανασυνδυασμένο εμβόλιο μπορεί να χορηγηθεί σε προηγουμένως εμβολιασμένα με το ζωντανό εξασθενημένο στέλεχος άτομα αφού παρέλθουν 2 μήνες. Τοπική αντίδραση στο σημείο της έγχυσης παρατηρείται στο 74% και συστηματικές εκδηλώσεις, όπως μυαλγίες και κεφαλαλγία ανέρχονται στο 53% σε άτομα άνω των 7021. Ακόμη, μία πρόσφατη μετανάλυση της ίδιας μελέτης, κατέδειξε την ασφάλεια του εμβολιασμού με το ανασυνδυασμένο εμβόλιο και για τις ομάδες πληθυσμού με χρόνιες νόσους διαμεσολαβούμενες με ανοσολογικό μηχανισμό, όπως ρευματοειδή αρθρίτιδα, ψωρίαση και αγκυλοποιητική σπονδυλίτιδα23.
Η χορήγησή του ανασυνδυασμένου εμβολίου ενδείκνυται σε άτομα ηλικίας>50 ετών καθώς και σε ανοσοκατασταλμένα άτομα ηλικίας> 19 ετών, σε αντίθεση με το VZL εμβόλιο. Συγκεκριμένα, το εμβόλιο είναι ανοσογόνο σε ανθρώπους που ζουν με HIV και έχουν σύνολο CD4+ περί τα 200-500 κυτ./μl, καθώς και σε ασθενείς με μόσχευμα νεφρού, με αιματολογικές κακοήθειες και σε καρκινοπαθείς υπό χημειοθεραπεία. Μάλιστα, έχει αποδειχθεί πως ο εμβολιασμός ενηλίκων που έχουν υποβληθεί σε αυτόλογη μεταμόσχευση μυελού των οστών, η πλέον ευάλωτη κατηγορία ανοσοκατασταλμένων ασθενών, ελαττώνει τον κίνδυνο προσβολής από VZV και την επακόλουθη νευραλγίας κατά 68% και 90% αντίστοιχα σε διάστημα παρακολούθησης 21 μηνών μετά τη μεταμόσχευση24. Το ανασυνδυασμένο εμβόλιο δεν ενδείκνυται για την πρόληψη της ανεμευλογιάς, ενώ δεν υπάρχουν αρκετά δεδομένα που να καθιστούν ασφαλή τη χορήγηση του RΖV σε κύηση.
Συνολικά, η χορήγηση του εμβολίου έναντι του VZV με οποιοδήποτε σκεύασμα αντενδείκνυται πλήρως μόνο στις εξής περιπτώσεις: σε άτομα με ιστορικό αναφυλακτικής αντίδρασης σε κάποιο από τα συστατικά του εμβολίου, σε ασθενείς με σοβαρή ενεργό μορφή της νόσου και στην κύηση.
Αν και δεν υπάρχουν μελέτες που να συγκρίνουν τα δύο εμβόλια άμεσα μεταξύ τους, τα μέχρι στιγμής δεδομένα είναι σαφώς υπέρ του ανασυνδυασμένου εμβολίου, το οποίο και προτιμάται από τις διεθνείς κατευθυντήριες οδηγίες εμβολιασμού καθώς παρέχει υψηλή προστασία (>90%) ανεξαρτήτως ηλικίας για πάνω από 9 έτη ενώ είναι ασφαλές και αποτελεσματικό και στους ανοσοκατεσταλμένους. Από την άλλη πλευρά, το ZVL, το εμβόλιο που περιέχει το εξασθενημένο στέλεχος του ιού, παρέχει μόνο μέτρια και ηλικιακά εξαρτώμενη προστασία, η οποία μάλιστα φθίνει σε διάστημα μετά τα 5 έτη, ενώ παράλληλα αντενδείκνυται σε ανοσοκατεσταλμένους ασθενείς. Για να γίνει ακόμα πιο ξεκάθαρο, έχει υπολογιστεί πως ο αριθμός των ατόμων που πρέπει να εμβολιαστούν προκειμένου να προληφθεί 1 νόσηση από έρπητα ζωστήρα είναι 8-11 για την ανασυνδυασμένη μορφή του εμβολίου και 20-50 για το ζωντανό εξασθενημένο στέλεχος. Για την μεθερπητική νευραλγία οι αριθμοί ανέρχονται σε 39-53 και 94-198 αντίστοιχα25. Συμπερασματικά, όλα τα παραπάνω καθιστούν το μαζικό εμβολιασμό με RZV πιο οικονομικά ωφέλιμο.
Σε περίπτωση που ένα άτομο εκτίθεται στον VZV και δεν έχει προηγηθεί εμβολιασμός ή θεωρείται ότι δεν έχει ανοσία, συνιστάται η χορήγηση του εμβολίου (ιδανικά εντός διαστήματος 3-5 ημερών από την έκθεση) ή σε περίπτωση που αντενδείκνυται ο εμβολιασμός, η χορήγηση ειδικής για τον VZV ανοσοσφαιρίνης (VariZIG) όσο το δυνατόν συντομότερα (σε διάστημα μικρότερο των 10 ημερών από την έκθεση) σε δοσολογία 125IU/10Kg με μέγιστη δόση 625IU.(26) Εάν χορηγηθεί ανοσοσφαιρίνη τότε ο εμβολιασμός για το VZV πραγματοποιείται τουλάχιστον 5 μήνες αργότερα. Σε περίπτωση που συνεχίζεται η έκθεση συστήνεται μια επαναληπτική δόση σφαιρίνης σε διάστημα 3 εβδομάδων από την πρώτη δόση. Εναλλακτικά από το εμβόλιο μπορεί να χορηγηθεί προληπτικά ακυκλοβίρη (40-80mg/kg) για 5 ημέρες.
Συμπεράσματα
Καταληκτικά, ο έρπης ζωστήρας αποτελεί σημαντική αιτία νοσηρότητας σε άτομα άνω των 50 ετών καθώς και σε ανοσοκατεσταλμένους, που μειώνει την ποιότητα ζωής τους και ταυτόχρονα επιβαρύνει τα συστήματα υγείας. Οι θεραπευτικές επιλογές που έχουμε στη φαρέτρα μας αν και σχετικά αποτελεσματικές και ασφαλείς δεν αποκλείουν την πιθανότητα σοβαρών επιπλοκών από τη νόσηση, όπως της μεθερπητικής νευραλγίας, η οποία συνιστά χρόνιο και μείζον πρόβλημα υγείας. Αρκετές χώρες στην Ευρώπη, συμπεριλαμβανομένης της Ελλάδας, προάγουν και συνιστούν προγράμματα εμβολιασμού για τους ηλικιωμένους έναντι του ιού του έρπητα ζωστήρα. Στη χώρα µας ο συγκεκριμένος εµβολιασµός έχει ενταχθεί στο Εθνικό Πρόγραµµα Εµβολιασµών του Υπουργείου Υγείας και το εµβόλιο χορηγείται δωρεάν στα άτοµα ηλικίας 60 – 75 ετών, ανεξαρτήτως αν έχει προηγηθεί επεισόδιο έρπητα ζωστήρα. (Εθνικό Πρόγραµµα Εμβολιασμών Ενηλίκων 2020-2021) Ο εμβολιασμός των ευάλωτων ομάδων συνιστά ένα ασφαλές και αποτελεσματικό μέτρο για τον περιορισμό της προσβολής από τον ιό του έρπητα ζωστήρα. Για το λόγο αυτό απαιτείται συστηματική ενημέρωση τόσο στους επαγγελματίες υγείας όσο και στις ευάλωτες ομάδες ατόμων σχετικά με την ωφελιμότητα του εμβολιασμού.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Curran D, Callegaro A, Fahrbach K, et al. Meta-Regression of Herpes Zoster Incidence Worldwide. Infectious Diseases and Therapy. 2022; 11: 389-403.
- Lecrenier N, Beukelaers P, Colindres R, et al. Development of adjuvanted recombinant zoster vaccine and its implications for shingles prevention. Expert review of vaccines. 2018; 17: 619-634.
- Oxman MN. Zoster vaccine: current status and future prospects. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2010; 51: 197-213.
- Zerboni L, Sen N, Oliver SL, Arvin AM. Molecular mechanisms of varicella zoster virus pathogenesis. Nature Reviews Microbiology. 2014; 12: 197-210.
- Kawai K, Yawn BP. Risk Factors for Herpes Zoster: A Systematic Review and Meta-analysis. Mayo Clinic proceedings. 2017; 92: 1806-1821.
- Gershon AA, Steinberg SP. Cellular and humoral immune responses to varicella-zoster virus in immunocompromised patients during and after varicella-zoster infections. Infection and immunity. 1979; 25: 170-174.
- Kwon DE, Lee HS, Lee KH, et al. Incidence of herpes zoster in adult solid organ transplant recipients: A meta-analysis and comprehensive review. Transplant infectious disease : an official journal of the Transplantation Society. 2021; 23: e13674.
- Ku HC, Tsai YT, Konara-Mudiyanselage SP, et al. Incidence of Herpes Zoster in HIV-Infected Patients Undergoing Antiretroviral Therapy: A Systematic Review and Meta-analysis. Journal of clinical medicine. 2021; 10: 2300.
- Sullivan AK, Raben D, Reekie J, et al. Feasibility and Effectiveness of Indicator Condition-Guided Testing for HIV: Results from HIDES I (HIV Indicator Diseases across Europe Study). PLOS ONE. 2013; 8: e52845.
- Redeker I, Albrecht K, Kekow J, et al. Risk of herpes zoster (shingles) in patients with rheumatoid arthritis under biologic, targeted synthetic and conventional synthetic DMARD treatment: data from the German RABBIT register. Annals of the Rheumatic Diseases. 2022; 81: 41.
- Winthrop KL, Nash P, Yamaoka K, et al. Incidence and risk factors for herpes zoster in patients with rheumatoid arthritis receiving upadacitinib: a pooled analysis of six phase III clinical trials. Annals of the Rheumatic Diseases. 2022; 81: 206.
- Choi W, Ahn SM, Kim Y-G, et al. Safety of JAK inhibitor use in patients with rheumatoid arthritis who developed herpes zoster after receiving JAK inhibitors. Clinical Rheumatology. 2022; 41: 1659-1663.
- Pinchinat S, Cebrián-Cuenca AM, Bricout H, Johnson RW. Similar herpes zoster incidence across Europe: results from a systematic literature review. BMC Infect Dis. 2013; 13: 170.
- Opstelten W, Mauritz JW, de Wit NJ, et al. Herpes zoster and postherpetic neuralgia: incidence and risk indicators using a general practice research database. Family Practice. 2002; 19: 471-475.
- Yang F, Yu S, Fan B, et al. The Epidemiology of Herpes Zoster and Postherpetic Neuralgia in China: Results from a Cross-Sectional Study. Pain and therapy. 2019; 8: 249-259.
- Gershon AA, Breuer J, Cohen JI, et al. Varicella zoster virus infection. Nature Reviews Disease Primers. 2015; 1: 15016.
- Moore RA, Chi CC, Wiffen PJ, et al. Oral nonsteroidal anti-inflammatory drugs for neuropathic pain. The Cochrane database of systematic reviews. 2015; 2015: Cd010902.
- Oxman MN, Levin MJ, Johnson GR, et al. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. The New England journal of medicine. 2005; 352: 2271-2284.
- Schmader KE, Oxman MN, Levin MJ, et al. Persistence of the efficacy of zoster vaccine in the shingles prevention study and the short-term persistence substudy. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America. 2012; 55: 1320-1328.
- Gabutti G, Valente N, Sulcaj N, Stefanati A. Evaluation of efficacy and effectiveness of live attenuated zoster vaccine. Journal of preventive medicine and hygiene. 2014; 55: 130-136.
- Cunningham AL, Lal H, Kovac M, et al. Efficacy of the Herpes Zoster Subunit Vaccine in Adults 70 Years of Age or Older. New England Journal of Medicine. 2016; 375: 1019-1032.
- Schwarz TF, Volpe S, Catteau G, et al. Persistence of immune response to an adjuvanted varicella-zoster virus subunit vaccine for up to year nine in older adults. Human vaccines & immunotherapeutics. 2018; 14: 1370-1377.
- Dagnew AF, Rausch D, Hervé C, et al. Efficacy and serious adverse events profile of the adjuvanted recombinant zoster vaccine in adults with pre-existing potential immune-mediated diseases: a pooled post hoc analysis on two parallel randomized trials. Rheumatology (Oxford, England). 2021; 60: 1226-1233.
- Bastidas A, de la Serna J, El Idrissi M, et al. Effect of Recombinant Zoster Vaccine on Incidence of Herpes Zoster After Autologous Stem Cell Transplantation: A Randomized Clinical Trial. Jama. 2019; 322: 123-133.
- Curran D, Van Oorschot D, Varghese L, et al. Assessment of the potential public health impact of Herpes Zoster vaccination in Germany. Human vaccines & immunotherapeutics. 2017; 13: 2213-2221.
- Lachiewicz AM, Srinivas ML. Varicella-zoster virus post-exposure management and prophylaxis: A review. Preventive medicine reports. 2019; 16: 101016.
CMJ 2022; 5: 287-293