Περίληψη
Η διαδερμική οστεοπλαστική της σπονδυλικής στήλης περιλαμβάνει διαδερμικές επεμβάσεις όπως η σπονδυλοπλαστική, η κυφοπλαστική και η οστεοπλαστική του ιερού οστού και της λεκάνης. Η οστική ενίσχυση με ακρυλικό τσιμέντο στοχεύει στη θεραπεία ή πρόληψη παθολογικών καταγμάτων των σπονδύλων και της λεκάνης και στην ανακούφιση από το άλγος σε ασθενείς με οστεοπόρωση και οστικές μεταστάσεις. Οι συγγραφείς περιγράφουν τις αποδεκτές και νεότερες ενδείξεις για την επιλογή ασθενών και παρουσιάζουν τις βασικές αρχές της απεικονιστικά κατευθυνόμενης προσπέλασης των αλλοιώσεων για την έγχυση τσιμέντου. Οι ιατροί θα πρέπει να αξιολογούν προσεκτικά κάθε ασθενή και να έχουν ενδελεχή γνώση της ανατομίας, της τεχνικής, των αναμενόμενων αποτελεσμάτων και των πιθανών επιπλοκών. Συνιστάται η λεπτομερής συγκατάθεση και η διεπιστημονική λήψη αποφάσεων. Η κατανόηση των ιδιαίτερων πλεονεκτημάτων και περιορισμών των διαφόρων σύγχρονων υλικών πλήρωσης είναι επίσης κρίσιμη για μια επιτυχημένη και απλή διαδικασία. Οι μελλοντικές εξελίξεις περιλαμβάνουν νέες μηχανικές συσκευές για την αποτελεσματική αποκατάσταση του σπονδυλικού ύψους, καθώς και την εισαγωγή οστεοεπαγωγικών τσιμέντων που θα είναι σε θέση να προάγουν την φυσιολογική επούλωση των οστών.
ΛΕΞΕΙΣ – ΚΛΕΙΔΙΑ: Οστεοπόρωση, οστική μετάσταση, οστεοπλαστική, σπονδυλοπλαστική, κυφοπλαστική
Εισαγωγή
Στη σύγχρονη πρακτική η διαδερμική σπονδυλοπλαστική και οστεοπλαστική αναφέρεται στη διαδερμική εφαρμογή ακρυλικού τσιμέντου για τη σταθεροποίηση της σπονδυλικής στήλης, της λεκάνης και του σκελετικού συστήματος των άκρων, όπου ο όρος τσιμέντο χρησιμοποιείται για να περιγράψει μια μεγάλη ποικιλία παχύρρευστων υλικών που εγχέονται για τη σταθεροποίηση επώδυνων οστεολυτικών βλαβών. Η οστεοπλαστική χρησιμοποιείται ευρέως και περιλαμβάνει διαδικασίες όπως η σπονδυλοπλαστική, η κυφοπλαστική, η οστεοπλαστική και η ιεροπλαστική.1–3 Η πλήρωση των οστών με τσιμέντο στοχεύει στη θεραπεία ή πρόληψη παθολογικών καταγμάτων και άλγους σε ασθενείς με σπονδυλικές και εξωσπονδυλικές οστεολυτικές βλάβες.4 Η διαδερμική σπονδυλοπλαστική, η οποία περιεγράφηκε αρχικά στα τέλη της δεκαετίας του 1980 από τον Galibert και συνεργάτες για τη θεραπεία ενός επώδυνου, επιθετικού σπονδυλικού αιμαγγειώματος5, σηματοδότησε τη γέννηση των διαδικασιών διαδερμικής ενίσχυσης των σπονδύλων και έχει φέρει επανάσταση στον τομέα των επεμβάσεων σπονδυλοπλαστικής έκτοτε. Η σπονδυλοπλαστική γενικά περιλαμβάνει την απεικονιστικά κατευθυνόμενη έγχυση ακτινοσκιερού μεθακρυλικού τσιμέντου για τη σταθεροποίηση επώδυνων οστεοπορωτικών ή κακοήθων συμπιεστικών καταγμάτων και επιθετικών σπονδυλικών αιμαγγειωμάτων.1–4,6–8 Η διαδικασία εκτελείται από καλά εκπαιδευμένους και έμπειρους ιατρούς, συμπεριλαμβανομένων επεμβατικών ακτινολόγων, ορθοπεδικών και νευροχειρουργών. Η ανασκόπηση του παρόντος άρθρου περιγράφει τις αποδεκτές και νεότερες ενδείξεις για τη διαδικασία, παρουσιάζει τις βασικές αρχές της τεχνικής, αναφέρει τα αναμενόμενα αποτελέσματα και εξετάζει κριτικά τους διάφορους τύπους τσιμέντου που διατίθενται στην αγορά, δίνοντας έμφαση στις λεπτομέρειες και τις τεχνικές πτυχές μιας ασφαλούς και επιτυχημένης διαδικασίας σπονδυλοπλαστικής. 2,9
Επιλογή Ασθενούς
Τα μη τραυματικά συμπιεστικά σπονδυλικά κατάγματα, που ορίζονται ως μείωση του ύψους του μεμονωμένου σπονδυλικού σώματος κατά 20% ή 4mm,10 προκαλούνται από οστεοπόρωση ή διάφορες κακοήθεις αιτιολογίες και προκαλούν έντονο πόνο στη ράχη με καταστροφικές επιπτώσεις στη γενική ποιότητα ζωής του ασθενούς.11 Υπολογίζεται ότι η οστεοπόρωση επηρεάζει περισσότερους από 10 εκατομμύρια ανθρώπους και αφορά περισσότερα από 700.000 συμπιεστικά κατάγματα σπονδύλων μόνο στις Ηνωμένες Πολιτείες. Σημειώνεται ότι η συμπίεση των θωρακικών και οσφυϊκών σπονδύλων έχει ως αποτέλεσμα κυφωτικές παραμορφώσεις της σπονδυλικής στήλης και σχετίζεται με σημαντικό πρόσθετο κίνδυνο θνησιμότητας σε σύγκριση με τους μάρτυρες παρόμοιας ηλικίας, λόγω της μειωμένης πνευμονικής λειτουργίας.1,13
Αποδεκτές ενδείξεις διαδερμικής οστεοπλαστικής ή σπονδυλοπλαστικής είναι τα επώδυνα σπονδυλικά κατάγματα ανθεκτικά στη συντηρητική ιατρική θεραπεία για τουλάχιστον 4 εβδομάδες.1,3,4,6,8 Σε περίπτωση οστεοπόρωσης, υπερβολικές δόσεις οπιούχων ή ανεπαρκής διαχείριση του πόνου μετά από περίοδο τουλάχιστον 4 εβδομάδων με τακτικά αναλγητικά είναι απαραίτητη προϋπόθεση.14 Σε περίπτωση κακοήθειας, μπορούν να αντιμετωπιστούν επώδυνες οστεολυτικές αλλοιώσεις μεταστατικού πολλαπλού μυελώματος ή λεμφώματος, παράλληλα με το κατάλληλο πρωτόκολλο ογκολογικής θεραπείας.4,9,15,16 Επώδυνες μεταστατικές βλάβες του ιερού οστού, κοτύλης, ηβικών οστών και μηριαίου οστού είναι επίσης ενδείξεις για διαδερμική οστεοπλαστική για την ενίσχυση των οστών που ΄δεχονται αξονικές φορτίσεις. Ασθενείς με επιθετικά σπονδυλικά αιμαγγειώματα και γιγαντοκυτταρικούς όγκους είναι επίσης υποψήφιοι για τη διαδικασία επίτευξης αποαγγείωσης του όγκου και ανακούφισης από τον πόνο.20,21 Σε δύσκολες περιπτώσεις με επισκληρίδιο εξάπλωση ή/και συμπίεση της σπονδυλικής στήλης, η οστεοπλαστική με συμπληρωματική σκληροθεραπεία μπορεί να εφαρμοστεί μόνη ή προεγχειρητικώς.20,22
Άλλες προτεινόμενες ενδείξεις για διαδερμική οστεοπλαστική της σπονδυλικής στήλης περιλαμβάνουν την οστεονέκρωση (νόσος Kummell), ψευδάρθρωση της σπονδυλικής στήλης, φαινόμενα ενδοσπονδυλικού κενού, ιστιοκυττάρωση κυττάρων Langerhans, ατελής οστεογένεση, νόσος του Paget, επώδυνοι όζοι Schmorl, προεγχειρητική ενίσχυση του σπονδυλικού σώματος, μη επουλωμένα χρόνια τραυματικά κατάγματα, καθώς και πρόσφατα εκρηκτικά κατάγματα.1,9,23-29 Η επιτυχής συντηρητική θεραπεία, οι μη διορθώσιμες διαταραχές πήξης, η τοπική λοίμωξη και οι εκτεταμένες οστικές μεταστάσεις είναι σαφείς αντενδείξεις της τεχνικής.1,4 Η διαδικασία μπορεί να εκτελεστεί με μεγάλη προσοχή σε περίπτωση οστεόλυσης ή κατάγματος της οπίσθιας σπονδυλικής στήλης και εάν ο όγκος εκτείνεται στον σπονδυλικό σωλήνα, λόγω σημαντικά υψηλότερου κινδύνου επιπλοκών.2,3 Απαιτείται λεπτομερές ιατρικό ιστορικό και κατάλληλη φυσική εξέταση για τον αποκλεισμό εκφυλιστικών αιτιών άλγους στην πλάτη και ριζοπάθειας όπως η αρθροπάθεια facet, κήλη μεσοππονδυλίου δίσκου ή κεντρική στένωση του σπονδυλικού σωλήνα.1,2,4,11 Η συμπίεση του νωτιαίου μυελού με νευρολογικά ελλείμματα θα πρέπει να αντιμετωπίζεται με χειρουργική αποσυμπίεση και οπίσθια σταθεροποίηση της σπονδυλικής στήλης. Ο ιδανικός υποψήφιος για διαδερμική σπονδυλοπλαστική είναι ένας ασθενής που παρουσιάζεται εντός 4 έως 6 μηνών από ένα κάταγμα που δεν βελτιώνεται με συντηρητική ιατρική θεραπεία ή έχει πόνο μέσης γραμμής στην πλάτη ή/και την μέση που αυξάνεται με την άρση βάρους και που επιδεινώνεται με την πίεση της ακανθώδους απόφυσης του εμπλεκόμενου σπονδύλου.3,4,8,11 Σύμφωνα με τη βιβλιογραφία, αυτός ο ασθενής θα πρέπει να περιμένει σχεδόν 80% ανακούφιση από σημαντικό άλγος και βελτιωμένη κινητικότητα μετά την σπονδυλοπλαστική.2 Η σπονδυλοπλαστική παραμένει ο ακρογωνιαίος λίθος θεραπείας για οστεοπενικές ή οστεολυτικές βλάβες των οστών που φέρουν βάρος λόγω της συνδυασμένης ενοποίησης και τις σταθεροποιητικές επιπτώσεις. Τεχνικές κρυοκατάλυσης ή θερμικής κατάλυσης με προαιρετική σπονδυλοπλαστική μπορούν να εφαρμοστούν για τη διαχείριση του άλγους στο υπόλοιπο σκελετικό σύστημα.22,30 Οι ενδείξεις και οι αντενδείξεις της διαδερμικής σπονδυλοπλαστικής και οστεοπλαστικής περιγράφονται στον Πίνακα 1.

Κλινικά Θέματα
Ασθενείς με επώδυνα οστεοπορωτικά κατάγματα σπονδύλων θα πρέπει να παραπέμπονται για θεραπεία σπονδυλοπλαστικής μετά από αποτυχία τουλάχιστον 3 εβδομάδων συντηρητικής θεραπείας. Η έγκαιρη παρέμβαση δικαιολογείται μόνο σε περιπτώσεις ηλικιωμένων με υψηλό κίνδυνο για επιπλοκές της κατάκλισης όπως εν τω βάθει φλεβική θρόμβωση, πνευμονία και έλκη κατάκλισης.7,31 Οι οσφυϊκές σπονδυλικές βλάβες γενικά προκαλούν άλγος στη ράχη και ευαισθησία στη μέση γραμμή στο επίπεδο του κατάγματος. Σε περίπτωση καταγμάτων στο επίπεδο του μυελού, το άλγος μπορεί να ακτινοβολεί στην περιοχή των ισχίων.1,4,6,8 Βασικές ακτινογραφικές μελέτες, αξονική τομογραφία λεπτής τομής (CT) και μαγνητική τομογραφία (MR) είναι απαραίτητες για το βέλτιστο προεγχειρητικό σχεδιασμό για τον εντοπισμό των επιπέδων του κατάγματος, την εκτίμηση του χρόνου, την περιγραφή της έκτασης της λύσης, τον εντοπισμό τυχόν συμμετοχής των αυχένων, την αξιολόγηση της ακεραιότητας του οπισθίου σπονδυλικού τοιχώματος του σώματος και τον αποκλεισμό της επισκληριδίου εξαπλώσεως του όγκου και των οστικών θραυσμάτων , τα οποία όλα συνδέονται με αυξημένη πιθανότητα επιπλοκών.1,3,6,11 Το κάταγμα ή η παραβίαση του οπίσθιου σπονδυλικού φλοιού καταργεί τις προστατευτικές και μονωτικές του ιδιότητες και προδιαθέτει σε αυξημένες διαφυγές στον σπονδυλικό σωλήνα.
Η MR απεικόνιση με αλληλουχίες T1, T2 και Short TI Inversion Recovery (STIR) σε αξονικό και οβελιαίο επίπεδο παρέχει τις περισσότερες από τις απαραίτητες μορφολογικές πληροφορίες. Τα οξέα, υποξέα και μη επουλούμενα κατάγματα απεικονίζονται χαμηλής έντασης σε εικόνες T1 και υψηλής έντασης σε εικόνες T2 και STIR.2,3 Λόγω της καταστολής του λίπους, οι ακολουθίες STIR είναι ιδιαίτερα ευαίσθητες στην ανίχνευση οιδήματος του μυελού των οστών και μεταβολικά ενεργών καταγμάτων.7,11 Περαιτέρω απεικόνιση με έγχυση σκιαγραφικού γαδολινίου είναι χρήσιμη για τον εντοπισμό κακοήθους διήθησης και τον αποκλεισμό της λοίμωξης.2,9 Όσον αφορά τα σπονδυλικά αιμαγγειώματα, τα οποία είναι τυπικώς υψηλής έντασης σήματος σε εικόνες Τ1 και Τ2, υπάρχει και ένας επιθετικός υπότυπος που είναι πιο συχνά συμπτωματικός και παρουσιάζει χαμηλό σήμα σε εικόνες Τ1 και υψηλό σήμα σε εικόνες Τ2.32 Συχνά, το υψηλό κόστος, η παρουσία βηματοδοτών και η σοβαρή κλειστοφοβία μπορεί να περιορίσουν την πρόσβαση στην προεγχειρητική απεικόνιση MR.
Σε περίπτωση πολυεπίπεδων σπονδυλικών καταγμάτων, η απεικόνιση των οστών μπορεί να είναι χρήσιμη για τη διαφοροποίηση του συμπτωματικού επιπέδου από αυτά που ανακαλύφθηκαν τυχαία. Απαιτείται σάρωση οστών σε περίπτωση πολλαπλών συνεχόμενων καταγμάτων και εάν υπάρχουν υπόνοιες για κατάγματα ανεπάρκειας του ιερού οστού και της λεκάνης.1,9 Σημειώνεται ότι η αυξημένη πρόσληψη ραδιοισοτόπου είναι εξαιρετικά προγνωστική για την επιτυχή ανακούφιση από το άλγος μετά από σπονδυλοπλαστική.33 Εάν η απεικόνιση αναδεικνύει σκλήρυνση των οστών, η οποία υποδηλώνει επούλωση του κατάγματος, η οστεοπλαστική θα πρέπει να αποθαρρύνεται επειδή η προώθηση της βελόνας και η έγχυση τσιμέντου μπορεί να είναι ιδιαίτερα δύσκολες και αναμένονται μη βέλτιστα κλινικά αποτελέσματα.11
Τεχνικά Θέματα
Η διαδερμική σπονδυλοπλαστική γενικά εκτελείται με τοπική αναισθησία και νευρολεπταναλγησία υπό αυστηρές άσηπτες συνθήκες.3,8,34 Η προφυλακτική αντιβιοτική κάλυψη ευρέος φάσματος (κεφαζολίνη 1g) είναι υποχρεωτική σε ανοσοκατεσταλμένους ασθενείς. Η διήθηση με 1% λιδοκαϊνη του δέρματος και του υποδόριου μαλακού ιστού έως και το περιόστεο του οστού-στόχου και ο συνδυασμός ενδοφλέβιας χορήγησης οπιούχου (φεντανύλη) και βενζοδιαζεπίνης (μιδαζολάμη) κατά την προώθηση της βελόνας και την ένεση τσιμέντου επιτυγχάνουν επαρκή αναλγησία και αναισθησία για μια επιτυχημένη διαδικασία οστεοπλαστικής στην πλειονότητα των περιπτώσεων. 1-4,9 Ενδέχεται να απαιτείται αναισθησιολογική κάλυψη και γενική αναισθησία για εργαλεία μεγαλύτερης διατομής, όπως στην περίπτωση της κυφοπλαστικής που περιγράφεται παρακάτω, και για δύσκολους ασθενείς με διαταραχή της καρδιοπνευμονικής λειτουργίας.35 Έχει επίσης προταθεί καταστολή με συνεχή έγχυση προποφόλης τιτλοποιημένη στις ανάγκες του ασθενούς.36 Βασικές εξετάσεις αίματος και βιοχημικός έλεγχος, έλεγχος του προφίλ πήξεως, παρακολούθηση του ασθενούς και επιτόπια ορθοπεδική ή νευροχειρουργική υποστήριξη στην έκτακτη περίπτωση πίεσης του νωτιαίου μυελού θα πρέπει να είναι όλα διαθέσιμα πριν από τη λήψη συναίνεσης του ασθενούς.2,4
Η διαδερμική οστεοπλαστική μπορεί να χωριστεί σε δύο εξίσου σημαντικά βήματα: πρώτον, τοποθέτηση βελόνας και δεύτερον, ένεση/έγχυση του τσιμέντου. Η σωστά επιλεγμένη ακτινοσκόπηση είναι υψίστης σημασίας για την ακριβή στόχευση της βλάβης, την τοποθέτηση της βελόνας, την ακριβή απεικόνιση της κατανομής του τσιμέντου και την έγκαιρη ανίχνευση πιθανών διαφυγών. 3,38 Εναλλακτικά, ένα μηχάνημα CT πολλαπλών ανιχνευτών με ενσωματωμένη πολυτομική ακτινοβολία fluoro-CT ή μια μονάδα αγγειογραφίας με αξονική τομογραφία επίπεδης οθόνης (cone beam CT) νέας γενιάς μπορεί να χρησιμοποιηθεί σύμφωνα με την εμπειρία του χειριστή. Σε κάθε περίπτωση, το τελικό κρίσιμο βήμα της έγχυσης τσιμέντου πρέπει να παρακολουθείται σε πραγματικό χρόνο με ακτινοσκόπηση υψηλής ποιότητας. Σύμφωνα με την εμπειρία μας, οι σύγχρονες μονάδες περιστροφικής αγγειογραφίας με απεικόνιση διπλού επιπέδου προσφέρουν υψηλή ευελιξία σε συνδυασμό με απεικόνιση υψηλής ανάλυσης για την πλειονότητα των ελάχιστα επεμβατικών επεμβάσεων σπονδυλικής στήλης. Η ακτινοσκόπηση διπλού επιπέδου είναι στοιχειώδης γιατί επιτρέπει την ταυτόχρονη απεικόνιση δύο κάθετων επιπέδων.1 Λόγω της υψηλής χωρικής ανάλυσης, η καθοδήγηση υπό CT είναι ανώτερη στον εντοπισμό μικρών διαρροών τσιμέντου.39,40
Το σημείο εισόδου στο δέρμα και η οδός της βελόνας μπορούν να αποφασιστούν εκ των προτέρων με βάση την προεγχειρητική απεικόνιση. Ο ασθενής τοποθετείται τυπικά σε πρηνή θέση για οστεοπλαστική των θωρακοοσφυϊκών σπονδύλων και σε ύπτια θέση για θεραπεία της αυχενικής μοίρας της σπονδυλικής στήλης. Η τοποθέτηση του ασθενούς για εξωσπονδυλική οστεοπλαστική μπορεί να είναι πρηνής, ύπτια ή σε πλάγια κατάκλιση, ανάλογα με την ακριβή ανατομική θέση της βλάβης. Όταν ο ασθενής βρίσκεται σε πρηνή θέση, η τοποθέτηση μαλακών μαξιλαριών στα επίπεδα των αστραγάλων και της οσφυϊκής μοίρας της σπονδυλικής στήλης βοηθά στην ευθυγράμμιση της καμπυλότητας της σπονδυλικής στήλης.37 Η ασφαλέστερη οδός εισόδου της βελόνας στο θωρακικό και οσφυϊκό επίπεδο είναι με μια τυπική διαυχενική προσέγγιση. Εναλλακτικά, μπορεί να ακολουθηθεί μια σπονδυλοπλευρική ή μια παρασπονδυλική οδός εάν οι αυχένες δεν είναι εύκολα ορατοί στη μετωπιαία ακτινογραφία ακτινοσκόπησης λόγω νεοπλασματικής διήθησης ή κατάγματος και κατάρρευσης.1,3,37,41 Μια προσθιοπλάγια προσέγγιση που αποφεύγει τον τραυματισμό του συμπλέγματος καρωτίδας – σφαγίτιδας συνήθως ακολουθείται στα επίπεδα του τραχήλου και αυχενος.37 Προτείνεται μια άμεση προσθιοοπίσθια διαστοματική οδός για την έγχυση τσιμέντου στον δεύτερο αυχενικό σπόνδυλο.42,43 Έχει επίσης περιγραφεί μια δια-δισκική προσέγγιση από ένα παρακείμενο οσφυϊκό επίπεδο.44 Σε περίπτωση ενός συμπιεστικού κατάγματος, τουλάχιστον το ένα τρίτο που απομένει στο ύψος του σπονδυλικού σώματος είναι απαραίτητο για την ασφαλή εισαγωγή της βελόνας και την έγχυση τσιμέντου.
Η εισαγωγή μιας βελόνας με μεγάλη οπή, διαμέτρου 10 έως 15G, σε σχήμα διαμαντιού ή λοξότμητης βελόνας ξεκινά με τον ασθενή σε πρηνή θέση. Ο κατάλληλος αυχένας εντοπίζεται με ακτινοσκόπηση και εμφανίζεται με ωοειδή μορφή σε ευθεία προσθιοπίσθια όψη με ελαφρά γωνίωση 5 έως 10 μοιρών. Μόλις τεθεί σε εφαρμογή το τοπικό αναισθητικό, η φλοιώδης διάτρηση στην άνω και πλάγια όψη του αυχένα ξεκινά με τη βοήθεια ενός χειρουργικού σφυριού ή τρυπανιού με μπαταρία.1,3,4,6,37 Η βελόνα προωθείται αργά κάτω από περιοδική στεφανιαία και πλάγια ακτινοσκόπηση με ιδιαίτερη προσοχή ώστε να μην ξεπεραστεί το έσω και το κάτω όριο του μίσχου, ώστε να αποφευχθεί η διάρρηξη του σπονδυλικού σωλήνα και των υποκείμενων τρημάτων, αντίστοιχα. Μια γωνία προώθησης 10 έως 15 μοιρών στο στεφανιαίο επίπεδο της μέσης γραμμής θα τοποθετήσει τη βελόνα μέσα στο ομόπλευρο σπονδυλικό σώμα, ενώ μια γωνία 25 έως 30 μοιρών θα τοποθετήσει τη βελόνα πιο κοντά στη μέση γραμμή. Ο χειριστής θα πρέπει να θυμάται ότι οι σπόνδυλοι είναι κυκλικοί και σε μια πλάγια προβολή το πιο πρόσθιο τμήμα του σπονδυλικού σώματος βρίσκεται στη μέση γραμμή, επομένως όσο πιο ομόπλευρη είναι η προσέγγιση της βελόνας, τόσο λιγότερο προς τα εμπρός μπορεί να προωθηθεί η βελόνα πριν διαρρήξει τον πρόσθιο σπονδυλικό φλοιό.45 Η καθοδήγηση με αξονική τομογραφία μπορεί να είναι περισσότερο δύσχρηστη από την ακτινοσκόπηση σε πραγματικό χρόνο, αλλά επιτρέπει την τρισδιάστατη απεικόνιση με ακριβή διαφοροποίηση της τοπικής ανατομίας και είναι πιο αποτελεσματική στην επίτευξη της ιδανικής τροχιάς της βελόνας προς τη μέση γραμμή.38 Για τη διαδερμική σπονδυλοπλαστική, το άκρο της βελόνας θα πρέπει να τοποθετείται μεσαία στο πρόσθιο ένα τρίτο έως το ένα τέταρτο του σπονδυλικού σώματος, όσο το δυνατόν πιο κοντά στη μέση γραμμή.1,3,37
Με αυτόν τον τρόπο, συνήθως αρκεί μια ενιαία ετερόπλευρη προσέγγιση για τη σταθεροποίηση όλου του σπονδυλικού σώματος με τσιμέντο. Εάν η βέλτιστη συσσώρευση τσιμέντου δεν επιτευχθεί από την πρώτη προσέγγιση, τότε μπορεί να πραγματοποιηθεί αμφοτερόπλευρη διαυχενική προσέγγιση, εις βάρος μιας παρατεταμένης διαδικασίας και επιπλέον κινδύνου διαφυγής τσιμέντου.22 Ωστόσο, δεν έχει αναφερθεί διαφορά στα κλινικά αποτελέσματα μεταξύ ετερόπλευρων και αμφοτερόπλευρων προσεγγίσεων.46 Προσωπικά, προτιμούμε να χρησιμοποιούμε βελόνα σπονδυλοπλαστικής διαμετρήματος 10 για την οσφυϊκή μοίρα, διαμετρήματος 12 για τον θωρακικό και διαμετρήματος 15 για τους αυχενικούς σπονδύλους. Η χρήση μιας λοξότμητης βελόνας έχει το πλεονέκτημα της δυνατότητας διεύθυνσης, επιτρέποντας συνεχείς αλλαγές στον προσανατολισμό της οδού της βελόνας. Με αυτόν τον τρόπο, το έσω όριο του αυχένα σπάνια παραβιάζεται, η βελόνα προωθείται αμέσως στη μέση γραμμή και σπάνια απαιτείται αμφοτερόπλευρη πρόσβαση.3,4
Για ιατροδικαστικά ζητήματα, υποστηρίζουμε τη συλλογή δείγματος βιοψίας οστού σε όλες τις περιπτώσεις, καθώς η βελόνα διέρχεται από το μέσον του σπονδυλικού σώματος.1-47 Η εφαρμογή της φλεβογραφίας για την απεικόνιση των φλεβικών επικοινωνιών και τον εντοπισμό πιθανών οδών εξαγγείωσης πριν από την οριστική ένεση του τσιμέντου παραμένει αμφιλεγόμενη.48,49 Εκτός από τις υπεραγγειούμενες βλάβες όπως τα αιμαγγειώματα και οι μεταστάσεις από τον καρκίνο του θυρεοειδούς και των νεφρικών κυττάρων, το ιωδιούχο σκιαγραφικό ξεπλένεται πολύ αργά από το σπονδυλικό σώμα και μπορεί να κρύψει μικρές διαρροές τσιμέντου στη συνέχεια.4 Ως εκ τούτου, θα συνιστούσαμε μια ήπια αναρρόφηση από τη βελόνα αντί για φλεβογραφία με σκιαγραφικό για να αποκλειστεί μια σημαντική φλεβική επικοινωνία πριν από την ένεση τσιμέντου. Η οστεοπλαστική εξωσπονδυλικών αλλοιώσεων άλλων οστών που φέρουν βάρος εκτελείται υπό την καθοδήγηση αξονικής τομογραφίας και μπορεί να απαιτούνται περισσότερες από μία βελόνες, ανάλογα με την έκταση της νεοπλασματικής προσβολής.50
Υλικά Τσιμέντου
Η αρχή της ανακούφισης του άλγους με την οστεοπλαστική βασίζεται στη σταθεροποίηση του εξασθενημένου και παθολογικού σπογγώδους οστού και στη συνδυασμένη χημική και θερμική κυτταροτοξική δράση που παράγεται κατά τον πολυμερισμό του τσιμέντου. Στην πραγματικότητα, μπορεί να επιτευχθεί επαρκής ανακούφιση από το μεταστατικό άλγος από έγχυση όγκου μόνο 2mL μεθακρυλικού πολυμεθυλεστέρα (PMMA).51,52 Μετά την επιτυχή τοποθέτηση της βελόνας στη βλάβη που μας ενδιαφέρει, το τσιμέντο παρασκευάζεται σύμφωνα με τις οδηγίες του κατασκευαστή. Το PMMA είναι το πιο ευρέως χρησιμοποιούμενο τσιμέντο με εμπειρία πολλών δεκαετιών στην ορθοπεδική χειρουργική. Τα τσιμέντα PMMA παλαιότερης γενιάς έπρεπε να αναμιχθούν με θειϊκό βάριο, βολφράμιο ή σκόνη τανταλίου λόγω της εγγενώς χαμηλής ακτινοσκιερότητάς τους. Σήμερα, μια ποικιλία ενέσιμων τσιμέντων είναι εμπορικά διαθέσιμη για χρήση σε επεμβάσεις οστεοπλαστικής και κάθε ιατρός θα πρέπει να είναι εξοικειωμένος με τις διαφορές τους όσον αφορά τη χημική σύνθεση, τους χρόνους πολυμερισμού, τη βιοσυμβατότητα, τη μηχανική αντοχή, και τις ρεολογικές τους ιδιότητες (Πίνακας 2). Συνιστάται η χρήση κλειστού συστήματος ανάμειξης για την αποφυγή μόλυνσης του τσιμέντου και την επίτευξη ομοιογενούς ανάμειξης και βέλτιστης αντοχής χωρίς να περιλαμβάνονται φυσαλίδες αέρα.34
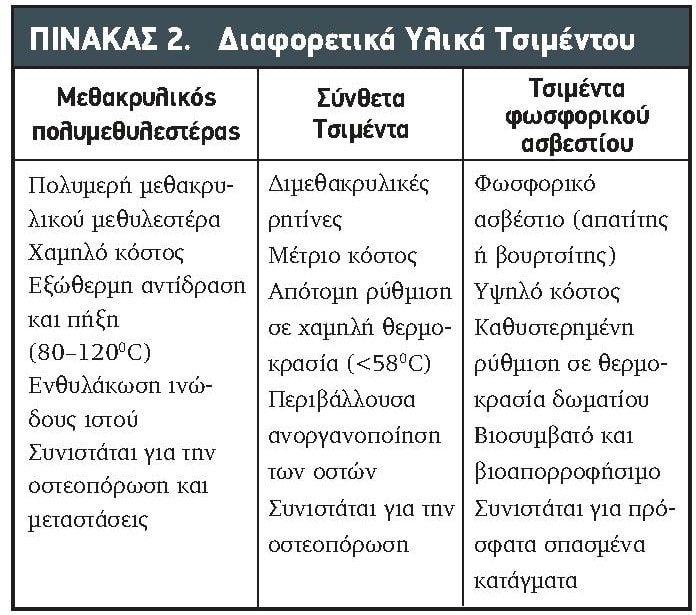
Τα νέα τσιμέντα PMMA έχουν αυξημένη ακτινοσκιερότητα, αλλά εξακολουθούν να παρασκευάζονται με ανάμειξη με το χέρι μιας σκόνης πολυμερούς (μεθακρυλικός μεθυλεστέρας) και ενός μονομερούς υγρού (μεθακρυλικός μεθυλεστέρας/διμεθυλ-π-τολουιδίνη).53,54 Ο κατασκευαστής προτείνει μια αναλογία μονομερούς/πολυμερούς 0,5mL/g. Η προσαρμοσμένη τροποποίηση αυτής της αναλογίας ή η ψύξη του μείγματος σε παγωμένο λουτρό μπορεί να παρατείνει το χρόνο πήξης με μειωμένο ιξώδες του μείγματος. Μέσα σε λίγα λεπτά από τη συνιστώμενη παρασκευή του, το PMMA αυξάνει το ιξώδες του από λεπτό σε παχύ και παχύρρευστο. Για να ελαχιστοποιηθούν οι διαρροές τσιμέντου, το PMMA πρέπει να εγχυθεί κατά τη διάρκεια αυτής της φάσης πολυμερισμού.2,4 Τυπικά, το PMMA έχει χρόνο πήξης 8 έως 10 λεπτά σε θερμοκρασία δωματίου 200C. Στη σύγχρονη κλινική πρακτική, έτοιμα προς χρήση τσιμέντα PMMA διατίθενται στο εμπόριο, επιτρέποντας την ασφαλή έγχυση χωρίς επιτόπιο χειρισμό του υλικού. Ο πολυμερισμός του PMMA είναι μια εξωθερμική αντίδραση και η θερμοκρασία του τσιμέντου φτάνει τους 80 έως τους 1200C, η οποία παράγει τοπική θερμοπηξία των καρκινικών κυττάρων, αλλά μπορεί επίσης να βλάψει υγιείς παρακείμενους ιστούς, όπως οι νευρικές ρίζες και ο ίδιος ο νωτιαίος μυελός, σε περίπτωση σοβαρής διαρροής. Θερμοκρασίες ιστών έως και 700C έχουν καταγραφεί κατά τη διάρκεια της οστεοπλαστικής PMMA.55 Είναι ενδιαφέρον ότι το PMMA δεν αντιδρά στον σχηματισμό νέου οστού και η παθολογική εξέταση έχει δείξει την ανάπτυξη ενός στρώματος ινώδους ιστού μεταξύ του PMMA και του υγιούς παρακείμενου οστού που ενθυλακώνει το εμφυτευμένο υλικό.54
Τα νεότερα υλικά πλήρωσης για την οστεοπλαστική είναι τα σύνθετα τσιμέντα και τα τσιμέντα φωσφορικού ασβεστίου (CPCs).53,54 Τα σύνθετα τσιμέντα είναι ένας άλλος τύπος ακρυλικής κόλλας που χρησιμοποιείται από τα τέλη της δεκαετίας του 1970 και τα σύνθετα σκευάσματα τσιμέντου αποτελούνται από διάφορες μορφές διμεθακρυλικών ρητινών γλυκυλ-μεθακρυλικού (GMA) ή μεθακρυλικό αιθυλεστέρα (EMA). Τα σύνθετα τσιμέντα αναπτύχθηκαν κυρίως για την αποφυγή της εξωθερμικής αντίδρασης σε συνδυασμό με PMMA, αλλά έχουν επίσης τα πλεονεκτήματα του βελτιωμένου εμβιομηχανικού προφίλ και της βιοσυμβατότητας. Τα σύνθετα τσιμέντα στερεοποιούνται σε χαμηλή θερμοκρασία (που δεν υπερβαίνει τους 580C), έχουν βελτιωμένη ανοχή στην κόπωση σε σύγκριση με το PMMA και ακολουθούνται από μεγαλύτερο βαθμό ανοργανοποίησης του περιβάλλοντος οστού.56,57 Τα μειονεκτήματα είναι το σχετικά χαμηλό ιξώδες τους που προδιαθέτει για διαρροές, το υψηλότερο κόστος και η απότομη πήξη του υλικού που συμβαίνει μετά από ~8 λεπτά με κίνδυνο να κολλήσει η βελόνα μέσα στον σπόνδυλο. Επειδή τα σύνθετα τσιμέντα στερούνται κυτταροτοξικής εξωθερμικής δράση, δεν θα τα συνιστούσαμε για τη θεραπεία οστικών μεταστάσεων. Ωστόσο, λόγω της χαμηλής θερμοκρασίας πήξης και των ανώτερων μηχανικών ιδιοτήτων των σύνθετων τσιμέντων, τα οστεοπορωτικά συμπιεστικά κατάγματα θα μπορούσαν να είναι η καλύτερη ένδειξη για τη χρήση τους.
Τα CPCs είναι ο πιο βιοσυμβατός και ακριβότερος τύπος τσιμέντου που διατίθεται στην αγορά σήμερα και είναι ιδιαίτερα ενδιαφέροντες λόγω των οστεοαγώγιμων ιδιοτήτων τους.53,54,58,59 Τα CPCs αποτελούνται από σκόνες φωσφορικού ασβεστίου διαλυμένες σε υδατικό διάλυμα. Σε θερμοκρασία δωματίου, κρύσταλλοι απατίτη ή βουρτσίτη καθιζάνουν από το ενέσιμο CPC, το οποίο με τη σειρά του διεγείρει το σχηματισμό νέων οστών. Η ιστολογική εξέταση έδειξε πρώιμη βιοαπορρόφηση των CPC μετά από 2 εβδομάδες και άφθονη νέα εναπόθεση οστού χωρίς φλεγμονή ή ινώδη ενθυλάκωση.53,54,59 Τα παραπάνω χαρακτηριστικά καθιστούν τα CPC εξαιρετικά ελκυστικά για τη θεραπεία πρόσφατων εκρηκτικών θωρακοοσφυϊκών καταγμάτων σε νέους. Στην περίπτωση οστεοπόρωσης, η πρώιμη βιοαπορρόφηση του τσιμέντου μπορεί να είναι πρόβλημα εάν δεν συμβεί παράλληλα με το σχηματισμό νέου οστού. Παρά τα ευνοϊκά βιοαπορροφήσιμα χαρακτηριστικά τους, τα CPC έχουν μεγαλύτερους χρόνους πήξης σε χαμηλές θερμοκρασίες (περίπου 10 λεπτά), χαμηλότερη αντοχή σε σύγκριση με το PMMA και μειωμένη συνοχή λόγω των υδρόφιλων ιδιοτήτων τους, χαρακτηριστικά τα οποία καθιστούν δύσκολη την έγχυση.59 Θα συνιστούσαμε τη χρήση αυτού του τύπου τσιμέντου μετά τη δημιουργία κοιλότητας στο σπονδυλικό σώμα, για παράδειγμα, με ένα διογκούμενο μπαλόνι όπως στην κυφοπλαστική, για να αποφευχθεί ο διαχωρισμός του υδατικού διαλύματος και των κρυσταλλικών ορυκτών κατά την έγχυση. Για μια πιο λεπτομερή ανάλυση των διαφόρων τύπων τσιμέντου και των ιδιοτήτων τους, ο αναγνώστης προτρέπεται να ανατρέξει και στις οδηγίες χρήσης των διαφόρων κατασκευαστών.
Συνήθως ο ασθενής χρειάζεται συνειδητή καταστολή κατά την έγχυση τσιμέντου, η οποία είναι επώδυνη λόγω της εξωθερμικής αντίδρασης PMMA. Η συνεχής επαγρύπνηση με συνεχή πλάγια και διαλείπουσα στεφανιαία ακτινοσκόπηση και αμέριστη προσοχή και έλεγχος από τον υπεύθυνο ιατρό είναι υποχρεωτική κατά τη διάρκεια της έγχυσης τσιμέντου για την έγκαιρη αναγνώριση τυχόν ακούσιων διαρροών.3,4 Ο κίνδυνος διαφυγής τσιμέντου είναι υψηλότερος στην αρχή της έγχυσης, όταν το τσιμέντο είναι πιο παχύρρευστο. Εάν εντοπιστεί διαρροή μετά τις πρώτες σταγόνες τσιμέντου, η πίεση έγχυσης απελευθερώνεται αμέσως ή ακόμα και αντιστρέφεται.1,2,9 Η έγχυση μπορεί να συνεχιστεί μετά από ένα μικρό διάστημα 30 έως 60 δευτερολέπτων για να επιτρέψει στο τσιμέντο να σκληρύνει και να σφραγίσει τη διαρροή. Εάν η διαρροή συνεχιστεί, τότε η βελόνα πρέπει να αποσυρθεί ελαφρά και η λοξότμηση να περιστραφεί για να κατευθύνει την έγχυση τσιμέντου σε διαφορετική κατεύθυνση. Η ένεση πρέπει να διακόπτεται αμέσως εάν το τσιμέντο φτάσει στον οπίσθιο σπονδυλικό φλοιό.1,2,9
Συνήθως, 2,5 έως 4mL τσιμέντου παρέχουν τη βέλτιστη σπονδυλική πλήρωση σε περίπτωση οστεοπόρωσης ή αιμαγγειώματος, αν και σε μεταστάσεις, 1,5 έως 2,5mL αρκούν για την ανακούφιση του άλγους και την αποφυγή επιπλοκών.4 Το προτεινόμενο τελικό σημείο είναι η πλήρωση με τσιμέντο του πρόσθιου μισού έως δύο τρίτα του σπονδυλικού σώματος, με το τσιμέντο να εκτείνεται κατά μήκος της μέσης γραμμής μέχρι την ετερόπλευρη πλευρά του σπονδύλου.1,37 Εάν υπάρχει ρωγμή κατάγματος, ο χειριστής θα πρέπει να προσπαθήσει να το γεμίσει με τσιμέντο.1 Σε περίπτωση αμφοτερόπλευρης προσέγγισης, το τσιμέντο από την πρώτη ένεση μπορεί να αποκρύψει την οπτικοποίηση της δεύτερης ένεσης. Δεν συνιστάται η μέγιστη πλήρωση τσιμέντου λόγω του κινδύνου υπερχείλισης τσιμέντου. Μετά την ικανοποιητική πλήρωση και πριν από τη σκλήρυνση του τσιμέντου, η βελόνα του στυλεού πρέπει να επανατοποθετηθεί για να εκκενωθεί ο μικρός όγκος τσιμέντου που βρίσκεται στον νεκρό χώρο του σωληνίσκου-τροκαρ. Διαφορετικά, η αφαίρεση της βελόνας μπορεί να είναι δύσκολη και υπάρχει κίνδυνος διαρροής τσιμέντου κατά μήκος της οδού της βελόνας. Υπάρχουν ανέκδοτες περιπτώσεις γραμμικών διαρροών τσιμέντου μέσω του μίσχου που φθάνουν στην επιφάνεια του δέρματος που έπρεπε να αφαιρεθεί χειρουργικά. Σε περίπτωση που ο στυλεός δεν μπορεί να επανατοποθετηθεί, η συνεχής δεξιόστροφη και αριστερόστροφη περιστροφή του σωληνίσκου υπό ακτινοσκόπηση βοηθά στην αποκόλληση της βελόνας χωρίς διαρροή τσιμέντου.
Μετά την ολοκλήρωση της διαδικασίας και πριν απομακρυνθεί ο ασθενής από το χειρουργικό τραπέζι, ο χειριστής θα πρέπει να περιμένει τη σκλήρυνση του τσιμέντου, όπως υποδεικνύεται από την τοποθέτηση του υπόλοιπου τσιμέντου στο κυπέλλου ανάμειξης.2 Επιπλέον, επιτρέπεται στον ασθενή να περπατήσει τουλάχιστον 2 ώρες μετά τη διαδικασία (ή ακόμα και αργότερα εάν έγινε ένεση CPC). Συνιστάται η τακτική παρακολούθηση των ζωτικών σημείων και η νευρολογική εξέταση αμέσως μετά την επέμβαση. Μη στεροειδή παυσίπονα ή στεροειδή αντιφλεγμονώδη φάρμακα μπορούν να συνταγογραφηθούν για 2 έως 4 ημέρες μετά την τσιμεντοπλαστική PMMA.2
Επιπλοκές
Η πιθανότητα επιπλοκών, ιδιαίτερα διαρροής τσιμέντου, είναι υψηλότερη κατά τη θεραπεία των μεταστατικών βλαβών παρά των συμπιεστικών καταγμάτων οστεοπόρωσης. Ως εκ τούτου, η αναλογία κινδύνου-οφέλους θα πρέπει να αξιολογείται με σύνεση, ειδικά όταν αποφασίζεται η διενέργεια οστεοπλαστικής σε ασθενή με πολυεπίπεδες οστικές μεταστάσεις. Ο συνιστώμενος ουδός επιπλοκών για ένα εξειδικευμένο τριτοβάθμιο κέντρο που εκτελεί διαδερμική σπονδυλοπλαστική και οστεοπλαστική για τη διαχείριση του πόνου είναι 2% για οστεοπορωτικές ενδείξεις και 10% για κακοήθεις περιπτώσεις.9
Αν και είναι συνήθως ασυμπτωματική, η ακούσια διαρροή τσιμέντου είναι η πρώτη και πιο σημαντική επιπλοκή της οστεοπλαστικής.1,60 Η ανίχνευση διαρροών τσιμέντου στις ακτινογραφίες κυμαίνεται από 30 έως 72,5% και φτάνει πάνω από 90% στην CT.1,61 Στη σπονδυλοπλαστική, το τσιμέντο μπορεί να διαρρεύσει προς τις επισκληρίδιες φλέβες ή τον επισκληρίδιο χώρο, μέσα στα νευρικά τρήματα, προς το δίσκο, το περισπονδυλικό φλεβικό πλέγμα ή στους παρασπονδύλιους μαλακούς ιστούς. Διαρροές τσιμέντου που εντοπίζονται στην αορτή και τις μεσοπλεύριες αρτηρίες έχουν επίσης περιγραφεί.1–4,37,60 Η οπίσθια υπερχείλιση τσιμέντου στον νωτιαίο σωλήνα και η συμπίεση του νωτιαίου μυελού αποτελούν μια σημαντική επιπλοκή που μπορεί να απαιτεί επείγουσα χειρουργική αποσυμπίεση σε περίπτωση παραπληγίας. Το αναφερόμενο ποσοστό παροδικών νευρολογικών ελλειμμάτων, που συνήθως βελτιώνονται εντός 30 ημερών από την παρέμβαση, είναι 1% σε ασθενείς με οστεοπόρωση και 5% σε ασθενείς με μεταστάσεις.9 Η διαρροή τσιμέντου στο νευρικό τρήμα είναι λιγότερο ανεκτή λόγω του περιορισμένου χώορυ και μπορεί να προκαλέσει χημική και θερμική βλάβη του εξερχόμενου νεύρου, με αποτέλεσμα ριζοπάθεια.4 Εάν συμβεί αυτό, θα πρέπει να πραγματοποιηθεί αμέσως ακτινοσκοπική ενδοτρηματική έγχυση φυσιολογικού ορού, λιδοκαΐνης και στεροειδών με βελόνα για να ψυχθεί η ρίζα και να αντιμετωπιστεί η φλεγμονή.1
Οι περι- και παρα-σπονδυλικές φλεβικές διαρροές είναι ζωτικής σημασίας γιατί μπορεί να συνεχιστούν και να προκαλέσουν πνευμονική εμβολή από τσιμέντο.3 Η πνευμονική εμβολή από τσιμέντο είναι συνήθως περιφερική και ασυμπτωματική και μπορεί να συμβεί σε 4,0 έως 6,8% των περιπτώσεων σπονδυλοπλαστικής.1,62-64 Παράδοξη εγκεφαλική εμβολή επίσης έχει αναφερθεί.65 Διαρροές ενδοδισκικού τσιμέντου συνήθως επηρεάζουν τον υπερκείμενο μεσοσπονδύλιο δίσκο και μπορεί να σχετίζονται με αυξημένο κίνδυνο γειτονικής σπονδυλικής κατάρρευσης λόγω της αλλοιωμένης εμβιομηχανικής του δίσκου.66 Οι διαφυγές στο επισκληρίδιο φλεβικό δίθκτυο και οι παρασπονδυλικές διαρροές στους μαλακούς ιστούς είναι συνήθως ασυμπτωματικές χωρίς καμία κλινική σημασία.3,4
Η δεύτερη πιο ανησυχητική επιπλοκή είναι η τοπική λοίμωξη, η οποία εμφανίζεται σε λιγότερο από 1% των περιπτώσεων.2 Επομένως, η τήρηση αυστηρών πρωτοκόλλων αποστείρωσης κατά τη διάρκεια όλων των ελάχιστα επεμβατικών μυοσκελετικών παρεμβάσεων δεν μπορεί παρά να υπερτονιστεί. Η ανάπτυξη ενός επισκληρίδιου αποστήματος απαιτεί χειρουργικό καθαρισμό και πιθανώς οριστική αφαίρεση του μολυσμένου ιστού και του τσιμέντου που ακολουθείται από σταθεροποίηση της σπονδυλικής στήλης.67 Περιεγχειρητικό κάταγμα των πλευρών, των σπονδυλικών οπίσθιων στοιχείων ή του αυχένα του τόξου λόγω χειρισμών του χειριστή συμβαίνει σε λιγότερο από 1% των περιπτώσεων και μαζί με την αιμορραγία από το σημείο της παρακέντησης και τα τοπικά αιματώματα, θεωρούνται ελάσσονες επιπλοκές.2 Μετά τη διαδικασία, οι ασθενείς μπορεί να εμφανίσουν παροδικό πυρετό και εντοπισμένο άλγος λόγω της εξώθερμης αντίδρασης της ακρυλικής κόλλας. Το μετεγχειρητικό άλγος είναι ανάλογο με τον όγκο του τσιμέντου που εγχύεται. Ωστόσο, η επαρκής ανακούφιση από το άλγος συνήθως επιτυγχάνεται εντός 24 ωρών.1,4 Τέλος, η διαδικασία ενέχει ορισμένους περιορισμένους κινδύνους αλλεργίας στο ακρυλικό τσιμέντο και σε άλλα υλικά πλήρωσης. Η συστηματική κυκλοφορία του υγρού μονομερούς PMMA που δεν πολυμερίστηκε μπορεί επίσης να προκαλέσει υπόταση και αρρυθμίες.2,68 Οι ιατροί θα πρέπει επίσης να γνωρίζουν τις αντιδράσεις των αεραγωγών όπως βήχας και βρογχόσπασμος μετά από έκθεση σε ατμούς τσιμέντου PMMA, των οποίων τα καταγεγραμμένα επίπεδα είναι, ωστόσο, πολύ χαμηλά κατά τη διάρκεια της διαδερμικής οστεοπλαστικής.69
Για να ελαχιστοποιηθεί ο κίνδυνος επιπλοκών και να μεγιστοποιηθεί η κλινική επιτυχία, οι διεθνείς κατευθυντήριες οδηγίες συνιστούν επαρκή εκπαίδευση του χειριστή, διαθεσιμότητα υψηλής ποιότητας ακτινοσκόπησης, καλή επιλογή ασθενών, σωστή τοποθέτηση της βελόνας και έως τρία έως τέσσερα επίπεδα σπονδυλικής στήλης για κάθε διαδικασία τσιμεντοπλαστικής.9 Περίπου το 70% των περιπτώσεων με επώδυνες οστικές μεταστάσεις, το 80% των σπονδυλικών αιμαγγειωμάτων και το 90% των ασθενών με οστεοπορωτικά κατάγματα θα βιώσουν ικανοποιητική ανακούφιση από τον πόνο από τη διαδικασία με βελτιωμένη κινητικότητα και ποιότητα ζωής.2,4,6,14,21 ,70,71 Ωστόσο, πρόσφατα δημοσιευμένα δεδομένα από δύο τυχαιοποιημένες ελεγχόμενες δοκιμές δεν έδειξαν στατιστικά σημαντική υπεροχή της σπονδυλοπλαστικής έναντι της εικονικής διαδικασίας όσον αφορά την ανακούφιση από τον άλγος72,73 και έχουν προκαλέσει παγκόσμια σύγκρουση και συζήτηση για τη συνολική τους επιστημονική αξία λόγω του ελαττωματικού σχεδιασμού τους, τη μη ρεαλιστική επιλογή ασθενών και τη χαμηλή στατιστική ισχύ.74–76 Επώδυνα συμπιεστικά κατάγματα ηλικίας άνω των 6 μηνών μπορεί να ανταποκριθούν στη τσιμεντοπλαστική αλλά με χαμηλότερα ποσοστά επιτυχίας.77 Μετά τη σπονδυλοπλαστική, νέα συμπιεστικά κατάγματα εμφανίζονται σε έως και στο ένα τέταρτο των ασθενών και σχεδόν τα μισά από αυτά βρίσκονται σε επίπεδα δίπλα στα υπό θεραπεία, συνήθως αμέσως κεφαλοειδή.78 Μια ενδιαφέρουσα μελέτη ανέφερε επαναλαμβανόμενα κατάγματα σπονδύλων που έχουν ήδη υποβληθεί σε θεραπεία στο 63% των περιπτώσεων.79 Μια πρόσφατη συστηματική ανασκόπηση κατέληξε στο συμπέρασμα ότι δεν υπάρχει σαφής απάντηση στο εάν η σπονδυλοπλαστική αυξάνει τον κίνδυνο νέων καταγμάτων σε ασθενείς με οστεοπόρωση.80
Παράδειγμα Κυφοπλαστικής
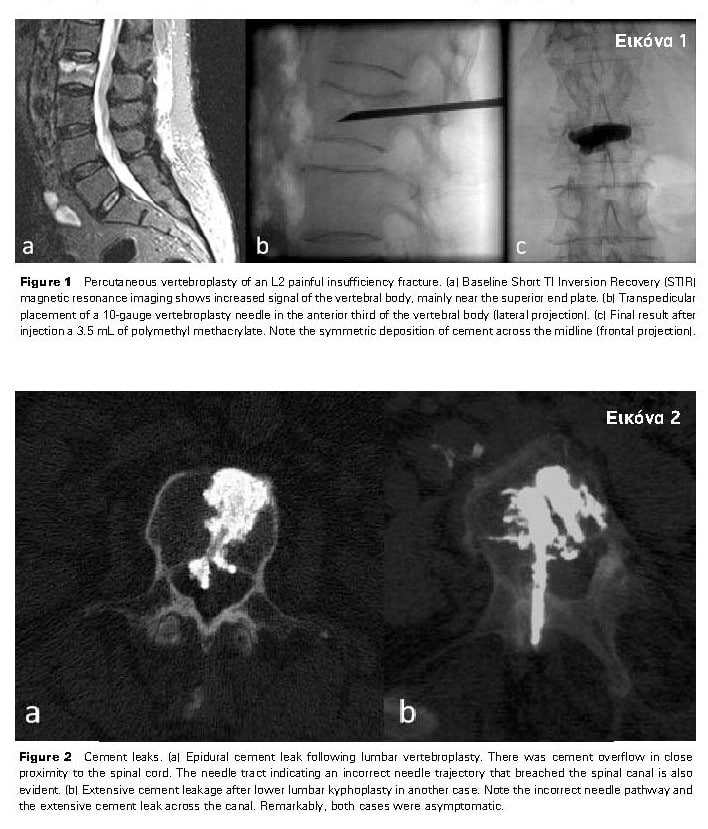
Διαδερμική Κυφοπλαστική επώδυνων οστεοπορωτικών καταγμάτων στους σπονδύλους Θ10, Θ11, Θ12 και Ο2. (Εικόνα 1) Διαδοχικά βήματα με αμφοτερόπλευρη διαυχενική προσπέλαση με είσοδο των τροκάρ, διαστολή των αεροθαλάμων και έγχυση του μεθακρυλικού PMMA. (Εικόνα 2) Τελικό αποτέλεσμα σε πλάγια (αριστερά) και μετωπιαία (δεξιά) προβολές χωρίς σημαντικές διαφυγές του υλικού. Η ασθενής παρουσίασε σημαντική ύφεση του άλγους και πλήρη κινητοποίηση εντός ημέρας.
Κυφοπλαστική
Η κυφοπλαστική εισήχθη το 2001. Πρόκειται για μια τροποποίηση της σπονδυλοπλαστικής, η οποία χρησιμοποιεί ένα μπαλόνι για την αποκατάσταση του σπονδυλικού ύψους και τη δημιουργία μιας κοιλότητας μέσα στο σπονδυλικό σώμα για τη φιλοξενία του εγχυόμενου τσιμέντου.81 Ο στόχος είναι να διορθωθούν ή να αποτραπούν οι κυφωτικές παραμορφώσεις μετά την απώλεια ύψους της σπονδυλικής στήλης. Ωστόσο, η θεμελιώδης αρχή τόσο της σπονδυλοπλαστικής όσο και της κυφοπλαστικής παραμένει η μηχανική σταθεροποίηση των οστών με έγχυση τσιμέντου.82,83 Το μπαλόνι προωθείται και φουσκώνεται μέσω ενός τροκάρ διαμετρήματος 8G που εισάγεται όπως και στην σπονδυλοπλαστική. Το κύριο πλεονέκτημα της κυφοποπλαστικής είναι η μερική αποκατάσταση του ύψους του σπονδυλικού σώματος, σε βάρος, ωστόσο, του υψηλότερου κόστους της διαδικασίας. Η αναφερόμενη μέση αποκατάσταση ύψους μετά από κυφοπλαστική για συμπιεστικά κατάγματα είναι περίπου 3 έως 5mm στο κέντρο του σπονδυλικού σώματος.84
Πρόσφατα δεδομένα από τυχαιοποιημένες ελεγχόμενες δοκιμές σπονδυλοπλαστικής ή κυφοπλαστικής έναντι της βέλτιστης ιατρικής θεραπείας δείχνουν ότι και οι δύο διαδικασίες είναι σημαντικά καλύτερες όσον αφορά στην ανακούφιση από το άλγος και την κινητικότητα του ασθενούς.1,84-87 Παρά την έλλειψη τυχαιοποιημένων πολυκεντρικών μελετών μεταξύ σπονδυλοπλαστικής και κυφοπλαστικής, οι συστηματικές αναλύσεις της βιβλιογραφίας έχουν δείξει ότι και οι δύο διαδικασίες είναι εξίσου αποτελεσματικές στη διαχείριση του πόνου των οστεοπορωτικών συμπιεστικών καταγμάτων.84,86,88,89 Πρόσφατα δημοσιευμένα δεδομένα μιας μονοκεντρικής τυχαιοποιημένης μελέτης σπονδυλοπλαστικής έναντι κυφοπλαστικής με PMMA σε 100 ασθενείς με οστεοπορωτικά κατάγματα δεν έδειξε σημαντική διαφορά στην ανακούφιση από το άλγος μεταξύ των δύο τεχνικών μετά από 6 μήνες.90 Ωστόσο, υποστηρίζεται ότι η κυφοπλαστική σχετίζεται με λιγότερο από το ήμισυ του κινδύνου διαρροής τσιμέντου σε σύγκριση με τη σπονδυλοπλαστική.91,92 Από την άλλη πλευρά, οι βιβλιογραφικές ανασκοπήσεις αναφέρουν ότι δεν υπάρχει σημαντική διαφορά στην αποκατάσταση του σπονδυλικού ύψους μεταξύ των δύο τεχνικών.92,93 Ο κάθε ιατρός θα πρέπει να έχει επαρκή γνώση των πλεονεκτημάτων και των ελλείψεων και των δύο διαδικασιών και πρέπει να είναι εξίσου εκπαιδευμένος και επιδέξιος στην εκτέλεση καθεμιάς από αυτές σύμφωνα με τις κλινικές συνθήκες.
Οστεοπλαστικήκαι Οστική Κατάσταση
Η οστεοπλαστική του ιερού οστού (ιεροπλαστική), της κοτύλης (κοτυλιοπλαστική) και άλλων οστών που φέρουν βάρος (οστεοπλαστική γενικά) είναι διαδικαστικές παραλλαγές της διαδερμικής σπονδυλοπλαστικής που στοχεύουν στην ανακούφιση του άλγους με ενίσχυση με τσιμέντο κακοήθων οστεολυτικών βλαβών. Η αποτελεσματική διαχείριση των επώδυνων οστεοπορωτικών καταγμάτων ή των κακοήθων οστεολύσεων του ιερού οστού, του ηβικού άκρου, των ισχιακών φυματίων και της κοτύλης μπορεί να επιτευχθεί με απεικονιστικά καθοδηγούμενη έγχυση PMMA.18,19,94 Για την εξωσπονδυλική τσιμεντοπλαστική ή την οστεοπλαστική ισχύουν οι ίδιες αρχές όπως και στη διαδερμική σπονδυλοπλαστική. Η καθοδήγηση με αξονική τομογραφία υποστηρίζεται για την κοτυλιοπλαστική, ενώ η ακτινοσκοπική προσέγγιση bull’s-eye μπορεί να χρησιμοποιηθεί για την ηβική οστεοπλαστική. Οι πιθανές επιπλοκές περιλαμβάνουν τον τραυματισμό των ευαίσθητων γειτονικών νευροαγγειακών δομών που προκαλείται από το τσιμέντο.18 Επομένως, η εξοικείωση με τις τοπικές ανατομικές λεπτομέρειες και σχέσεις είναι κρίσιμη. Ενδαρθρική διαρροή τσιμέντου στην άρθρωση του ισχίου έχει επίσης αναφερθεί χωρίς κλινική σημασία.18,19 Η τσιμεντοπλαστική οστεολύσεων που βρίσκονται στη σύμφυση μακρών οστών που φέρουν βάρος όπως το μηριαίο οστό θα πρέπει να αποφεύγεται λόγω ανεπαρκούς οστικής στερέωσης και παθολογικών καταγμάτων. Ωστόσο, οι βλάβες της κεφαλής του μηριαίου οστού έχουν αντιμετωπιστεί επιτυχώς.19 Τα αναφερόμενα ποσοστά ανακούφισης του άλγους μετά από οστεοπλαστική για μεταστάσεις είναι συγκρίσιμα με αυτά της σπονδυλοπλαστικής.94
Σε περίπτωση επώδυνων επεκτατικών οστεολυτικών βλαβών της πυέλου, η οστεοπλαστική μπορεί να συνδυαστεί με σύγχρονες τεχνικές κρυο- ή θερμοπηξίας με στόχο την παρηγορητική οστική σταθεροποίηση μετά την καταστροφή του όγκου.30 Σε τέτοιες περιπτώσεις, οι ιατροί θα πρέπει να γνωρίζουν ότι οι χρόνοι ρύθμισης του PMMA εξαρτώνται από την τοπική θερμοκρασία του ιστού. Επομένως, υψηλότερες θερμοκρασίες περιβάλλοντος, όπως μετά από αφαίρεση ραδιοσυχνοτήτων ή μικροκυμάτων, θα επιταχύνουν τον πολυμερισμό και τη σκλήρυνση του υλικού. Αντίθετα, χαμηλότερες θερμοκρασίες, όπως κατά τη διάρκεια της κρυοκατάλυσης κάτω από το μηδέν, θα καθυστερήσουν σημαντικά την αντίδραση με αυξημένο κίνδυνο διαρροής.30 Ως εκ τούτου, συνιστάται η οστεοπλαστική να καθυστερεί για 2 έως 24 ώρες μετά την ολοκλήρωση των συνεδριών κρυοπηξίας ή θερμοπηξίας για να επιτραπεί η ομαλοποίηση των τοπικών θερμοκρασιών των ιστών.
Συμπέρασμα
Η διαδερμική οστεοπλαστική αποτελεί βασικό στοιχείο της σύγχρονης θεραπείας διαχείρισης του άλγους για τη θεραπεία οστεοπορωτικών καταγμάτων και επώδυνων οστικών μεταστάσεων. Οι ιατροί θα πρέπει να αξιολογούν προσεκτικά κάθε ασθενή και να έχουν ενδελεχή γνώση της ανατομίας και των διαφόρων διαφορετικών τεχνικών για την απεικονιστικά κατευθυνόμενη προσπέλαση της βλάβης και την έγχυση τσιμέντου. Η κατανόηση των ιδιαίτερων πλεονεκτημάτων και περιορισμών των διαφόρων σύγχρονων υλικών πλήρωσης είναι επίσης κρίσιμη για μια επιτυχημένη και απλή διαδικασία. Οι μελλοντικές εξελίξεις περιλαμβάνουν νέες μηχανικές συσκευές για την αποτελεσματική αποκατάσταση του σπονδυλικού ύψους, καθώς και την εισαγωγή οστεοαγώγιμων τσιμέντων που θα είναι σε θέση να προάγουν περισσότερο τη φυσιολογική επούλωση των οστών.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Peh WC, Munk PL, Rashid F, Gilula LA. Percutaneous vertebral augmentation: vertebroplasty, kyphoplasty and skyphoplasty. Radiol Clin North Am 2008; 46: 611–635 vii
- Gangi A, Sabharwal T, Irani FG, Buy X, Morales JP, Adam A; Standards of Practice Committee of the Society of Interventional Radiology. Quality assurance guidelines for percutaneous vertebroplasty. Cardiovasc Intervent Radiol 2006; 29: 173–178
- Gangi A, Guth S, Imbert JP, Marin H, Dietemann JL. Percutaneous vertebroplasty: indications, technique, and results. Radiographics 2003; 23: e10
- Gangi A, Wong L, Guth S, Dietermann J. Percutaneous vertebroplasty: indications, technique, and results. Semin Intervent Radiol 2002; 19: 265–270
- Galibert P, Deramond H, Rosat P, Le Gars D. [Preliminary note on the treatment of vertebral angioma by percutaneous acrylic vertebroplasty]. Neurochirurgie 1987; 33: 166–168
- Deramond H, Depriester C, Toussaint P, Galibert P. Percutaneous vertebroplasty. Semin Musculoskelet Radiol 1997; 1: 285–296
- Mathis JM, Barr JD, Belkoff SM, Barr MS, Jensen ME, Deramond H. Percutaneous vertebroplasty: a developing standard of care for vertebral compression fractures. AJNR Am J Neuroradiol 2001; 22: 373–381
- Murphy KJ, Deramond H. Percutaneous vertebroplasty in benign and malignant disease. Neuroimaging Clin N Am 2000; 10: 535–545
- McGraw JK, Cardella J, Barr JD, et al; SIR Standards of Practice Committee. Society of Interventional Radiology quality improvement guidelines for percutaneous vertebroplasty. J Vasc Interv Radiol 2003; 14: 827–831
- Black DM, Palermo L, Nevitt MC, Genant HK, Christensen L, Cummings SR; The Study of Osteoporotic Fractures Research Group. Defining incident vertebral deformity: a prospective comparison of several approaches. J Bone Miner Res 1999; 14: 90–101
- Stallmeyer MJ, Zoarski GH, Obuchowski AM. Optimizing patient selection in percutaneous vertebroplasty. J Vasc Interv Radiol 2003; 14: 683–696
- Riggs BL, Melton LJ III. The worldwide problem of osteoporosis: insights afforded by epidemiology. Bone 1995; 17(5 Suppl): 505S–511S
- Leech JA, Dulberg C, Kellie S, Pattee L, Gay J. Relationship of lung function to severity of osteoporosis in women. Am Rev Respir Dis 1990; 141: 68–71
- McGraw JK, Lippert JA, Minkus KD, Rami PM, Davis TM, Budzik RF. Prospective evaluation of pain relief in 100 patients undergoing percutaneous vertebroplasty: results and follow-up. J Vasc Interv Radiol 2002; 13(9 Pt 1): 883–886
- Zapałowicz K, Radek A, Błaszczyk B, Kozinski T, Zelechowski J. Percutaneous vertebroplasty with methyl methacrylate bone cement in the treatment of spinal angiomas and neoplasms. Ortop Traumatol Rehabil 2003; 5: 185–188
- McDonald RJ, Trout AT, Gray LA, Dispenzieri A, Thielen KR, Kallmes DF. Vertebroplasty in multiple myeloma: outcomes in a large patient series. AJNR Am J Neuroradiol 2008; 29: 642–648
- Cotten A, Deprez X, Migaud H, Chabanne B, Duquesnoy B, Chastanet P. Malignant acetabular osteolyses: percutaneous injection of acrylic bone cement. Radiology 1995; 197: 307–310
- Kelekis A, Lovblad KO, Mehdizade A, et al. Pelvic osteoplasty in osteolytic metastases: technical approach under fluoroscopic guidance and early clinical results. J Vasc Interv Radiol 2005; 16: 81–88
- Hierholzer J, Anselmetti G, Fuchs H, Depriester C, Koch K, Pappert D. Percutaneous osteoplasty as a treatment for painful malignant bone lesions of the pelvis and femur. J Vasc Interv Radiol 2003; 14: 773–777
- Cotten A, Deramond H, Cortet B, et al. Preoperative percutaneous injection of methyl methacrylate and N-butyl cyanoacrylate in vertebral hemangiomas. AJNR Am J Neuroradiol 1996;17: 137–142
- Cortet B, Cotten A, Deprez X, et al. [Value of vertebroplasty combined with surgical decompression in the treatment of aggressive spinal angioma. Apropos of 3 cases]. Rev Rhum Ed Fr 1994; 61: 16–22
- Gangi A, Guth S, Imbert JP, Marin H, Wong L. Percutaneous bone tumour management. Semin Intervent Radiol 2002; 19: 279–286
- Peh WC, Gelbart MS, Gilula LA, Peck DD. Percutaneous vertebroplasty: treatment of painful vertebral compression fractures with intraosseous vacuum phenomena. AJR Am J Roentgenol 2003; 180: 1411–1417
- Jang JS, Kim DY, Lee SH. Efficacy of percutaneous vertebroplasty in the treatment of intravertebral pseudarthrosis associated with noninfected avascular necrosis of the vertebral body. Spine (Phila Pa 1976) 2003; 28: 1588–1592
- Rami PM, McGraw JK, Heatwole EV, Boorstein JM. Percutaneous vertebroplasty in the treatment of vertebral body compression fracture secondary to osteogenesis imperfecta. Skeletal Radiol 2002; 31: 162–165
- Cardon T, Hachulla E, Flipo RM, et al. Percutaneous vertebroplasty with acrylic cement in the treatment of a Langerhans cell vertebral histiocytosis. Clin Rheumatol 1994; 13: 518–521
- Masala S, Pipitone V, Tomassini M, Massari F, Romagnoli A, Simonetti G. Percutaneous vertebroplasty in painful schmorl nodes. Cardiovasc Intervent Radiol 2006; 29: 97–101
- Cho DY, Lee WY, Sheu PC. Treatment of thoracolumbar burst fractures with polymethyl methacrylate vertebroplasty and short-segment pedicle screw fixation. Neurosurgery 2003; 53: 1354–1360; discussion 1360–1361
- Verlaan JJ, Dhert WJ, Oner FC. Vertebroplasty for burst fractures. J Neurosurg Spine 2005; 2: 398–399; author reply 399
- Sabharwal T, Katsanos K, Buy X, Gangi A. Image-guided ablation therapy of bone tumors. Semin Ultrasound CT MR 2009; 30: 78–90
- Zoarski GH, Snow P, Olan WJ, et al. Percutaneous vertebroplasty for osteoporotic compression fractures: quantitative prospective evaluation of long-term outcomes. J Vasc Interv Radiol 2002; 13(2 Pt 1): 139–148
- Laredo JD, Assouline E, Gelbert F, Wybier M, Merland JJ, Tubiana JM. Vertebral hemangiomas: fat content as a sign of aggressiveness. Radiology 1990; 177: 467–472
- Maynard AS, Jensen ME, Schweickert PA, Marx WF, Short JG, Kallmes DF. Value of bone scan imaging in predicting pain relief from percutaneous vertebroplasty in osteoporotic vertebral fractures. AJNR Am J Neuroradiol 2000; 21: 1807– 1812
- Mathis JM, Wong W. Percutaneous vertebroplasty: technical considerations. J Vasc Interv Radiol 2003; 14: 953–960
- White SM. Anaesthesia for percutaneous vertebroplasty. Anaesthesia 2002; 57: 1229–1230
- Della Puppa A, Andreula C, Frass M. Assisted sedation: a safe and easy method for pain-free percutaneous vertebroplasty. Minerva Anestesiol 2008; 74: 57–62
- Heran MK, Legiehn GM, Munk PL. Current concepts and techniques in percutaneous vertebroplasty. Orthop Clin North Am 2006; 37: 409–434, vii
- Gangi A, Kastler BA, Dietemann JL. Percutaneous vertebroplasty guided by a combination of CT and fluoroscopy. AJNR Am J Neuroradiol 1994; 15: 83–86
- Caudana R, Renzi Brivio L, Ventura L, Aitini E, Rozzanigo U, Barai G. CT-guided percutaneous vertebroplasty: personal experience in the treatment of osteoporotic fractures and dorsolumbar metastases. Radiol Med (Torino) 2008; 113: 114–133
- Vogl TJ, Proschek D, Schwarz W, Mack M, Hochmuth K. CT-guided percutaneous vertebroplasty in the therapy of vertebral compression fractures. Eur Radiol 2006; 16:7 97–803
- Appel NB, Gilula LA. ‘‘Bull’s-eye’’ modification for transpedicular biopsy and vertebroplasty. AJR Am J Roentgenol 2001; 177:1 387–1389
- Tong FC, Cloft HJ, Joseph GJ, Rodts GR, Dion JE. Transoral approach to cervical vertebroplasty for multiple myeloma. AJR Am J Roentgenol 2000; 175: 1322–1324
- Sachs DC, Inamasu J, Mendel EE, Guiot BH. Transoral vertebroplasty for renal cell metastasis involving the axis: case report. Spine (Phila Pa 1976) 2006; 31: E925–E928
- Mehdizade A, Payer M, Somon T, et al. Percutaneous vertebroplasty through a transdiscal access route after lumbar transpedicular instrumentation. Spine J 2004; 4: 475–479
- Evans AJ, Jensen ME, Kip KE, et al. Vertebral compression fractures: pain reduction and improvement in functional mobility after percutaneous polymethylmethacrylate vertebroplasty retrospective report of 245 cases. Radiology 2003; 226: 366–372
- Kim AK, Jensen ME, Dion JE, Schweickert PA, Kaufmann TJ, Kallmes DF. Unilateral transpedicular percutaneous vertebroplasty: initial experience. Radiology 2002; 222: 737– 741
- Minart D, Valle´e JN, Cormier E, Chiras J. Percutaneous coaxial transpedicular biopsy of vertebral body lesions during vertebroplasty. Neuroradiology 2001; 43: 409–412
- McGraw JK, Heatwole EV, Strnad BT, Silber JS, Patzilk SB, Boorstein JM. Predictive value of intraosseous venography before percutaneous vertebroplasty. J Vasc Interv Radiol 2002; 13(2 Pt 1): 149–153
- Vasconcelos C, Gailloud P, Beauchamp NJ, Heck DV, Murphy KJ. Is percutaneous vertebroplasty without pretreatment venography safe? Evaluation of 205 consecutive procedures AJNR Am J Neuroradiol 2002; 23: 913–917
- Munk PL, Rashid F, Heran MK, et al. Combined cementoplasty and radiofrequency ablation in the treatment of painful neoplastic lesions of bone. J Vasc Interv Radiol 2009; 20: 903–911
- Molloy S, Riley LH III, Belkoff SM. Effect of cement volume and placement on mechanical-property restoration resulting from vertebroplasty. AJNR Am J Neuroradiol 2005; 26: 401–404
- Belkoff SM, Mathis JM, Jasper LE, Deramond H. The biomechanics of vertebroplasty. The effect of cement volume on mechanical behavior. Spine (Phila Pa 1976) 2001; 26: 1537–1541
- Heini PF, Berlemann U. Bone substitutes in vertebroplasty. Eur Spine J 2001; 10(Suppl 2): S205–S213
- Lieberman IH, Togawa D, Kayanja MM. Vertebroplasty and kyphoplasty: filler materials. Spine J 2005; 5(6 Suppl): 305S–316S
- Deramond H, Wright NT, Belkoff SM. Temperature elevation caused by bone cement polymerization during vertebroplasty. Bone 1999; 25(2 Suppl): 17S–21S
- Pomrink GJ, DiCicco MP, Clineff TD, Erbe EM. Evaluation of the reaction kinetics of CORTOSS, a thermoset cortical bone void filler. Biomaterials 2003; 24: 1023–1031
- Erbe EM, Clineff TD, Gualtieri G. Comparison of a new bisphenol-a-glycidyl dimethacrylate-based cortical bone void filler with polymethyl methacrylate. Eur Spine J 2001; 10(Suppl 2): S147–S152
- Bohner M. Physical and chemical aspects of calcium phosphates used in spinal surgery. Eur Spine J 2001; 10(Suppl 2): S114–S121
- Hitchon PW, Goel V, Drake J, et al. Comparison of the biomechanics of hydroxyapatite and polymethylmethacrylate vertebroplasty in a cadaveric spinal compression fracture model. J Neurosurg 2001; 95(2 Suppl): 215–220
- Nussbaum DA, Gailloud P, Murphy K. A review of complications associated with vertebroplasty and kyphoplasty as reported to the Food and Drug Administration medical device related web site. J Vasc Interv Radiol 2004; 15: 1185–1192
- Yeom JS, Kim WJ, Choy WS, Lee CK, Chang BS, Kang JW. Leakage of cement in percutaneous transpedicular vertebroplasty for painful osteoporotic compression fractures. J Bone Joint Surg Br 2003; 85: 83–89
- Padovani B, Kasriel O, Brunner P, Peretti-Viton P. Pulmonary embolism caused by acrylic cement: a rare complication of percutaneous vertebroplasty. AJNR Am J Neuroradiol 1999; 20: 375–377
- Francois K, Taeymans Y, Poffyn B, Van Nooten G. Successful management of a large pulmonary cement embolus after percutaneous vertebroplasty: a case report. Spine (Phila Pa 1976) 2003; 28: E424–E425
- Choe DH, Marom EM, Ahrar K, Truong MT, Madewell JE. Pulmonary embolism of polymethyl methacrylate during percutaneous vertebroplasty and kyphoplasty. AJR Am J Roentgenol 2004; 183: 1097–1102
- Scroop R, Eskridge J, Britz GW. Paradoxical cerebral arterial embolization of cement during intraoperative vertebroplasty: case report. AJNR Am J Neuroradiol 2002; 23: 868–870
- Lin EP, Ekholm S, Hiwatashi A, Westesson PL. Vertebroplasty: cement leakage into the disc increases the risk of new fracture of adjacent vertebral body. AJNR Am J Neuroradiol 2004; 25: 175–180
- Alfonso Olmos M, Silva Gonza´lez A, Duart Clemente J, Villas Tome´ C. Infected vertebroplasty due to uncommon bacteria solved surgically: a rare and threatening life complication of a common procedure: report of a case and a review of the literature. Spine (Phila Pa 1976) 2006; 31: E770–E773
- Vasconcelos C, Gailloud P, Martin JB, Murphy KJ. Transient arterial hypotension induced by polymethylmethacrylate injection during percutaneous vertebroplasty. J Vasc Interv Radiol 2001; 12: 1001–1002
- Cloft HJ, Easton DN, Jensen ME, Kallmes DF, Dion JE. Exposure of medical personnel to methylmethacrylate vapor during percutaneous vertebroplasty. AJNR Am J Neuroradiol 1999; 20: 352–353
- Peh WC, Gilula LA, Peck DD. Percutaneous vertebroplasty for severe osteoporotic vertebral body compression fractures. Radiology 2002; 223: 121–126
- Cotten A, Boutry N, Cortet B, et al. Percutaneous vertebroplasty: state of the art. Radiographics 1998; 18: 311– 320; discussion 320–323
- Kallmes DF, Comstock BA, Heagerty PJ, et al. A randomized trial of vertebroplasty for osteoporotic spinal fractures. N Engl J Med 2009; 361: 569–579
- Buchbinder R, Osborne RH, Ebeling PR, et al. A randomized trial of vertebroplasty for painful osteoporotic vertebral fractures. N Engl J Med 2009; 361: 557–568
- Noonan P. Randomized vertebroplasty trials: bad news or sham news? AJNR Am J Neuroradiol 2009; 30: 1808–1809
- Baerlocher MO, Munk PL, Radvany MG, Murphy TP, Murphy KJ. Vertebroplasty, research design, and critical analysis. J Vasc Interv Radiol 2009; 20: 1277–1278
- Munk PL, Liu DM, Murphy KP, Baerlocher MO. Effectiveness of vertebroplasty: a recent controversy. Can Assoc Radiol J 2009; 60: 170–171
- Brown DB, Gilula LA, Sehgal M, Shimony JS. Treatment of chronic symptomatic vertebral compression fractures with percutaneous vertebroplasty. AJR Am J Roentgenol 2004; 182: 319–322
- Voormolen MH, Lohle PN, Juttmann JR, van der Graaf Y, Fransen H, Lampmann LE. The risk of new osteoporotic vertebral compression fractures in the year after percutaneous vertebroplasty. J Vasc Interv Radiol 2006; 17: 71–76
- Lin WC, Lee YC, Lee CH, et al. Refractures in cemented vertebrae after percutaneous vertebroplasty: a retrospective analysis. Eur Spine J 2008; 17: 592–599
- Trout AT, Kallmes DF. Does vertebroplasty cause incident vertebral fractures? A review of available data AJNR Am J Neuroradiol 2006; 27: 1397–1403
- Lieberman IH, Dudeney S, Reinhardt MK, Bell G. Initial outcome and efficacy of ‘‘kyphoplasty’’ in the treatment of painful osteoporotic vertebral compression fractures. Spine (Phila Pa 1976) 2001; 26: 1631–1638
- Phillips FM, Ho E, Campbell-Hupp M, et al. Early radiographic and clinical results of balloon kyphoplasty for the treatment of osteoporotic vertebral compression fractures. Spine (Phila Pa 1976) 2003; 28: 2260–2265
- Rao RD, Singrakhia MD. Painful osteoporotic vertebral fracture. Pathogenesis, evaluation, and roles of vertebroplasty and kyphoplasty in its management. J Bone Joint Surg Am 2003; 85-A: 2010–2022
- Mathis JM, Ortiz AO, Zoarski GH. Vertebroplasty versus kyphoplasty: a comparison and contrast. AJNR Am J Neuroradiol 2004; 25: 840–845
- Voormolen MH, Mali WP, Lohle PN, et al. Percutaneous vertebroplasty compared with optimal pain medication treatment: short-term clinical outcome of patients with subacute or chronic painful osteoporotic vertebral compression fractures. The VERTOS study. AJNR Am J Neuroradiol 2007; 28: 555–560
- McGirt MJ, Parker SL, Wolinsky JP, Witham TF, Bydon A, Gokaslan ZL. Vertebroplasty and kyphoplasty for the treatment of vertebral compression fractures: an evidencedbased review of the literature. Spine J 2009; 9: 501–508
- Wardlaw D, Cummings SR, Van Meirhaeghe J, et al. Efficacy and safety of balloon kyphoplasty compared with non-surgical care for vertebral compression fracture (FREE): a randomised controlled trial. Lancet 2009; 373: 1016–1024
- Gill JB, Kuper M, Chin PC, Zhang Y, Schutt RJr. Comparing pain reduction following kyphoplasty and vertebroplasty for osteoporotic vertebral compression fractures. Pain Physician 2007; 10: 583–590
- Taylor RS, Taylor RJ, Fritzell P. Balloon kyphoplasty and vertebroplasty for vertebral compression fractures: a comparative systematic review of efficacy and safety. Spine (Phila Pa 1976) 2006; 31: 2747–2755
- Liu JT, Liao WJ, Tan WC, et al. Balloon kyphoplasty versus vertebroplasty for treatment of osteoporotic vertebral compression fracture: a prospective, comparative, and randomized clinical study. Osteoporos Int 2010; 21: 359–364
- Eck JC, Nachtigall D, Humphreys SC, Hodges SD. Comparison of vertebroplasty and balloon kyphoplasty for treatment of vertebral compression fractures: a meta-analysis of the literature. Spine J 2008; 8: 488–497
- Cloft HJ, Jensen ME. Kyphoplasty: an assessment of a new technology. AJNR Am J Neuroradiol 2007; 28: 200–203
- Hulme PA, Krebs J, Ferguson SJ, Berlemann U. Vertebroplasty and kyphoplasty: a systematic review of 69 clinical studies. Spine (Phila Pa 1976) 2006; 31: 1983–2001
- Whitlow CT, Mussat-Whitlow BJ, Mattern CW, Baker MD, Morris PP. Sacroplasty versus vertebroplasty: comparable clinical outcomes for the treatment of fracture-related pain. AJNR Am J Neuroradiol 2007; 28: 1266–1270