Hasan Ahmad Hasan Albitar,1 Narjust Duma,2 Konstantinos Leventakos,2 and Alice Gallo De Moraes3
1 Department of Internal Medicine, Mayo Clinic, Rochester, Minnesota, USA, 2 Division of Medical Oncology, Mayo Clinic, Rochester, Minnesota, USA, 3 Division of Pulmonary and Critical Care, Mayo Clinic, Rochester, Minnesota, USA
Ιστορικό. Οι ανοσοποιητικοί αναστολείς ελέγχου (ICI) έχουν αλλάξει το τοπίο όσον αφορά τη θεραπεία ορισμένων καρκίνων. Οι ανοσοσχετιζόμενες ανεπιθύμητες ενέργειες (irAEs) έχουν εμφανιστεί ως ένα σοβαρό κλινικό πρόβλημα με τη χρήση των ICI.
Μέθοδοι. Εξετάστηκαν όλοι οι ογκολογικοί ασθενείς που διαγνώστηκαν με πνευμονικές επιπλοκές δευτερογενώς από τους ICI στην Mayo Clinic Rochester από την 1η Ιανουαρίου 2012 έως την 31η Δεκεμβρίου 2018. Αναλύθηκαν τα δημογραφικά στοιχεία, οι συννοσηρότητες, το κάπνισμα και το ογκολογικό ιστορικό.
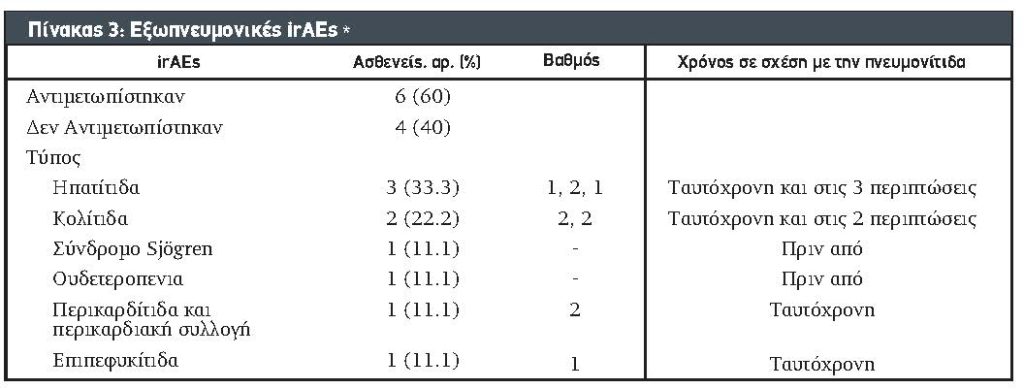
Αποτελέσματα. Συνολικά 10 ασθενείς εμφάνισαν πνευμονικές επιπλοκές δευτερογενώς από τους ICI. Επτά ασθενείς ήταν άρρενες (70%) και η διάμεση ηλικία κατά τη διάγνωση ήταν 61,5 έτη (IQR 55,8-69,3). Όλοι οι ασθενείς είχαν νόσο σταδίου IV. Το μελάνωμα ήταν η πιο κοινή κακοήθεια. Επτά (70%) ασθενείς είχαν θετικό ιστορικό καπνίσματος και 6 (60%) ήταν παχύσαρκοι (ΔΜΣ> 30). Οι περισσότερες περιπτώσεις ήταν πνευμονίτιδα βαθμού 2 (70%). Ένας ασθενής με πνευμονίτιδα βαθμού 4 είχε ανάγκη από ενδοτραχειακή διασωλήνωση και παρατεταμένη χρήση συστηματικών κορτικοστεροειδών (> 30 ημέρες). Οκτώ (80%) ασθενείς έλαβαν προηγούμενη θεραπεία με ακτινοβολία. Ο διάμεσος χρόνος από την έναρξη της διάγνωσης ICI έως τη διάγνωση της πνευμονίτιδας ήταν 3,5 μήνες.
Συμπέρασμα. Το μελάνωμα ήταν η πιο συχνή κακοήθεια. Η πλειονότητα των ασθενών είχε πνευμονίτιδα βαθμού 2 και απαιτούσε θεραπεία με στεροειδή και όλοι οι ασθενείς που ενόσησαν από πνευμονίτιδα η οποία σχετίζετο με ICI είχαν κακοήθεια σταδίου IV. Οι πιθανοί παράγοντες κινδύνου περιελάμβαναν ιστορικό καπνίσματος, προηγούμενη ακτινοθεραπεία, παχυσαρκία και προχωρημένο στάδιο κατά την έναρξη της ICI. Τα εξωπνευμονικά irAEs είναι κοινά σε ασθενείς με πνευμονίτιδα.
1. Εισαγωγή
Ο προγραμματισμένος θάνατος 1 (PD-1) και τα προσδέματά του (PD-L1 και PD-L2), εκτός από την κυτταροτοξική πρωτεΐνη 4 που σχετίζεται με τα Τ-λεμφοκύτταρα (CTLA-4), είναι αρνητικοί ρυθμιστές της ενεργοποίησης των Τ-κυττάρων που παίζουν αναπόσπαστο ρόλος στην ανοσολογική ομοιόσταση.1,2 Η ανάπτυξη φαρμακευτικών αντι-PD-1 και PD-L1 αντισωμάτων και μονοκλωνικών αντισωμάτων που στοχεύουν στο CTLA-4 έχει αλλάξει το τοπίο στη θεραπεία ορισμένων καρκίνων και βελτίωσε την επιβίωση από μήνες έως την πλήρη ύφεση σε ορισμένες περιπτώσεις.3 Ωστόσο, με την ανάπτυξη αυτών των νέων παραγόντων ήρθε μια νέα ομάδα διακριτικών ανοσολογικών ανεπιθύμητων ενεργειών οι οποίες πιστεύεται ότι σχετίζονται με την απελευθέρωση κυτοκίνης, η οποία κυμαίνεται από παροδική και καλοήθης έως σοβαρή και θανατηφόρος.4,5 Αυτές αναφέρονται ως ανεπιθύμητες ενέργειες που σχετίζονται με το ανοσοποιητικό σύστημα (irAEs). Τα στοιχεία δείχνουν ότι η χρήση των ICI σχετίζεται με αυξημένο κίνδυνο πνευμονίτιδας όλων των βαθμών σε σύγκριση με άλλους συμβατικούς χημειοθεραπευτικούς παράγοντες.6 Τα πνευμονικά irAEs παρουσιάζουν ιδιαίτερο ενδιαφέρον επειδή μπορούν να οδηγήσουν σε εισαγωγή σε μονάδας εντατικής θεραπείας (ΜΕΘ), ενδοτραχειακή διασωλήνωση και σε σοβαρές περιπτώσεις στο θάνατο.
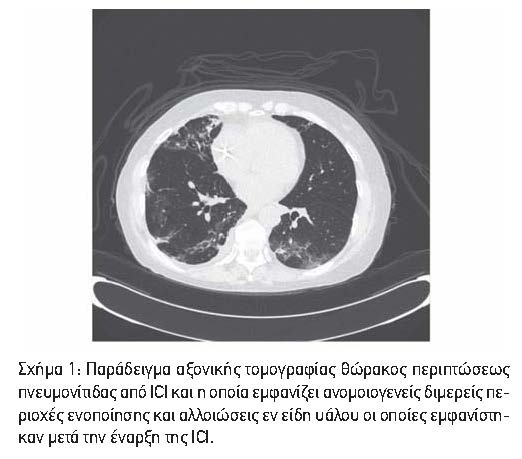
Τα ευρήματα της υπολογιστικής τομογραφίας που απαντώνται συνήθως περιλαμβάνουν διμερείς ενοποιητικές αλλαγές και αλλοιώσεις εν είδη υάλου (Σχήμα 1), κυρίως στην περιφερειακή κατανομή, αλλά και με ενδοσφαιρική πάχυνση του διαφράγματος στη βασική κατανομή.7 Ωστόσο, τα ευρήματα απεικόνισης είναι μη ειδικά και η διάκριση της ICI-πνευμονίτιδας από την πνευμονίτιδα που προκαλείται από ακτινοβολία και πνευμονικές λοιμώξεις μπορεί να είναι δύσκολη. Η διακοπή της θεραπείας με ICI από μόνη της είναι επαρκής σε περιπτώσεις ήπιας πνευμονίτιδας και τα κορτικοστεροειδή χρησιμοποιούνται συνήθως για τη θεραπεία πιο σοβαρών, συμπτωματικών περιπτώσεων.8,9 Τα περισσότερα irAEs ανταποκρίνονται στα κορτικοστεροειδή και υποχωρούν εντός 3 μηνών.10
Στόχος μας στην παρούσα μελέτη είναι να παρουσιάσουμε την κλινική εμπειρία του κέντρου μας σε περιστατικά πνευμονίτιδας προκαλούμενης από ICI, να αναφέρουμε τα βασικά χαρακτηριστικά των ασθενών σε δείγμα 10 ασθενών με πνευμονίτιδα η οποία προκαλείται από ICI και να συγκρίνουμε το ποσοστό αυτών των επιπλοκών με τα δεδομένα που δημοσιεύθηκαν σε προηγούμενες αναφορές.
2. Υλικά και Μέθοδος
2.1. Ασθενείς. Τα κριτήρια ένταξης στη μελέτη καθόρισαν την ηλικία των ασθενών άνω των 18 ετών, ιστολογικά επιβεβαιωμένη διάγνωση κακοήθειας για την οποία η θεραπεία με ICI έχει εγκριθεί από την US Food and Drug Administration (FDA), παρακολούθηση άνω των 3 μηνών στη Mayo Clinic στο Ρότσεστερ της Μινεσότα και λήψη τουλάχιστον 1 δόσης ICI. Αποκλείστηκαν όλοι οι ασθενείς με αιματολογική κακοήθεια, αυτοί χωρίς συγκατάθεση στην έρευνα και ασθενείς χωρίς στενή παρακολούθηση στη Mayo Clinic στο Ρότσεστερ.
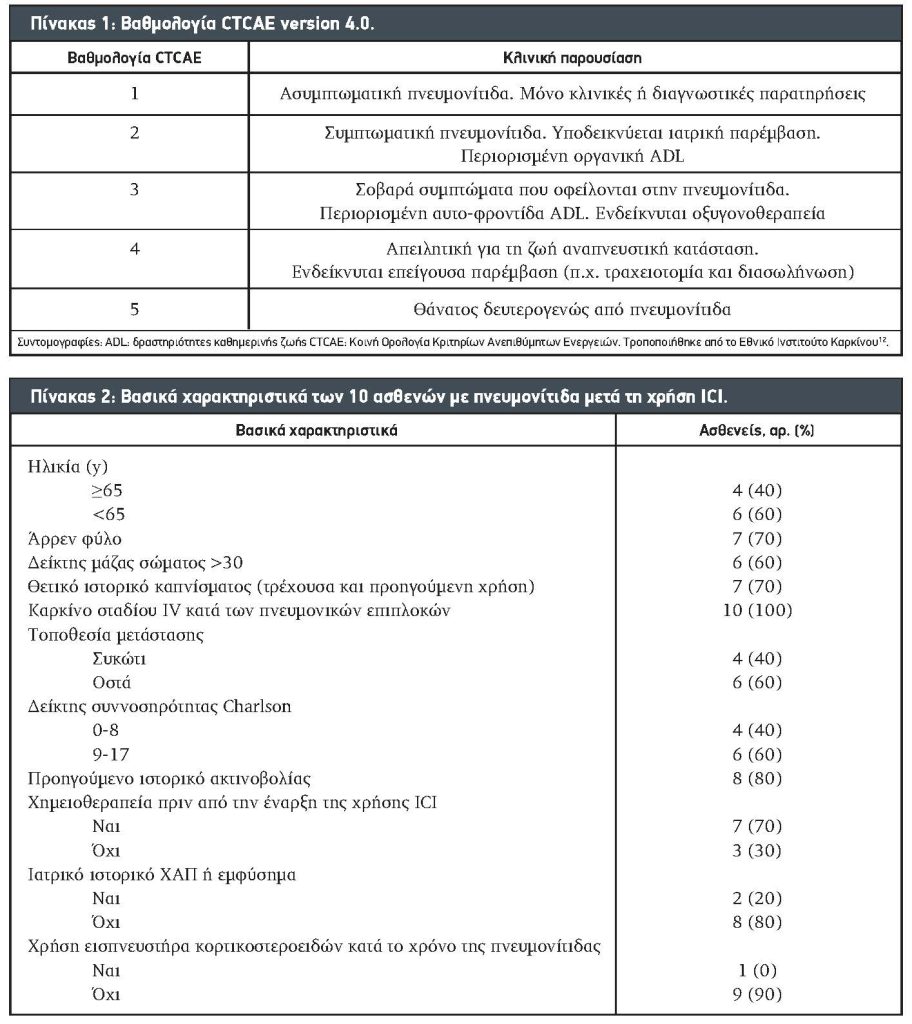
2.2. Συλλογή Δεδομένων. Χρησιμοποιώντας το ηλεκτρονικό σύστημα ιατρικών αρχείων, εντοπίσαμε ασθενείς με πνευμονίτιδα προκαλούμενη από ICI στην πανεπιστημιούπολη της Mayo Clinic στο Rochester από την 1η Ιανουαρίου 2012 έως την 31η Δεκεμβρίου 2018. Αυτή η μελέτη εγκρίθηκε από το Mayo Clinic’s Institutional Review Board. Τα περιστατικά αναθεωρήθηκαν από τουλάχιστον 1 ακτινολόγο και 1 πνευμονολόγο και ταξινομήθηκαν και βαθμολογήθηκαν σύμφωνα με τα κριτήρια κοινής ορολογίας του National Cancer Institute Common Terminology Criteria for Adverse Effects version 4.0 (Πίνακας 1).11,12
3. Αποτελέσματα
3.1. Χαρακτηριστικά Ασθενούς Βασικής Γραμμής. Ταυτοποιήθηκαν δέκα ασθενείς με μέση ηλικία 61,5 έτη (IQR 55,8-69,3). Τα βασικά χαρακτηριστικά συνοψίζονται στον Πίνακα 2.
3.2. Πρωτοπαθής Κακοήθεια Ασθενών με Πνευμονίτιδα Προκαλούμενη από ICI. Το μελάνωμα ήταν η πιο συχνή κακοήθεια (n = 5, 50%) ακολουθούμενη από τον μικροκυτταρικό καρκίνο του πνεύμονα (SCLC) (n = 1, 10%), καρκίνωμα ατρακτοειδών κυττάρων (n = 1, 10%), νευροενδοκρινικό όγκο της επιγλωττίδας (n = 1, 10%), αδενοκαρκίνωμα πνευμόνων (n = 1, 10%) και καρκίνωμα κυττάρων Merkel (n = 1, 10%). Όλοι οι ασθενείς με πνευμονίτιδα είχαν καρκίνο σταδίου IV κατά την έναρξη της ανοσοθεραπείας. Οι πιο συχνές τοποθεσίες μετάστασης ήταν το ήπαρ και τα οστά οι οποίες παρατηρήθηκαν σε 4 (40%) και 6 ασθενείς (60%), αντίστοιχα.
3.3. Βαθμός ICI και Πνευμονίτιδα. Οι ICIκατά τη στιγμή της πνευμονίτιδας ήταν η pembrolizumab (n = 5, 45,5%), nivolumab (n = 3, 27,3%), ipilimumab (n = 2, 18,2%) και atezolizumab (n = 1, 9%), και 1 ασθενής έκανε διπλή θεραπεία με ipilimumab και nivolumab. Δύο ασθενείς (20%) είχαν πνευμονίτιδα βαθμού 1, επτά (70%) είχαν βαθμού 2 και 1 (10%) είχε πνευμονίτιδα βαθμού 4.
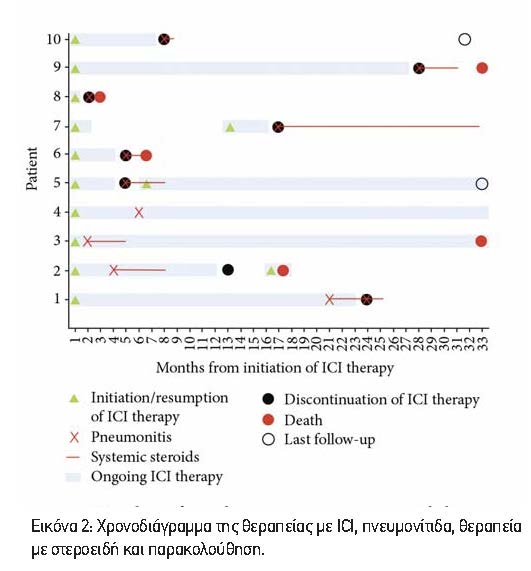
3.4. irAEs με Πνευμονίτιδα Προκαλούμενη από ICI. Εκτός από την πνευμονίτιδα, 6 ασθενείς (60%) είχαν και άλλα irAEs. Τα πιο συχνά συναντούμενα μη πνευμονικά irAEs ήταν αυτοάνοση ηπατίτιδα και κολίτιδα. Τα δεδομένα για τα άλλα irAEs συνοψίζονται στον Πίνακα 3.
3.5. Αποτελέσματα Μετά τη Θεραπεία ICI. Πέντε ασθενείς (50%) είχαν απόκριση μετά την έναρξη της θεραπείας με ICI, τρείς (30%) είχαν εξέλιξη της νόσου και δύο (20%) είχαν μικτή απόκριση. Ο μέσος χρόνος (IQR) από την έναρξη της θεραπείας ICI έως τη διάγνωση της πνευμονίτιδας ήταν 3,5 μήνες (εύρος, 1,5-28). Η βρογχοκυψελιδική έκπλυση (BAL) πραγματοποιήθηκε για 4 ασθενείς (40%) και έδειξε φλεγμονώδη κυψελιδίτιδα επικρατούσα σε μακροφάγα σε τρείς (75%) ασθενείς. Μικροβιολογικές μελέτες για δείγματα BAL για ιούς, βακτήρια, μύκητες και παράσιτα ήταν αρνητικές μεταξύ όλων των ασθενών που υποβλήθηκαν σε BAL.
Οκτώ ασθενείς (80%) χρειάστηκαν συστηματικά κορτικοστεροειδή για τη θεραπεία πνευμονικών και / ή εξωπνευμονικών irAEs. Η θεραπεία με ICI διακόπηκε για 8 ασθενείς (80%) και κατόπιν συνεχίστηκε για 5 (50%) μετά την θεραπεία της πνευμονίτιδας. Ένας ασθενής με πνευμονίτιδα βαθμού 1 συνέχισε με ICI χωρίς διακοπή ή στεροειδή και 1 με πνευμονίτιδα βαθμού 2 υποβλήθηκε σε θεραπεία μόνο με συγκράτηση φαρμάκου. Όλοι οι άλλοι ασθενείς υποβλήθηκαν σε θεραπεία με συστηματικά κορτικοστεροειδή με την πρεδνιζόνη να είναι το κύριο κορτικοστεροειδές που χρησιμοποιήθηκε. Η διάρκεια της θεραπείας με κορτικοστεροειδή κυμαινόταν από 30 έως 360 ημέρες. Ο ασθενής με πνευμονίτιδα βαθμού 4 χρειάστηκε ενδοτραχειακή διασωλήνωση και παρατεταμένη θεραπεία με κορτικοστεροειδεί (>30 ημέρες). Κανένας από τους ασθενείς δεν έλαβε ανοσοκατασταλτική θεραπεία εκτός από τα κορτικοστεροειδή.
Κατά τη διάρκεια της παρακολούθησης, 5 ασθενείς (50%) απέθαναν. Το πρόωρο ποσοστό θνησιμότητας εντός ενός μηνός από πνευμονίτιδα ήταν 10%. Μεταξύ των ασθενών που απέθαναν, ένας είχε πνευμονίτιδα βαθμού 4 και τέσσερις είχαν πνευμονίτιδα βαθμού 2. Μεταξύ των πέντε ασθενών που ήταν ακόμη εν ζωή στη συμπλήρωση της μελέτης, τρείς ασθενείς είχαν πνευμονίτιδα βαθμού 2 και δύο ασθενείς πνευμονίτιδα βαθμού 1. Η αιτία θανάτου σχετίστηκε άμεσα με την πνευμονίτιδα μόνο σε 1 ασθενή. Οι λεπτομέρειες συνοψίζονται στο Σχήμα 2.
4. Συζήτηση
Η αναφερόμενη συνολική επίπτωση πνευμονίτιδας όλων των βαθμών κυμαινόταν από 1,3% έως 11%.13–16 Σύμφωνα με τους Nishino και συνεργάτες16, οι ασθενείς με πνευμονίτιδα παρουσιάζουν συχνότερα βήχα (60%), δύσπνοια (55%) και ολιγότερο συχνά πυρετό. Η διάγνωση της πνευμονίτιδας μπορεί να αποτελεί πρόκληση για τους ιατρούς, ειδικά λόγω της ομοιότητας στην παρουσίαση μεταξύ της πνευμονίτιδας που προκαλείται από ICI, της πνευμονίτιδας από ακτινοβολία, της πνευμονίας και της κακοήθους διήθησης των πνευμόνων.17
Σε αυτήν τη μελέτη, παρουσιάσαμε την εμπειρία του κέντρου μας σε ασθενείς με πνευμονίτιδα προκαλούμενη από ICI και διαπιστώσαμε ότι όλοι οι ασθενείς είχαν κακοήθεια σταδίου IV. Το μελάνωμα ήταν η πιο κοινή κακοήθεια, η πλειονότητα των περιπτώσεων ήταν πνευμονίτιδα βαθμού 2 και οι περισσότεροι αντιμετωπίστηκαν με στεροειδή. Βρήκαμε επίσης ένα πρώιμο ποσοστό θνησιμότητας 10% που ήταν συγκρίσιμο με αυτό που παρατηρήθηκε από τους Delaunay και συνεργάτες18 (9,4%). Ωστόσο, και οι δύο μελέτες έδειξαν χαμηλότερο ποσοστό θνησιμότητας από προηγούμενες μελέτες που ανέφεραν ποσοστό θνησιμότητας από 30% έως 36%.19-21 Το χαμηλότερο ποσοστό θνησιμότητας της μελέτης μας μπορεί να σχετίζεται με την αυξημένη ευαισθητοποίηση των ιατρών και την έγκαιρη ανίχνευση και θεραπεία της πνευμονίτιδας σε σύγκριση με τις προηγούμενες μελέτες και θα μπορούσε να συγχέεται από τον χαμηλό αριθμό ασθενών.
Αναφέρουμε επίσης έναν μέσο χρόνο μεταξύ της έναρξης της θεραπείας με ICI και της ανάπτυξης πνευμονίτιδας 3,5 μηνών, ο οποίος είναι συγκρίσιμος με προηγούμενες μελέτες. Σύμφωνα με τους Brahmer και συνεργάτες14, ο μέσος χρόνος για την έναρξη της πνευμονίτιδας που σχετίζεται με τη θεραπεία ήταν 15,1 εβδομάδες. Σύμφωνα με τους Borghaei και συνεργάτες22, ο μέσος χρόνος έναρξης των πνευμονικών συμβάντων ήταν 31,1 εβδομάδες. Ο Fujimoto και συνεργάτες19 παρατήρησε διάμεσο χρόνο 1,3 μηνών μεταξύ της έναρξης της συστημικής αντικαρκινικής θεραπείας και της έναρξης της πνευμονίτιδας. Ομοίως, ο Delaunay και συνεργάτες18 έδειξαν ότι οι περισσότερες από τις περιπτώσεις πνευμονίτιδας της μελέτης τους εμφανίστηκαν κατά τους πρώτους μήνες της θεραπείας, με μέσο χρόνο έως την έναρξη 2,3 μήνες. Ο Naidoo και συνεργάτες23 ανέφερε ότι ο μέσος χρόνος για την έναρξη της πνευμονίτιδας ήταν 2,8 μήνες.
Ένα ενδιαφέρον εύρημα στη μελέτη μας ήταν ότι ένα σημαντικό ποσοστό ασθενών με πνευμονίτιδα (60%) ήταν παχύσαρκοι. Ωστόσο, η αιτιότητα δεν μπορεί να προσδιοριστεί χρησιμοποιώντας τον τρέχοντα σχεδιασμό μελέτης και τον μικρό αριθμό ασθενών. Οι ερευνητές έχουν δείξει προηγουμένως ότι ο λιπώδης ιστός παράγει και απελευθερώνει διάφορους προφλεγμονώδεις παράγοντες, συμπεριλαμβανομένων των κυτοκινών όπως ο παράγοντας νέκρωσης όγκων-α και της ιντερλευκίνης-6 (IL-6).24 Τα στοιχεία αναφέρουν επίσης μια θετική συσχέτιση μεταξύ των επιπέδων IL-6 στον ορό και του δείκτη μάζας σωματικού λίπους.25 Επιπλέον, ο παράγοντας νέκρωσης όγκου-α υπερεκφράζεται στον λιπώδη ιστό παχύσαρκων ανθρώπων.26,27 Αυτές οι κυτοκίνες πυροδοτούν την παραγωγή παραγόντων οξείας φάσης, όπως C-αντιδρώσα πρωτεΐνη, αναστολέα ενεργοποιητή πλασμινογόνου-1 και αμυλοειδές-Α ορού.28 Ως εκ τούτου, η παχυσαρκία έχει θεωρηθεί προφλεγμονώδης κατάσταση λόγω του αυξημένου επιπέδου φλεγμονωδών κυτοκινών.29
Η παρούσα μελέτη έχει περιορισμούς. Πρώτον, αναγνωρίζουμε ότι η μελέτη έχει μια μικρή ομάδα ασθενών. Ωστόσο, ο μικρός αριθμός ασθενών που εντοπίστηκαν σε αυτή τη μελέτη σχετίζεται με το γεγονός ότι οι περισσότεροι ασθενείς λαμβάνουν τη θεραπεία τους σε εγκαταστάσεις αλλού και επισκέπτονται τη Mayo Clinic για δεύτερη γνώμη ή για επαναληπτικές απεικονιστικές εξετάσεις κάθε 3 μήνες μόνο. Αυτό το πρόγραμμα περιορίζει την ποιότητα των δεδομένων και μειώνει τη δυνατότητα καταγραφής του ποσοστού των πνευμονικών επιπλοκών με ακρίβεια λόγω της μη πρόσβασης στα εξωτερικά αρχεία. Δεύτερον, ο αναδρομικός σχεδιασμός περιορίζει τη μελέτη. Ωστόσο, στόχος μας ήταν να αναφέρουμε την εμπειρία του κέντρου μας σε περιστατικά πνευμονίτιδας προκαλούμενης από ICI και να αναφέρουμε τα χαρακτηριστικά των ασθενών που εμφάνισαν πνευμονίτιδα, για τους οποίους ο αναδρομικός σχεδιασμός είναι επαρκής. Τρίτον, η διάγνωση της πνευμονίτιδας καθορίστηκε βάσει της γνώμης των εμπειρογνωμόνων μετά την ανασκόπηση των απεικονιστικών ευρημάτων. Αναγνωρίζουμε ότι η απόδοση αιτιότητας στη χρήση ICI είναι πάντα μια πρόκληση λόγω της έλλειψης καθολικών διαγνωστικών κριτηρίων και τυπικών διαγνωστικών δοκιμών. Ωστόσο, πραγματοποιήσαμε μια σειρά δοκιμών – συμπεριλαμβανομένων ενδεικτικά της βρογχοσκόπησης με BAL – για να αποκλείσουμε άλλες αιτίες όπως λοιμώξεις και διείσδυση όγκων στους πνεύμονες. Η δοκιμή BAL πραγματοποιήθηκε για το 40% των ασθενών μας. Το ποσοστό αυτό έρχεται σε αντίθεση με προηγούμενες μελέτες, οι οποίες δεν περιελάμβαναν δοκιμές BAL στην αξιολόγηση ύποπτων περιπτώσεων πνευμονίτιδας.20,29 Επιπλέον, τα κλινικά, εργαστηριακά, ακτινογραφικά και παθολογικά χαρακτηριστικά των ασθενών της μελέτης αναθεωρήθηκαν εκτενώς από ειδικούς στον τομέα. Τέλος, παρόλο που αναφέρουμε πολλά ευρήματα σε ασθενείς με πνευμονίτιδα σε αυτήν τη μελέτη, συμπεριλαμβανομένου του υψηλού ποσοστού παχυσαρκίας, η αιτιότητα δεν μπορεί να εξακριβωθεί δεδομένου του τρέχοντος σχεδιασμού της μελέτης.
5. Συμπεράσματα
Το μελάνωμα ήταν η πιο συχνή κακοήθεια που σχετίζεται με πνευμονίτιδα, η πλειονότητα των ασθενών είχε πνευμονίτιδα βαθμού 2 και χρειάστηκε θεραπεία με στεροειδή και όλοι οι ασθενείς που επλήγησαν από πνευμονίτιδα η οποία σχετίζεται με ICI είχαν κακοήθεια σταδίου IV. Οι πιθανοί παράγοντες κινδύνου περιελάμβαναν ιστορικό καπνίσματος, προηγούμενη ακτινοθεραπεία, παχυσαρκία και προχωρημένο στάδιο κατά την έναρξη της ICI. Οι εξωπνευμονικές irAE είναι συχνές σε ασθενείς με πνευμονίτιδα.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Y. Dong, Q. Sun, and X. Zhang, “PD-1 and its ligands are important immune checkpoints in cancer,” Oncotarget, vol. 8, no. 2, pp. 2171–2186, 2017.
- L. S. Walker and D. M. Sansom, “The emerging role of CTLA4 as a cell-extrinsic regulator of T cell responses,” Nature Reviews. Immunology, vol. 11, no. 12, pp. 852–863, 2011.
- C. Robert, A. Ribas, O. Hamid et al., “Durable complete response after discontinuation of pembrolizumab in patients with metastatic melanoma,” Journal of Clinical Oncology, vol. 36, no. 17, pp. 1668–1674, 2018.
- D. Y. Wang, J.-E. Salem, J. V. Cohen et al., “Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta-analysis,” JAMA Oncology, vol. 4, no. 12, pp. 1721–1728, 2018.
- R. N. Schwartz, L. Stover, and J. P. Dutcher, “Managing toxicities of high-dose interleukin-2,” Oncology, vol. 16, 11 Suppl 13, pp. 11–20, 2002.
- O. Abdel-Rahman and M. Fouad,“Risk of pneumonitis in cancer patients treated with immune checkpoint inhibitors: a meta-analysis,” Therapeutic Advances in Respiratory Disease, vol. 10, no. 3, pp. 183–193, 2016.
- S. H. Tirumani, N. H. Ramaiya, A. Keraliya et al.,“Radiographic profiling of immune-related adverse events in advanced melanoma patients treated with ipilimumab,” Cancer Immunology Research, vol. 3, no. 10, pp. 1185–1192, 2015.
- J. D. Possick, “Pulmonary toxicities from checkpoint immunotherapy for malignancy,” Clinics in Chest Medicine, vol. 38, no. 2, pp. 223–232, 2017.
- S. Champiat, O. Lambotte, E. Barreau et al., “Management of immune checkpoint blockade dysimmune toxicities: a collaborative position paper,” Annals of Oncology, vol. 27, no. 4, pp. 559–574, 2016.
- J. S. Weber, R. Dummer, V. de Pril, C. Lebbé, F. S. Hodi, and for the MDX010-20 Investigators, “Patterns of onset and resolution of immune-related adverse events of special interest with ipilimumab: detailed safety analysis from a phase 3 trial in patients with advanced melanoma,” Cancer, vol. 119, no. 9, pp. 1675–1682, 2013.
- M. Selman, A. Pardo, and T. E. King Jr., “Hypersensitivity pneumonitis: insights in diagnosis and pathobiology,” American Journal of Respiratory and Critical Care Medicine, vol. 186, no. 4, pp. 314–324, 2012.
- National Cancer Institute Common Terminology Criteria for Adverse Events (CTCAE), 2018, November 2018, https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm#ctc_40.
- E. D. Kwon, C. G. Drake, H. I. Scher et al., “Ipilimumab versus placebo after radiotherapy in patients with metastatic castration-resistant prostate cancer that had progressed after docetaxel chemotherapy (CA184-043): a multicentre, randomised, double-blind, phase 3 trial,” The Lancet Oncology, vol. 15, no. 7, pp. 700–712, 2014.
- J. Brahmer, K. L. Reckamp, P. Baas et al., “Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer,” The New England Journal of Medicine, vol. 373, no. 2, pp. 123–135, 2015.
- M. Nishino, A. Giobbie-Hurder, H. Hatabu, N. H. Ramaiya, and F. S. Hodi, “Incidence of programmed cell death 1 inhibitor-related pneumonitis in patients with advanced cancer: a systematic review and meta-analysis,” JAMA Oncology, vol. 2, no. 12, pp. 1607–1616, 2016.
- M. Nishino, N. H. Ramaiya, M. M. Awad et al., “PD-1 inhibitor-related pneumonitis in advanced cancer patients: radiographic patterns and clinical course,” Clinical Cancer Research, vol. 22, no. 24, pp. 6051–6060, 2016.
- K. S. Shohdy and O. Abdel-Rahman, “Risk of pneumonitis with different immune checkpoint inhibitors in NSCLC,” Annals of Translational Medicine, vol. 5, no. 17, p. 365, 2017.
- M. Delaunay, J. Cadranel, A. Lusque et al., “Immune-checkpoint inhibitors associated with interstitial lung disease in cancer patients,” European Respiratory Journal, vol. 50, no. 2, p. 1700050, 2017.
- D. Fujimoto, R. Kato, T. Morimoto et al., “Characteristics and prognostic impact of pneumonitis during systemic anti-cancer therapy in patients with advanced non-small-cell lung cancer,” PLoS One, vol. 11, no. 12, article e0168465, 2016.
- R. Dhokarh, G. Li, C. N. Schmickl et al., “Drug-associated acute lung injury: a population-based cohort study,” Chest, vol. 142, no. 4, pp. 845–850, 2012.
- T. Sakurada, S. Kakiuchi, S. Tajima et al., “Characteristics of and risk factors for interstitial lung disease induced by chemotherapy for lung cancer,” The Annals of Pharmacotherapy, vol. 49, no. 4, pp. 398–404, 2015.
- H. Borghaei, L. Paz-Ares, L. Horn et al., “Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer,” The New England Journal of Medicine, vol. 373, no. 17, pp. 1627–1639, 2015.
- J. Naidoo, X. Wang, K. M. Woo et al., “Pneumonitis in patients treated with anti-programmed death-1/programmed death ligand 1 therapy,” Journal of Clinical Oncology, vol. 35, no. 7, pp. 709–717, 2017.
- M. Lafontan, “Fat cells: afferent and efferent messages define new approaches to treat obesity,” Annual Review of Pharmacology and Toxicology, vol. 45, pp. 119–146, 2005.
- R. H. Straub, H. W. Hense, T. Andus, J. Scholmerich, G. A. Riegger, and H. Schunkert, “Hormone replacement therapy and interrelation between serum interleukin-6 and body mass index in postmenopausal women: a population-based study,” The Journal of Clinical Endocrinology and Metabolism, vol. 85, no. 3, pp. 1340–1344, 2000.
- G. S. Hotamisligil, P. Arner, J. F. Caro, R. L. Atkinson, and B. M. Spiegelman, “Increased adipose tissue expression of tumor necrosis factor-alpha in human obesity and insulin resistance,” The Journal of Clinical Investigation, vol. 95, no. 5, pp. 2409–2415, 1995.
- P. A. Kern, M. Saghizadeh, J. M. Ong, R. J. Bosch, R. Deem, and R. B. Simsolo, “The expression of tumor necrosis factor in human adipose tissue. Regulation by obesity, weight loss, and relationship to lipoprotein lipase,” The Journal of Clinical Investigation, vol. 95, no. 5, pp. 2111–2119, 1995.
- A. Badawi, A. Klip, P. Haddad et al., “Type 2 diabetes mellitus and inflammation: prospects for biomarkers of risk and nutritional intervention,” Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy, vol. 3, pp. 173–186, 2010.
- M. S. Ellulu, I. Patimah, H. Khaza’ai, A. Rahmat, and Y. Abed, “Obesity and inflammation: the linking mechanism and the complications,” Archives of Medical Science, vol. 4, no. 4, pp. 851–863, 2017.









Άφησε σχόλιο