Lei-Min Yu,1,2 Ke-Jia Zhao,1,2, Bin Lu 1
1 Department of Gastroenterology, The First Affiliated Hospital of Zhejiang Chinese Medical University, Hangzhou, Zhejiang, China 2 The First Clinical Medical College of Zhejiang Chinese Medical University, Hangzhou, Zhejiang, China
Σκοπός αυτής της μελέτης ήταν η εκτίμηση της αποτελεσματικότητας της ορθικής χορήγησης μη στεροειδών αντιφλεγμονωδών φαρμάκων (NSAIDs) στην πρόληψη της παγκρεατίτιδας μετά από ERCP (PEP). Έγινε έρευνα στη βάση δεδομένων για τυχαιοποιημένες ελεγχόμενες μελέτες (RCTs) που συγκρίνουν την προδιαδικαστική χορήγηση από το ορθό των ΜΣΑΦ με εικονικό φάρμακο για την πρόληψη της PEP. Η ορθική χορήγηση των NSAIDs μείωσε σημαντικά την επίπτωση της PEP σε ολόκληρο τον πληθυσμό ασθενών (αναλογία πιθανότητας (OR): 0.44, 95% διάστημα εμπιστοσύνης (CI): 0.30-0.64, P <0.0001) 0,34, 95% CI: 0,19-0,58, Ρ = 0,0001) και σε ασθενείς υψηλού κινδύνου (OR: 0,51, 95% CI: 0,31-0,84, P = 0,008). Η επίπτωση της PEP μειώθηκε από την ινδομεθακίνη (OR: 0,54, 95% CI: 0,36-0,82, P = 0,004) και τη δικλοφαινάκη (OR: 0,27, 95% CI: 0,15-0,46, P <0 00001). Η χορήγηση των ΜΣΑΦ πριν από (OR: 0,42, 95% CI: 0,25-0,73, P = 0,002) ή μετά από ERCP μείωσε την PEP (OR: 0,39, 95% CI: 0,27-0,56, P <0-00001). Τα μη στεροειδή αντιφλεγμονώδη φάρμακα συσχετίστηκαν με μία μείωση στην ήπια PEP (OR: 0,55, 95% CI: 0,36-0,83, Ρ = 0,004) και στη μέτρια έως σοβαρή PEP (OR: 0,47, 95% CI: 0,28-0,79, Ρ = 0 004). Η χορήγηση από το ορθό των ΜΣΑΦ μείωσε τη συχνότητα εμφάνισης PEP σε ασθενείς υψηλού κινδύνου.
1. Εισαγωγή
Από την εισαγωγή της ενδοσκοπικής σφιγκτηροτομής, η ενδοσκοπική αναδρομική χολαγγειοπαγκρεατογραφία (ERCP) έχει γίνει ένα σημαντικό εργαλείο για τη θεραπεία των νόσων των χοληφόρων και του παγκρέατος. Η πιο συχνή επιπλοκή της ERCP είναι η οξεία παγκρεατίτιδα. Η επίπτωση της παγκρεατίτιδας μετά από ERCP κυμαίνεται από 1% έως 10% σε όλους τους ασθενείς με κίνδυνο και μπορεί να φτάσει ακόμη και σε 25% σε ασθενείς υψηλού κινδύνου1. Οι περισσότερες περιπτώσεις PEP είναι ήπιες, αλλά περίπου το 10% των επεισοδίων μπορεί να είναι σοβαρές, με αποτέλεσμα τη σημαντική νοσηρότητα και την περιστασιακή θνησιμότητα2.
Πολλά ιδρύματα έχουν προσπαθήσει να αναπτύξουν μηχανικές και φαρμακολογικές διαδικασίες για την πρόληψη της PEP. Ωστόσο, γενικά, τα αποτελέσματα των φαρμακολογικών παρεμβάσεων ήταν απογοητευτικά3. Η σωματοστατίνη έχει αποδειχθεί χρήσιμη4, αλλά απαιτεί συνεχή έγχυση και είναι ακατάλληλη για χρήση στη συνήθη κλινική πρακτική. Έτσι, η χρήση της είναι περιορισμένη. Τα μη στεροειδή αντιφλεγμονώδη φάρμακα (ΜΣΑΦ) έχουν βρεθεί ότι είναι ευεργετικά στην πρόληψη της PEP. Ενεργούν καταστέλλοντας την παραγωγή αρκετών κύριων κατηγοριών προφλεγμονωδών λιπιδίων (π.χ. λευκοτριένια, προσταγλανδίνες και παράγοντα ενεργοποίησης αιμοπεταλίων), με αποτέλεσμα την αναστολή της δραστηριότητας της φωσφολιπάσης Α25,6. Επιπλέον, η πρόσδεση ουδετερόφιλων-ενδοθηλιακών κυττάρων αναστέλλεται επίσης από τα ΜΣΑΦ6.
Το 2014, η Ευρωπαϊκή Εταιρεία Γαστρεντερικής Ενδοσκόπησης συνέστησε ως χρήση ρουτίνας 100mg ινδομεθακίνης ή δικλοφαινάκης μέσω της ορθικής οδού πριν ή μετά από τη διενέργεια ERCP σε όλους τους ασθενείς χωρίς αντενδείξεις (σύσταση βαθμού Α)7. Σήμερα, όμως, δεν υπάρχουν κατευθυντήριες γραμμές της Αμερικανικής Εταιρίας Ενδοσκόπησης που να συνιστούν ειδικά τη χρήση της ορθικής χορήγησης ΜΣΑΦ για την πρόληψη της PEP σε όλους τους ασθενείς. Σε προηγούμενες τυχαιοποιημένες ελεγχόμενες δοκιμές (RCTs) και μετα-αναλύσεις, τα αποτελέσματα υποστήριξαν τη χρήση της ορθικής χορήγησης ΜΣΑΦ για την πρόληψη της PEP. Ωστόσο, ορισμένες πρόσφατα δημοσιευμένες μελέτες RCT είχαν αντικρουόμενα αποτελέσματα6,8. Υποθέσαμε ότι οι διαφορές στους παράγοντες κινδύνου για την PEP μπορεί να έχουν οδηγήσει σε συγκρουόμενα αποτελέσματα. Με άλλα λόγια, η αποτελεσματικότητα της ορθικής χορήγησης των ΜΣΑΦ στην πρόληψη της ΡΕΡ μπορεί να επηρεαστεί από διαφορετικούς κινδύνους. Προκειμένου να αποσαφηνιστεί ο ρόλος της ορθικής χορήγησης ΜΣΑΦ τόσο σε πληθυσμούς υψηλού κινδύνου όσο και σε όλους τους πιθανούς κινδύνους, διεξήγαμε αυτή τη μετα-ανάλυση, η οποία περιλάμβανε όλες τις μελέτες RCT που έχουν αναφερθεί μέχρι σήμερα.
2. Υλικό και Μέθοδος
Αυτή η μετα-ανάλυση καταγράφηκε στο International Prospective Register of Systematic Reviews (Διεθνές Μητρώο Προοπτικών Συστηματικών Ανασκοπήσεων) (αριθμός CRD42016039540).
2.1. Στρατηγική Αναζήτησης και Αξιολόγηση Ποιότητας. Πραγματοποιήσαμε μια βιβλιογραφική έρευνα στο PubMed, στο Embase και στη βιβλιοθήκη Cochrane για να βρούμε πιθανές σχετικές μελέτες που δημοσιεύθηκαν από την αρχή μέχρι τον Μάιο του 2016. Επιλέξαμε άρθρα που υιοθετούν μια εξαιρετικά ευαίσθητη στρατηγική αναζήτησης, προκειμένου να εντοπίσουμε αναφορές για RCTs και λέξεις κειμένου που περιελάμβαναν τα ακόλουθα: (i) παλίνδρομη ενδοσκοπική χολαγγειοπαγκρεατογραφία, (ii) παγκρεατίτιδα και (iii) μη στεροειδείς αντιφλεγμονώδεις παράγοντες, ή ινδομεθακίνη ή ιβουπροφαίνη ή δικλοφαινάκη. Πραγματοποιήσαμε αναδρομικές αναζητήσεις καθώς και παραπομπές, υιοθετώντας μια λειτουργία “παρόμοιων άρθρων”. Έχουν αποκλειστεί μελέτες με χρήση από του στόματος και/ή ενδομυϊκής ένεσης και/ή ενδοφλέβια ΜΣΑΦ. Οι μη τυχαιοποιημένες δοκιμές και μελέτες με οποιαδήποτε έρευνα σχετικά με τη θεραπεία, τα ανεπαρκή δεδομένα σχετικά με την κλινική ανταπόκριση, τις παιδιατρικές μελέτες και τις διπλές δημοσιεύσεις εξαιρέθηκαν επίσης. Ανεξάρτητα από το κύριο αποτέλεσμα, εξετάσαμε όλες τις δυνητικά επιλέξιμες μελέτες για αξιολόγηση. Επιπλέον, εκτελέσαμε μια μη αυτόματη αναζήτηση χρησιμοποιώντας τους καταλόγους αναφοράς των κρίσιμων άρθρων που δημοσιεύθηκαν στα αγγλικά.
2.2. Κριτήρια Επιλογής Δοκιμής. Τα κριτήρια ένταξης για την επιλογή της μελέτης ήταν τα εξής: α) ο σχεδιασμός της μελέτης περιελάμβανε μελέτες σε ανθρώπους που δημοσιεύθηκαν στα αγγλικά με τυχαιοποιημένες, τυφλές και ελεγχόμενες μελέτες, β) ο πληθυσμός της μελέτης περιελάμβανε ενήλικες ασθενείς που υποβλήθηκαν σε ERCP, γ) η παρέμβαση περιελάμβανε την ορθική χορήγηση των ΜΣΑΦ και δ) η παρέμβαση σύγκρισης ήταν εικονικό φάρμακο. Απαιτήσαμε ότι οι ασθενείς στη δοκιμή θα έπρεπε να έχουν λάβει από το ορθό χορήγηση ΜΣΑΦ ή εικονικού φαρμάκου τυχαία, πριν, κατά τη διάρκεια ή αμέσως μετά την ERCP.
Δύο ανεξάρτητοι ερευνητές (Lei-Min Yu, Ke-Jia Zhao) αναθεώρησαν τους τίτλους των μελετών και τις περιλήψεις. Οι μελέτες που πληρούσαν τα κριτήρια ένταξης υποβλήθηκαν σε αξιολόγηση πλήρους κειμένου.
Οι δύο ερευνητές (Lei-Min Yu και Ke-Jia Zhao) ανέλυσαν τις επιλεγμένες δοκιμές και τα δεδομένα που εξήχθησαν. Ένας τρίτος ερευνητής (Bin Lu) επέλυσε τυχόν διαφωνίες. Χρησιμοποιήσαμε το εργαλείο Cochrane Collaboration για να αξιολογήσουμε τον κίνδυνο μεροληψίας και αξιολογήσαμε τη μεθοδολογική ποιότητα των περιλαμβανόμενων μελετών9.
2.3. Αποτελέσματα. Το κύριο αποτέλεσμα ήταν η επίπτωση της PEP. Τα δευτερεύοντα αποτελέσματα περιλάμβαναν τη συχνότητα εμφάνισης ήπιας PEP καθώς και μέτριας έως σοβαρής PEP. Οι αναλύσεις των υποομάδων πραγματοποιήθηκαν με βάση τον τύπο των ασθενών (ασθενείς υψηλού κινδύνου και όλοι σε κίνδυνο ασθενείς, ξεχωριστά), τον τύπο του φαρμάκου που χρησιμοποιήθηκε (δικλοφαινάκη έναντι ελέγχου, ινδομεθακίνη έναντι ελέγχου) και το χρόνο χορήγησης του φαρμάκου (πριν, κατά τη διάρκεια ή αμέσως μετά την ERCP).
2.4. Ορισμοί. Όλοι οι ασθενείς με κίνδυνο είναι όλοι οι μη επιλεγμένοι ασθενείς που υποβάλλονται σε ERCP. Οι ασθενείς που πληρούσαν ένα ή περισσότερα από τα ακόλουθα μείζονα κριτήρια κατηγοριοποιήθηκαν ως ασθενείς υψηλού κινδύνου10,11: κλινική υποψία δυσλειτουργίας του σφιγκτήρα του Oddi (SOD), παλαιό ιστορικό PEP, παγκρεατική σφιγκτηροτομή, precut σφιγκτηροτομή, περισσότερες από 8 απόπειρες καναλοποίησης, αεριώδης διαστολή ενός άθικτου χολικού σφιγκτήρα, εκτομή της λυκήθου ή παγκρεατογραφία.
Ασθενείς που πληρούσαν δύο ή περισσότερα από τα ακόλουθα δευτερεύοντα κριτήρια συμπεριλήφθηκαν επίσης στην ομάδα υψηλού κινδύνου10: γυναίκες ηλικίας κάτω των 50 ετών, ασθενείς με υποτροπιάζον ιστορικό παγκρεατίτιδας (≥2 επεισόδια), ασθενείς που έλαβαν ενέσιμο παράγοντα αντίθεσης στον παγκρεατικό πόρο τρεις ή περισσότερες φορές με τουλάχιστον μία ένεση μέχρι την ουρά του παγκρέατος, εκείνοι που έλαβαν ενέσιμο παράγοντα αντίθεσης στον παγκρεατικό πόρο προκαλώντας θολερότητα των ακτίνων του παγκρέατος ή εκείνοι από τους οποίους ελήφθη ένα κυτταρολογικό δείγμα από τον παγκρεατικό πόρο χρησιμοποιώντας την τεχνική απολέπισης.
2.5. Στατιστική Ανάλυση. Εκτιμήσαμε την προφυλακτική επίδραση των NSAIDs στη συχνότητα εμφάνισης της PEP θεωρώντας την ως διχοτόμο μεταβλητή. Για άμεσες συγκρίσεις, υιοθετήθηκαν τυχαία αποτελέσματα και όχι μοντέλο σταθερών αποτελεσμάτων, προκειμένου να ληφθεί υπόψη η ετερογένεια μεταξύ των πολλαπλών μελετών. Οι τιμές P <0,05 θεωρήθηκαν σημαντικές. Για τον υπολογισμό της σημασίας καθώς και της έκτασης της στατιστικής ετερογένειας χρησιμοποιήθηκε ο δείκτης I2. Τιμή μεγαλύτερη από 50% θεωρήθηκε ενδεικτική ετερογένειας. Οι αναλογίες αποδόσεων (ORs) καθώς και τα αντίστοιχα διαστήματα εμπιστοσύνης 95% (CIs) υπολογίστηκαν για κάθε ανάλυση.
Τα διαγράμματα διοχέτευσης και η δοκιμασία ασυμμετρίας παλινδρόμησης Egger χρησιμοποιήθηκαν για την εκτίμηση της πιθανότητας μεροληψίας της δημοσίευσης. Διεξήχθησαν αναλύσεις ευαισθησίας για να εκτιμηθεί η ευρωστία των αποτελεσμάτων, εξαλείφοντας κάθε μεμονωμένη μελέτη με τη σειρά της από το σύνολο και αναλύοντας το υπόλοιπο και πάλι με βάση την ποιότητα. Οι αναλύσεις των υποομάδων πραγματοποιήθηκαν με βάση τον τύπο των ΜΣΑΦ (δικλοφαινάκη έναντι ελέγχου, ινδομεθακίνη έναντι ελέγχου), τον κίνδυνο ασθενών (ασθενείς υψηλού κινδύνου και όλοι οι ασθενείς σε κίνδυνο, ξεχωριστά) και το χρόνο χορήγησης του φαρμάκου (πριν, κατά τη διάρκεια ή αμέσως μετά την ERCP).
Όλες οι στατιστικές αναλύσεις πραγματοποιήθηκαν με το λογισμικό RevMan της έκδοσης 5.3 και η αντικειμενικότητα της δημοσίευσης αναλύθηκε με λογισμικό STATA / SE 12.0.
3. Αποτελέσματα
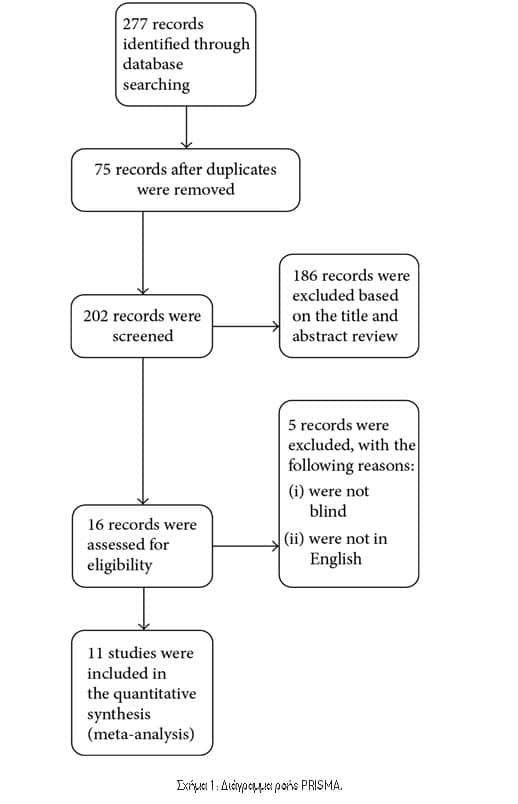
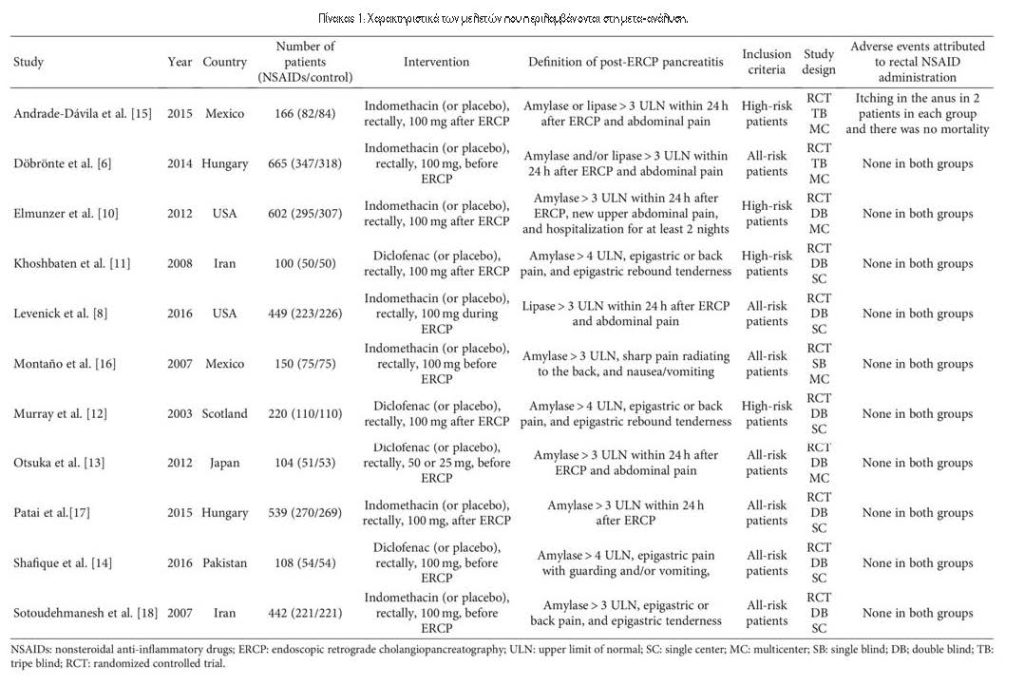
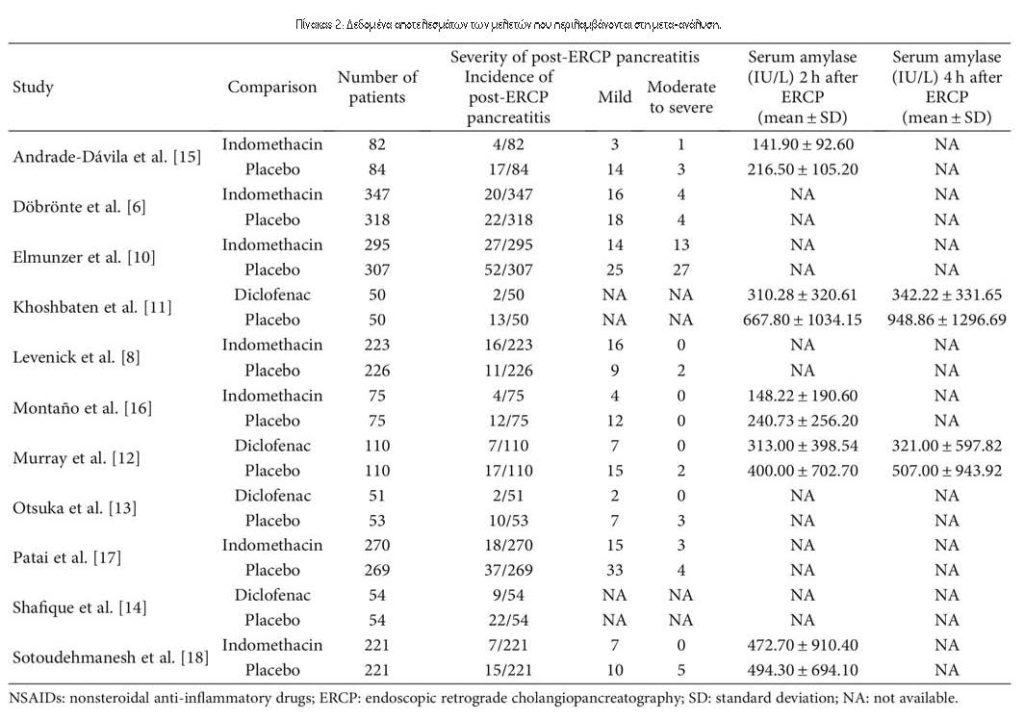
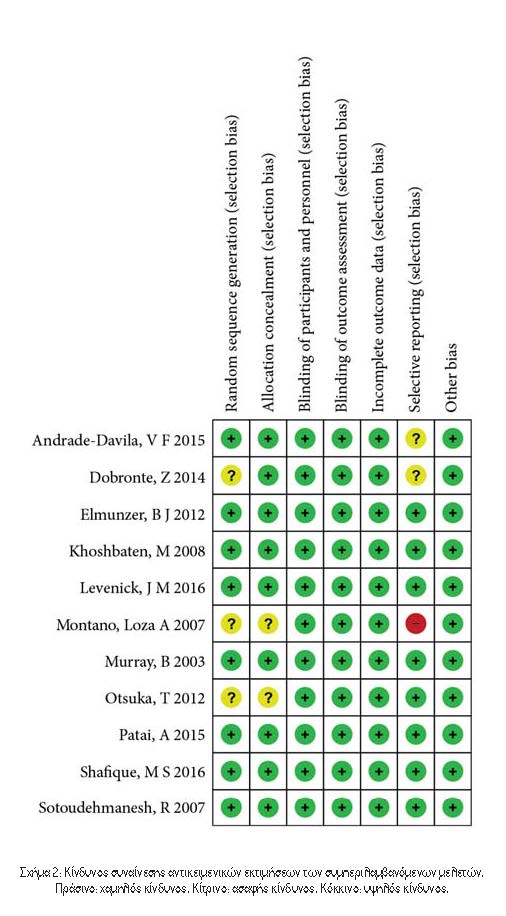
3.1. Χαρακτηριστικά των Περιλαμβανόμενων Δοκιμών. Συνολικά βρέθηκαν 277 άρθρα, εκ των οποίων 75 αφαιρέθηκαν, 186 εξαιρέθηκαν βάσει τίτλου και αφηρημένης ανασκόπησης, 3 αφαιρέθηκαν για μη αποκλεισμένες μελέτες και 2 εξαιρέθηκαν λόγω μη δημοσίευσης στα αγγλικά (Εικόνα 1). Τέλος, οι 11 RCTs πληρούσαν τα κριτήρια ένταξης. Ο Πίνακας 1 παρουσιάζει τα κύρια χαρακτηριστικά των συμπεριλαμβανόμενων μελετών σε αυτή τη μετα-ανάλυση και ο Πίνακας 2 παρουσιάζει τα αποτελέσματα των αποτελεσμάτων κάθε περιλαμβανόμενης δοκιμής. Οι μελέτες που περιελήφθησαν δημοσιεύτηκαν μεταξύ του 2003 και του 2016. Τα μεγέθη των RCT κυμάνθηκαν από 100 έως 665 ασθενείς, για συνολικά 3545 ασθενείς. Η PEP καθορίστηκε με σχετικά κριτήρια σε όλες τις δοκιμές. Δύο διαφορετικοί τύποι ΜΣΑΦ χρησιμοποιήθηκαν στις επιλεγμένες δοκιμές, συμπεριλαμβανομένης της δικλοφαινάκης11-14 και της ινδομεθακίνης6,8,10,15-18. Ο Πίνακας 1 δείχνει επίσης ότι δεν αναφέρθηκαν ανεπιθύμητες ενέργειες που αποδόθηκαν σε ΜΣΑΦ σε 10 δοκιμές. Σε μία δοκιμή15, βρέθηκε κνησμός στο ορθό σε δύο ασθενείς σε κάθε ομάδα και δεν παρατηρήθηκε θνησιμότητα. Το Σχήμα 2 υποδεικνύει τον κίνδυνο συναίνεσης από τις προκαταρκτικές εκτιμήσεις των συμπεριλαμβανόμενων μελετών.
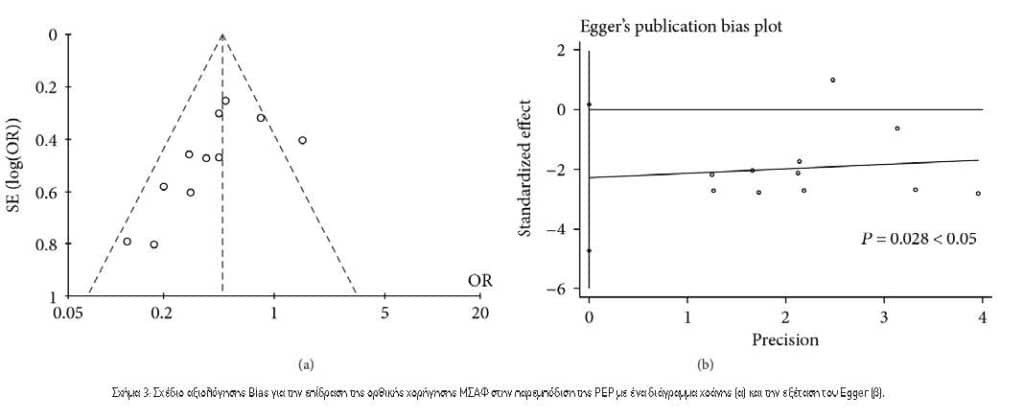
3.2. Δημοσκόπηση Bias. Ο οπτικός έλεγχος της δοκιμής διαγράμματος χοάνης (Σχήμα 3[α]) έδειξε ότι ήταν δυνατή η αντικειμενικότητα της δημοσίευσης. Ταυτόχρονα, η σταθμισμένη παλινδρόμηση του Egger έδειξε μια ήπια τάση δημοσίευσης για όλες τις αναλύσεις (P=0.028, Εικόνα 3[b]). Στις συγκρίσεις, δεν μπορέσαμε να αξιολογήσουμε την αντικειμενικότητα της δημοσίευσης, διότι κάποια αρνητικά αποτελέσματα ενδέχεται να μην έχουν δημοσιευθεί.
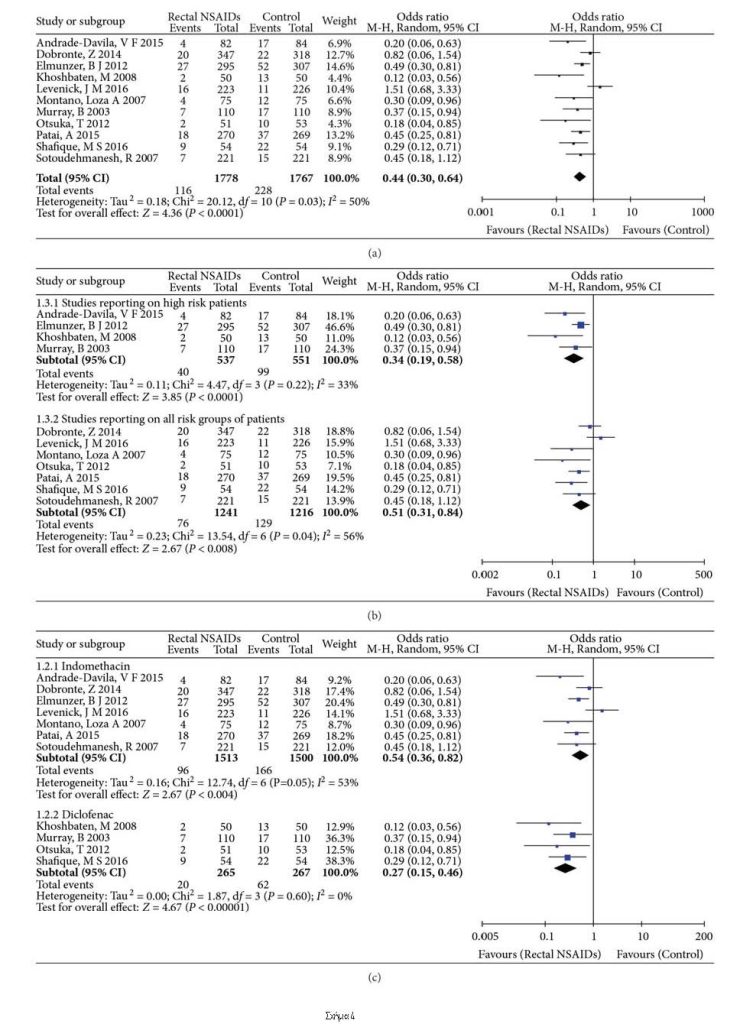
3.3. Πρωτογενές Αποτέλεσμα: Η συχνότητα εμφάνισης της PEP. Συνολικά, 344 (9,70%) ασθενείς ανέπτυξαν PEP: 116 στην ομάδα των ΜΣΑΦ και 228 στην ομάδα ελέγχου. Η επίπτωση της PEP προφανώς μειώθηκε με τη χρήση της ορθικής χορήγησης ΜΣΑΦ (OR: 0.44, 95% CI: 0.30-0.64, Ρ <0.0001, Σχήμα 4[a]). Εν τω μεταξύ, ανιχνεύθηκε ήπια ετερογένεια στην ανάλυση της επίπτωσης της PEP (Tau2=0,18, Chi2=20,12, Ρ=0.03, I2=50%). Ακολούθως, πραγματοποιήθηκε ανάλυση ευαισθησίας. Μετά την εξάλειψη κάθε μελέτης με τη σειρά της διαπιστώθηκε ότι τα αποτελέσματα καθώς και η ετερογένεια έχουν διαφορές. Περισσότερο ομοιογενή αποτελέσματα επιτεύχθηκαν με την εξαίρεση της εξωστρεφούς μελέτης των Levenick και συν8, η οποία ήταν η πηγή ετερογένειας (Tau2=0,05, Chi2=11,32, Ρ=0.25, I2=20%).
3.4. Αναλύσεις Υποομάδων. Η ανάλυση των υποομάδων των μελετών που διενεργούνται σε ασθενείς υψηλού κινδύνου και οι μελέτες που αναφέρονται σε ομάδες ασθενών με όλες τις ομάδες κινδύνου πραγματοποιήθηκαν όπως φαίνεται στο Σχήμα 4β. Σύμφωνα με την ανάλυση των υποομάδων των τεσσάρων μελετών ασθενών υψηλού κινδύνου10-12,15, η επίπτωση της PEP βρέθηκε στατιστικά σημαντική, ευνοώντας την ορθική χορήγηση των ΜΣΑΦ (OR:0,34, 95% CI: 0,19-0,58, P=0.0001). Δεν παρατηρήθηκε ετερογένεια σε αυτή την υποομάδα (Tau2=0,11, Chi2=4,47, Ρ=0.22, I2=33%). Η επίπτωση της PEP επίσης μειώθηκε σημαντικά από τα ΜΣΑΦ για όλους τους ασθενείς σε όλες τις άλλες μελέτες (OR:0.51, 95% CI: 0.31-0.84, P=0.008)6,8,13,14,16-18. Ήπια ετερογένεια διαπιστώθηκε στη συχνότητα εμφάνισης ΡΕΡ στην ομάδα ασθενών με όλες τις ομάδες κινδύνου (Tau2=0,23, Chi2=13,54, Ρ=0.44, I2=56%).
Η ανάλυση των υποομάδων των μελετών που χρησιμοποιούν ινδομεθακίνη και δικλοφαινάκη έχει δειχθεί χωριστά στο Σχήμα 4γ. Η μετα-ανάλυση των υποομάδων επτά μελετών6,8,10,15-18 έδειξε ότι η χορήγηση ινδομεθακίνης από το ορθό ήταν ανώτερη από το εικονικό φάρμακο στην πρόληψη της PEP (OR: 0,54, 95% CI: 0,36-0,82, P=0.004). Υπήρχε ήπια ετερογένεια για την ανάλυση της επίπτωσης της PEP στην υποομάδα ινδομεθακίνης (Tau2=0,16, Chi2=12,74, Ρ=0.55, I2=53%). Μια άλλη μετα-ανάλυση υποομάδας τεσσάρων μελετών11-14 έδειξε ότι η δικλοφαινάκη από το ορθό ήταν προφανώς ανώτερη από το εικονικό φάρμακο στην πρόληψη της PEP (OR: 0.27, 95% CI: 0.15-0.46, P<0.00001) και δεν υπήρχαν ενδείξεις ετερογένεια αυτών των αποτελεσμάτων (Tau2=0,00, Chi2=1,87, Ρ=0.60, I2=0%).
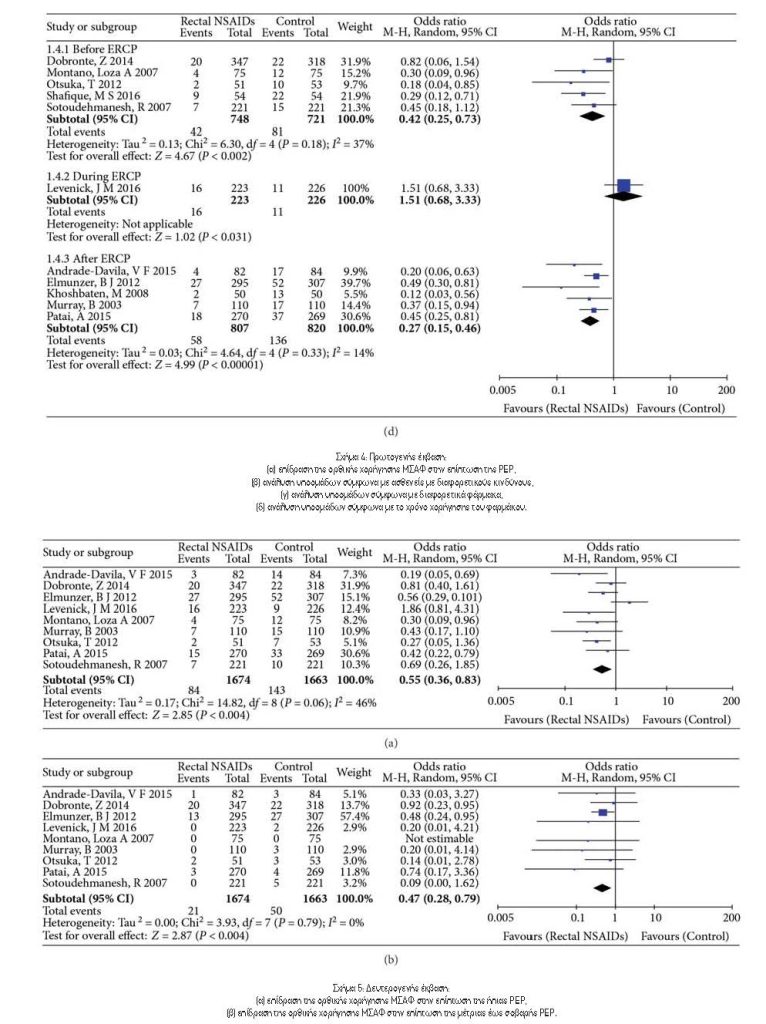
Η ανάλυση των υποομάδων χρόνου χορήγησης φαρμάκου (πριν, κατά τη διάρκεια ή αμέσως μετά το ERCP) παρουσιάζεται στο Σχήμα 4δ. Σε πέντε μελέτες, τα ΜΣΑΦ χορηγήθηκαν πριν από την ERCP6,13,14,16,18. Η μετα-ανάλυση αυτών των μελετών έδειξε ότι η συχνότητα της PEP μειώθηκε σημαντικά με αυτή τη θεραπεία (OR: 0,42, 95% CI: 0,25-0,73, P=0.002). Δεν παρατηρήθηκε ετερογένεια σε αυτή την υποομάδα (Tau2=0,13, Chi2=6,30, Ρ=0.18, I2=37%). Μια άλλη μετα-ανάλυση πέντε μελετών στις οποίες χορηγήθηκαν ΜΣΑΦ μετά από ERCP10-12,15,17 έδειξε ότι η συχνότητα της PEP μειώθηκε, ευνοώντας τη χρήση χορήγησης ΜΣΑΦ από το ορθό (OR: 0,39, 95% CI: 0,27 – 0,56, Ρ <0.00001). Δεν παρατηρήθηκε ετερογένεια σε αυτή την υποομάδα (Tau2=0,03, Chi2=4,64, Ρ=0.33, I2=14%). Μόνο μία μελέτη από τους Levenick και συν.8 οι οποίοι χρησιμοποίησαν ΜΣΑΦ κατά τη διάρκεια της ERCP και το αποτέλεσμα έδειξε ότι δεν μπορούσαν να αποτρέψουν την PEP (OR: 1,51, 95% CI: 0,68-3,33, P=0.31). Αυτή η μελέτη ήταν η πηγή ετερογένειας.
3.5. Δευτερογενές Αποτέλεσμα: Η συχνότητα εμφάνισης ήπιας PEP ή Μέτριας έως Σοβαρής PEP. Ως δευτερογενές έκβαση, η συχνότητα εμφάνισης ήπιας PEP και η μέτρια έως σοβαρή PEP αναλύθηκε χωριστά (Εικόνα 5). Η συχνότητα εμφάνισης διαφορετικών επιπέδων σοβαρότητας της PEP αναφέρθηκε σε εννέα μελέτες6,8,10,12,13,15-18. Τα ΜΣΑΦ συσχετίστηκαν με μείωση της συχνότητας εμφάνισης ήπιας ΡΕΡ (OR: 0,55, 95% CI: 0,36-0,83, Ρ=0.004) (Εικόνα 5[α]). Σε αυτές τις εννέα μελέτες, δεν υπήρχε ετερογένεια (Tau2=0,17, Chi2=14,82, Ρ=0.66, I2=46%). Η συχνότητα εμφάνισης μέτριας έως σοβαρής PEP μειώθηκε επίσης με τη χρήση των ΜΣΑΦ (OR: 0,47, 95% CI: 0,28-0,79, P=0.004) και δεν υπήρχαν ενδείξεις ετερογένειας για αυτά τα αποτελέσματα (Tau2=0.00 , Chi2=3.93, Ρ=0.79, I2=0%) (Σχήμα 5[b]). Με άλλα λόγια, το Σχήμα 5 δείχνει ότι η ορθική χορήγηση των ΜΣΑΦ μειώνει τη συχνότητα της ήπιας PEP καθώς και της μέτριας έως σοβαρής PEP.
4. Συζήτηση
Τα αποτελέσματά μας έδειξαν ότι, σε σύγκριση με το εικονικό φάρμακο, η χορήγηση από το ορθό των ΜΣΑΦ ως προφυλακτική θεραπεία μπορεί να αποτρέψει την PEP σε ασθενείς υψηλού κινδύνου και με όλους τους κινδύνους. Επιπλέον, με βάση το δευτερογενές αποτέλεσμα, τα ΜΣΑΦ μπορούν να μειώσουν τη συχνότητα τόσο της ήπιας όσο και της μέτριας PEP. Επιπλέον, σε όλες τις RCTs, δεν υπήρξαν σημαντικά ανεπιθύμητα συμβάντα μεταξύ των διαφόρων ομάδων, δείχνοντας ότι μία εφάπαξ δόση ΜΣΑΦ δεν αυξάνει τον κίνδυνο αιμορραγίας μετά από ERCP (Πίνακας 1). Η χρήση των ΜΣΑΦ πριν ή μετά από την ERCP βοηθά στη μείωση της συχνότητας εμφάνισης της PEP. Ωστόσο, απαιτούνται περισσότερες RCTs για να καθοριστεί ο καλύτερος χρόνος χορήγησης. Οι αναλύσεις ευαισθησίας έδειξαν ότι τα αποτελέσματα παρέμειναν σταθερά όταν αποκλείονταν η εξωτερική μελέτη[8.
Οι επιπλοκές της ERCP περιλαμβάνουν παγκρεατίτιδα (2,6%), αιμορραγία (0,3%), λοίμωξη (0,3%), καρδιακή (0,1%), πνευμονική (0,1%) και εντερική διάτρηση (0,1%)19. Μεταξύ αυτών των επιπλοκών, η ΡΕΡ θεωρείται μία από τις κύριες αιτίες θνησιμότητας και νοσηρότητας. Η έναρξη είναι συνήθως εντός 24 ωρών από τη διαδικασία. Μεταξύ του παγκρεατικού τραυματισμού κατά τη διάρκεια της ERCP και της πραγματικής εισβολής των συμπτωμάτων είναι το “χρυσό θεραπευτικό παράθυρο” (μέσος χρόνος 4.5 ώρες), το οποίο δημιουργεί μια βασική ευκαιρία θεραπείας για την πρόληψη της παγκρεατίτιδας20. Λόγω της κλινικής και οικονομικής επιβάρυνσης της ΡΕΡ, εκτεταμένες ερευνητικές προσπάθειες έχουν αφιερωθεί στην πρόληψή της. Η χρήση της περιπροδιαδικαστικής (periprocedural) χορήγησης από το ορθό των ΜΣΑΦ είναι μία από τις πιο ελπιδοφόρες παρεμβάσεις.
Για την πρόληψη της PEP, θα πρέπει να λαμβάνονται υπόψη παθογόνοι παράγοντες, όπως οι μηχανικές, θερμικές, υδροστατικές, βακτηριακές και χημικές προσβολές που συνοδεύουν τον καναλισμό ή/και την έγχυση μέσου αντίθεσης στον παγκρεατικό πόρο ή άλλους τρόπους μέτρησης της θηλής, καθώς όλα τα παραπάνω μπορούν να προκαλέσουν τραυματισμό στον παγκρεατικό πόρο. Όλοι αυτοί οι παθογόνοι παράγοντες προκαλούν μια φλεγμονώδη αντίδραση η οποία οδηγεί στην ανάπτυξη παγκρεατίτιδας. Οι έντονοι φλεγμονώδεις μηχανισμοί σηματοδότησης στα κυτταρικά κύτταρα είναι σημαντικοί για την παθογένεση της παγκρεατίτιδας21. Η φωσφολιπάση Α2 παίζει σημαντικό ρόλο ρυθμίζοντας μερικούς προφλεγμονώδεις μεσολαβητές, συμπεριλαμβανομένων των προϊόντων αραχιδονικού οξέος και των παραγόντων ενεργοποίησης αιμοπεταλίων στον αρχικό καταρράκτη της φλεγμονής στην οξεία παγκρεατίτιδα22. Έχει προταθεί ότι τα ΜΣΑΦ έχουν ευεργετικά αποτελέσματα στην οξεία παγκρεατίτιδα καθώς είναι ισχυροί ανταγωνιστές της φωσφολιπάσης Α223.
Επιπλέον, τα ΜΣΑΦ αναστέλλουν επίσης τη σύνθεση νιτρικού οξειδίου, η οποία εμπλέκεται στη φλεγμονή και την καταστροφή των κυττάρων24. Η μέγιστη συγκέντρωση ΜΣΑΦ στο πλάσμα επιτυγχάνεται εντός 30 λεπτών μετά τη χορήγηση από το ορθό25 και η βιοδιαθεσιμότητα είναι πλήρης. Με βάση τα διαθέσιμα δεδομένα, έχει αποδειχθεί ότι μόνο η χορήγηση ΜΣΑΦ από το ορθό έχει αποτέλεσμα στην πρόληψη της PEP, ίσως λόγω της πληρέστερης και ταχύτερης βιοδιαθεσιμότητας από ότι με τη στοματική οδό26,27. Η γαστρική οξύτητα μπορεί να καταστρέψει τα φάρμακα μετά από χορήγηση από το στόμα26. Δεύτερον, ο μεταβολισμός της δικλοφαινάκης ρυθμίζεται από το ένζυμο του κυτοχρώματος P450 (CYP) 2C9 (CYP2C9). Οι πολυμορφισμοί του ανθρώπινου γονιδίου CYP2C9 οδηγούν σε μεταβλητούς ρυθμούς μεταβολισμού της δικλοφαινάκης, επηρεάζοντας έτσι την αποτελεσματικότητα της θεραπείας28.
Στη μελέτη μας που περιλάμβανε 11 RCTs, 9 μελέτες διαπίστωσαν ότι τα ΜΣΑΦ είχαν προληπτική επίδραση στην ΡΕΡ, ενώ δύο μελέτες από τους Döbrönte και συν.6 και Levenick και συν.8 κατέληξαν στο συμπέρασμα ότι τα ΜΣΑΦ δεν ήταν αποτελεσματικά. Επιπλέον, τα δεδομένα που παρέχονται από τους Levenick και συν.8 οδήγησε σε στατιστικά σημαντική ετερογένεια στην ανάλυση μας. Μόνο οι Levenick και συν8 χρησιμοποίησαν ινδομεθακίνη κατά τη διάρκεια της ERCP μεταξύ αυτών των 11 μελετών. Αυτοί διαπίστωσαν ότι η συνολική συχνότητα της PEP (6%) ήταν συνεπής με τις εκτιμήσεις της προκαταρκτικής μελέτης, η οποία είναι πολύ χαμηλóτερη απó τη μέση συχνότητα ΡΕΡ σε προηγούμενες μελέτες ασθενών υψηλού κινδύνου10. Αυτό το εύρημα υποστηρίζει ότι τα χαρακτηριστικά του πληθυσμού της μελέτης είναι μεγάλης σημασίας και υποδηλώνει ότι τα συμπεράσματα που προέκυψαν από προηγούμενες μελέτες δεν είναι είναι δυνατόν να γενικευθούν σε όλους τους ασθενείς που υποβάλλονται σε ERCP. Πρόσφατα, οι Luo και συν.29 διεξήγαγαν RCT για να συγκρίνουν τη χρήση εν είδη ρουτίνας με την επιλεκτική εφαρμογή της τρανσκυτταρικής ινδομεθακίνης για την πρόληψη της PEP. Αυτοί συμπέραναν ότι η χορήγηση ινδομεθακίνης από το ορθό πριν από την ERCP σε όλες τις περιπτώσεις ασθενών ήταν ανώτερη από τη χορήγηση του ίδιου φαρμάκου μόνο σε ασθενείς υψηλού κινδύνου μετά από ERCP. Η ορθική χορήγηση των ΜΣΑΦ είναι σαφώς ευεργετική για την πρόληψη της PEP σε άτομα υψηλού κινδύνου. Ωστόσο, μερικές μελέτες διαπίστωσαν ότι τα ΜΣΑΦ δεν ήταν αποτελεσματικά σε ασθενείς με SOD. Ο Senol και συν.30 παρατήρησαν ότι η δικλοφαινάκη μέσω της ενδομυϊκής οδού ήταν αποτελεσματική μόνο στην πρόληψη της PEP σε ασθενείς χωρίς SOD. Αυτά τα αποτελέσματα επιβεβαιώθηκαν από τους Cheon και συν.26, οι οποίοι διαπίστωσαν ότι τα από του στόματος χορηγούμενα ΜΣΑΦ δεν είχαν καμία επίδραση στο ρυθμό της PEP σε περισσότερους από τους μισούς ασθενείς με SOD. Ο Murray και συν.12 επίσης διαπίστωσαν ότι η χορήγηση ινδομεθακίνης από το ορθό ήταν αναποτελεσματική στους ασθενείς με SOD. Αυτό μπορεί να σχετίζεται με το γεγονός ότι ο σπασμός του σφιγκτήρα μετά τη σφιγκτηροτομή ή το οίδημα μετά τη σφιγκτηροτομή αυξάνει την πίεση στον παγκρεατικό πόρο προκαλώντας απώλεια των προστατευτικών επιδράσεων των ΜΣΑΦ σε ασθενείς με SOD. Η ένταση του καταρράκτη της φλεγμονής και η συστηματική απόκριση καθορίζουν αμφότερες την σοβαρότητα της παγκρεατίτιδας. Επιπλέον, οι διάφοροι κίνδυνοι της PEP στους πληθυσμούς της μελέτης μπορεί να επηρεάσει τα αποτελέσματα των RCTs. Επομένως, είναι σημαντικό να στρωματοποιηθούν οι ασθενείς βάσει του κινδύνου προεπεξεργασίας και ενδοπρογράμματος.
Αυτή η μελέτη είναι μια ενημερωμένη μετα-ανάλυση 11 RCTs. Οι προηγούμενες δημοσιευμένες μετα-αναλύσεις έχουν συμπεριλάβει μόνο 7 RCT31-33. Παρεμπιπτόντως, σε μία από τις μετα-αναλύσεις31, η δόση της ινδομεθακίνης που χρησιμοποιήθηκε στην RCT του Elmunzer αναφέρθηκε ως 50mg, παρά το γεγονός ότι χρησιμοποιήθηκαν δύο υπόθετα των 50mg ινδομεθακίνης. Αυτό μπορεί να έχει οδηγήσει σε σφάλμα στην αναφορά των αποτελεσμάτων.
Ως συμπέρασμαι, συνιστούμε τη χρήση ορθικής χορήγησης ΜΣΑΦ ως φθηνών, παγκοσμίως διαθέσιμων, εύκολα χορηγούμενων και ασφαλών φαρμάκων για την πρόληψη της PEP πριν ή αμέσως μετά την ERCP σε όλους τους ασθενείς που υποβάλλονται σε αυτή τη διαδικασία. Ένας περιορισμός αυτής της μετα-ανάλυσης ήταν ότι δεν συμπεριλήφθηκαν μη Αγγλικές δημοσιεύσεις για το θέμα αυτό, οδηγώντας σε ένα ορισμένο βαθμό προκατειλημμένης επιλογής. Επιπλέον, η γραφική παράσταση έδειξε μια ήπια δημοσιευμένη μεροληψία σε αυτή τη μετα-ανάλυση. Ως εκ τούτου, υπάρχει πιθανότητα ότι τα αποτελέσματα μπορεί να υπερεκτιμηθούν επειδή η ανάλυσή μας περιελάμβανε μόνο δημοσιευμένα δεδομένα. Απαιτούνται περισσότερες μελέτες για την αξιολόγηση του βαθμού επίδρασης των ΜΣΑΦ στην πρόληψη της ΡΕΡ σε ασθενείς με διαφορετικούς παράγοντες κινδύνου.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- M. Bonzi, E. M. Fiorelli, and Gruppo di Autoformazione Metodologica (GrAM), “Indomethacin prevents post-ERCP pancreatitis in selected high-risk patients,” Internal and Emergency Medicine, vol. 7, no. 6, pp. 557-558, 2012.
- V. Bhatia, V. Ahuja, S. K. Acharya, and P. K. Garg, “A randomized controlled trial of valdecoxib and glyceryl trinitrate for the prevention of post-ERCP pancreatitis,” Journal of Clinical Gastroenterology, vol. 45, no. 2, pp. 170–176, 2011.
- M. E. Feurer and D. G. Adler, “Post-ERCP pancreatitis: review of current preventive strategies,” Current Opinion in Gastroenterology, vol. 28, no. 3, pp. 280–286, 2012.
- D. Arvanitidis, G. K. Anagnostopoulos, D. Giannopoulos et al., “Can somatostatin prevent post-ERCP pancreatitis? Results of a randomized controlled trial,” Journal of Gastroenterology and Hepatology, vol. 19, no. 3, pp. 278–282, 2004.
- A. Makela, T. Kuusi, and T. Schroder, “Inhibition of serum phospholipase-A2 in acute pancreatitis by pharmacological agents in vitro,” Scandinavian Journal of Clinical and Laboratory Investigation, vol. 57, no. 5, pp. 401–407, 1997.
- Z. Döbrönte, Z. Szepes, F. Izbéki et al., “Is rectal indomethacin effective in preventing of post-endoscopic retrograde cholangiopancreatography pancreatitis?” World Journal of Gastroenterology, vol. 20, no. 29, pp. 10151–10157, 2014.
- J. M. Dumonceau, A. Andriulli, B. J. Elmunzer et al., “Prophylaxis of post-ERCP pancreatitis: European Society of Gastrointestinal Endoscopy (ESGE) guideline – updated June 2014,” Endoscopy, vol. 46, no. 9, pp. 799–815, 2014.
- J. M. Levenick, S. R. Gordon, L. L. Fadden et al., “Rectal indomethacin does not prevent post-ERCP pancreatitis in consecutive patients,” Gastroenterology, vol. 150, no. 4, pp. 911–917, 2016.
- J. P. Higgins, D. G. Altman, P. C. Gøtzsche et al., “The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials,” BMJ, vol. 343, article d5928, 2011.
- B. J. Elmunzer, J. M. Scheiman, G. A. Lehman et al., “A randomized trial of rectal indomethacin to prevent post-ERCP pancreatitis,” The New England Journal of Medicine, vol. 366, no. 15, pp. 1414–1422, 2012.
- M. Khoshbaten, H. Khorram, L. Madad, M. J. Ehsani Ardakani, H. Farzin, and M. R. Zali, “Role of diclofenac in reducing post-endoscopic retrograde cholangiopancreatography pancreatitis,” Journal of Gastroenterology and Hepatology, vol. 23, part 2, no. 7, pp. e11–e16, 2008.
- B. Murray, R. Carter, C. Imrie, S. Evans, and C. O’Suilleabhain, “Diclofenac reduces the incidence of acute pancreatitis after endoscopic retrograde cholangiopancreatography,” Gastroenterology, vol. 124, no. 7, pp. 1786–1791, 2003.
- T. Otsuka, S. Kawazoe, S. Nakashita et al., “Low-dose rectal diclofenac for prevention of post-endoscopic retrograde cholangiopancreatography pancreatitis: a randomized controlled trial,” Journal of Gastroenterology, vol. 47, no. 8, pp. 912–917, 2012.
- M. S. Shafique, J. S. Khan, M. U. Fayyaz, S. Zafar, M. Nasrullah, and A. Raheel, “Prophylactic rectal NSAIDs in the prevention of post-ERCP pancreatitis,” Journal of Postgraduate Medical Institute, vol. 30, pp. 184–188, 2016.
- V. F. Andrade-Dávila, M. Chávez-Tostado, C. Dávalos-Cobián et al., “Rectal indomethacin versus placebo to reduce the incidence of pancreatitis after endoscopic retrograde cholangiopancreatography: results of a controlled clinical trial,” BMC Gastroenterology, vol. 15, no. 1, p. 85, 2015.
- A. Montaño Loza, X. Rodríguez Lomelí, J. E. García Correa et al., “Effect of the administration of rectal indomethacin on amylase serum levels after endoscopic retrograde cholangiopancreatography, and its impact on the development of secondary pancreatitis episodes,” Revista Española de Enfermedades Digestivas, vol. 99, no. 6, pp. 330–336, 2007.
- A. Patai, N. Solymosi, and A. V. Patai, “Effect of rectal indomethacin for preventing post-ERCP pancreatitis depends on difficulties of cannulation: results from a randomized study with sequential biliary intubation,” Journal of Clinical Gastroenterology, vol. 49, no. 5, pp. 429–437, 2015.
- R. Sotoudehmanesh, M. Khatibian, S. Kolahdoozan, S. Ainechi, R. Malboosbaf, and M. Nouraie, “Indomethacin may reduce the incidence and severity of acute pancreatitis after ERCP,” The American Journal of Gastroenterology, vol. 102, no. 5, pp. 978–983, 2007.
- P. B. Cotton, D. A. Garrow, J. Gallagher, and J. Romagnuolo, “Risk factors for complications after ERCP: a multivariate analysis of 11,497 procedures over 12 years,” Gastrointestinal Endoscopy, vol. 70, no. 1, pp. 80–88, 2009.
- H. Messmann, W. Vogt, A. Holstege et al., “Post-ERP pancreatitis as a model for cytokine induced acute phase response in acute pancreatitis,” Gut, vol. 40, no. 1, pp. 80–85, 1997.
- R. P. Sah, R. K. Dawra, and A. K. Saluja, “New insights into the pathogenesis of pancreatitis,” Current Opinion in Gastroenterology, vol. 29, no. 5, pp. 523–530, 2013.
- R. Sotoudehmanesh, M. A. Eloubeidi, A. A. Asgari, M. Farsinejad, and M. Khatibian, “A randomized trial of rectal indomethacin and sublingual nitrates to prevent post-ERCP pancreatitis,” The American Journal of Gastroenterology, vol. 109, no. 6, pp. 903–909, 2014.
- B. Leerhoy, A. Nordholm-Carstensen, S. Novovic, M. B. Hansen, and L. N. Jorgensen, “Diclofenac is associated with a reduced incidence of post-endoscopic retrograde cholangiopancreatography pancreatitis: results from a Danish cohort study,” Pancreas, vol. 43, no. 8, pp. 1286–1290, 2014.
- H. F. Dai, X. W. Wang, and K. Zhao, “Role of nonsteroidal anti-inflammatory drugs in the prevention of post-ERCP pancreatitis: a meta-analysis,” Hepatobiliary & Pancreatic Diseases International, vol. 8, no. 1, pp. 11–16, 2009.
- S. Tammaro, R. Caruso, F. Pallone, and G. Monteleone, “Post-endoscopic retrograde cholangio-pancreatography pancreatitis: is time for a new preventive approach?” World Journal of Gastroenterology, vol. 18, no. 34, pp. 4635–4638, 2012.
- Y. K. Cheon, K. B. Cho, J. L. Watkins et al., “Efficacy of diclofenac in the prevention of post-ERCP pancreatitis in predominantly high-risk patients: a randomized double-blind prospective trial,” Gastrointestinal Endoscopy, vol. 66, no. 6, pp. 1126–1132, 2007.
- C. D. van der Marel, B. J. Anderson, J. Romsing, E. Jacqz-Aigrain, and D. Tibboel, “Diclofenac and metabolite pharmacokinetics in children,” Paediatric Anaesthesia, vol. 14, no. 6, pp. 443–451, 2004.
- B. Leerhøy, A. Nordholm-Carstensen, S. Novovic, M. B. Hansen, and L. N. Jørgensen, “Effect of body weight on fixed dose of diclofenac for the prevention of post-endoscopic retrograde cholangiopancreatography pancreatitis,” Scandinavian Journal of Gastroenterology, vol. 16, no. 8, p. 1, 2016.
- H. Luo, L. Zhao, J. Leung et al., “Routine pre-procedural rectal indometacin versus selective post-procedural rectal indometacin to prevent pancreatitis in patients undergoing endoscopic retrograde cholangiopancreatography: a multicentre, single-blinded, randomised controlled trial,” The Lancet, vol. 387, no. 10035, pp. 2293–2301, 2016.
- A. Senol, U. Saritas, and H. Demirkan, “Efficacy of intramuscular diclofenac and fluid replacement in prevention of post-ERCP pancreatitis,” World Journal of Gastroenterology, vol. 15, no. 32, pp. 3999–4004, 2009.
- M. Yaghoobi, S. Rolland, K. A. Waschke et al., “Meta-analysis: rectal indomethacin for the prevention of post-ERCP pancreatitis,” Alimentary Pharmacology & Therapeutics, vol. 38, no. 9, pp. 995–1001, 2013.
- H. L. Sun, B. Han, H. P. Zhai, X. H. Cheng, and K. Ma, “Rectal NSAIDs for the prevention of post-ERCP pancreatitis: a meta-analysis of randomized controlled trials,” The Surgeon, vol. 12, no. 3, pp. 141–147, 2014.
- S. Sethi, N. Sethi, V. Wadhwa, S. Garud, and A. Brown, “A meta-analysis on the role of rectal diclofenac and indomethacin in the prevention of post-endoscopic retrograde cholangiopancreatography pancreatitis,” Pancreas, vol. 43, no. 2, pp. 190–197, 2014.










Άφησε σχόλιο