Η θεραπευτική αντιμετώπιση του ΣΔΤ2 αποσκοπεί στην ουσιαστική μείωση ή και αποτροπή των επιπλοκών του διαβήτη. Ουσιαστικό ρόλο στα πλαίσια της πολυπαραγοντικής αντιμετώπισης του διαβητικού ασθενούς διαδραματίζει η επίτευξη γλυκαιμικής ρύθμισης όσο το δυνατόν νωρίτερα στη διαδρομή εξέλιξης του διαβητικού συνδρόμου αλλά και η διατήρηση της ρύθμισης αυτής.
Για την υλοποίηση του θεραπευτικού αυτού στόχου σήμερα διαθέτουμε αξιόπιστες γνωστές κλασικές αγωγές αλλά και νέα ασφαλή και αποτελεσματικά θεραπευτικά μέσα. Τις αντιδιαβητικές θεραπευτικές κατηγορίες που εμπεριέχονται στους θεραπευτικούς αλγόριθμους (δεν εμπεριέχονται οι γλινίδες και οι αναστολείς α-γλυκοσιδάσης και γι΄αυτό δε θα αναφερθούν) θα αναλύσουμε και στη συνέχεια θα εξετάσουμε ποιες και πότε συνδυάζονται με τη μετφορμίνη (αναμφισβήτητο πρώτο θεραπευτικό βήμα) στα πλαίσια του δεύτερου και τρίτου θεραπευτικού βήματος, με στόχο την επιθυμητή γλυκαιμική ρύθμιση (HbA1c < 7% γενικώς, A1c < 6,5% στους νεοδιαγνωσμένους και 8%<A1c >7% στους χρόνιους διαβητικούς με παρουσία επιπλοκών).
Σουλφονυλουρίες
Οι σουλφονυλουρίες είναι ινσουλινοεκκριτικά φάρμακα. Δρουν στο παγκρεατικό β-κύτταρο, αυξάνουν την έκκριση ινσουλίνης και κατ’ αυτόν τον τρόπο ελαττώνουν τα επίπεδα σακχάρου στο αίμα. Η δράση στο β-κύτταρο γίνεται μέσω σύνδεσης της σουλφονυλουρίας με τον υποδοχέα σουλφονυλουρίας (SUR 1) με αποτέλεσμα κλείσιμο των διαύλων Ca++, εισροή Ca++ στο β-κύτταρο, σύσπαση μικροκυστιδίων ινσουλίνης, έκκριση ινσουλίνης.
Οι σουλφονυλουρίες είναι ιδιαίτερα δραστικές στην αγωγή του συμπτωματικού διαβητικού ασθενούς λόγω της ταχείας έναρξης δράσης τους και τουλάχιστον για κάποιο χρονικό διάστημα, της αποτελεσματικότητάς τους (μειώνουν την HbA1c κατά 1,5% σαν μονοθεραπεία κατά μέσο όρο).
Η διατήρηση του γλυκαιμικού ελέγχου με τη σουλφονυλουρία διαρκεί λιγότερο σε σύγκριση με άλλα αντιδιαβητικά φάρμακα, όπως οι γλιταζόνες και η μετφορμίνη (όπως έδειξε η μελέτη ADOPT).
Η κύρια ανεπιθύμητη ενέργεια είναι η υπογλυκαιμία, η οποία συμβαίνει συχνότερα στα ηλικιωμένα άτομα. Από μελέτες φαίνεται ότι η συχνότητα εμφάνισης της ήπιας υπογλυκαιμίας είναι 2-4% και της σοβαρής 0,2 έως 0,4 περιπτώσεις/1000 άνθρωποι/έτη.
Άλλη ανεπιθύμητη ενέργεια είναι η αύξηση του σωματικού βάρους (περίπου 2 κιλά).
Συμπερασματικά, οι σουλφονυλουρίες αποτελούν μια αποτελεσματική, αξιόπιστη και οικονομική αγωγή. Στα θετικά τους, επίσης, καταγράφεται η μακρόχρονη εμπειρία από τη χρησιμοποίησή τους, ενώ στα αρνητικά ο κίνδυνος ανεπιθύμητων ενεργειών (υπογλυκαιμίες).
Θειαζολιδινεδιόνες (TZDs)
Οι TZDs ή γλιταζόνες (ροσιγλιταζόνη και πιογλιταζόνη, σήμερα κυκλοφορεί μόνο η τελευταία) είναι αντιδιαβητικοί παράγοντες που δρουν αυξάνοντας την ευαισθησία των ιστών στη δράση της ινσουλίνης, γι’ αυτό καλούνται και «ευαισθητοποιητές της ινσουλίνης».
Η δράση τους επιτυγχάνεται μέσω ενεργοποιήσεως ειδικών πυρηνικών υποδοχέων των PPARγ υποδοχέων.
Οι TZDs σαν μονοθεραπεία, οδηγούν σε ελάττωση της HbA1c κατά 0,5-1,4%, ενώ φαίνεται ότι παρουσιάζουν και άλλες «πλειοτροπικές» δράσεις:
- Βελτίωση της λιπιδαιμικής εικόνας. Ιδιαίτερα η πιογλιταζόνη η οποία φαίνεται πως παρουσιάζει και δράση ευοδωτική των PPARα υποδοχέων, με αποτέλεσμα σαφή υπολιπιδαιμική δράση. Ενδεικτικά, στη μελέτη PROACTIVE, η πιογλιταζόνη μείωσε κατά 12% τα τριγλυκερίδια και αύξησε κατά 19% την HDL.
- Μείωση των επιπέδων της αρτηριακής πίεσης. Στις διάφορες μελέτες φαίνεται μια μείωση κατά 4 mmHg της συστολικής και κατά 2 mmHg της διαστολικής.
- Σημαντική δράση σε πολλούς παράγοντες και πτυχές της αθηροσκληρωτικής διαδικασίας (μείωση NEKB, MCP-1, PAI-1, μικρολευκωματινουρίας κ.λπ.)
Η καλά τεκμηριωμένη, προοπτική, πολυκεντρική, τυχαιοποιημένη μελέτη PROACTIVE έδειξε σημαντική διαφορά στο κύριο δευτερεύον καταληκτικό σημείο (θάνατος, έμφραγμα μυοκαρδίου, ΑΕΕ) Η ομάδα της πιογλιταζόνης παρουσίασε σημαντική μείωση κατά 16% (p<0,02) του τελικού αυτού σημείου. Μετα-ανάλυση, επίσης, 29 μελετών μικρής και μεγάλης διάρκειας (4 μήνες έως 3,5 χρόνια) έδειξε ότι η πιογλιταζόνη μείωνε σημαντικά, κατά 18% (p=0,005), τον κίνδυνο εμφάνισης θανάτου, εμφράγματος μυοκαρδίου και ΑΕΕ. Φαίνεται, έτσι, ότι η πιογλιταζόνη όχι μόνο δεν αυξάνει τον καρδιαγγειακό κίνδυνο, αλλά υπάρχουν ισχυρά δεδομένα ότι συμβάλλει στη μείωσή του.
Και οι δύο γλιταζόνες πάντως παρουσιάζουν σαν παρενέργεια τον αναμφισβήτητα αυξημένο κίνδυνο καρδιακής ανεπάρκειας (περίπου διπλάσιος). Η καρδιακή ανεπάρκεια των TZDs προκύπτει σαν αποτέλεσμα υπερφόρτωσης υγρών και διαστολής του εξωκυττάριου όγκου. Δεν προκύπτει από τις μελέτες, τοξική βλάβη των TZDs στο μυοκάρδιο και εξ’ αυτής της βλάβης ανάπτυξη καρδιακής ανεπάρκειας.
Άλλες ανεπιθύμητες ενέργειες των TZDs, είναι η αύξηση βάρους, η μικρή μείωση του αιματοκρίτη (λόγω κυρίως αιμαραίωσης) και ο αυξημένος κίνδυνος καταγμάτων στις μεταεμμηνοπαυσιακές γυναίκες. Αναφορικά με την αύξηση βάρους (περίπου 3-4 kg τον πρώτο χρόνο), οι μελέτες δείχνουν αύξηση κυρίως του υποδόριου λίπους και μείωση του ενδοκοιλιακού λίπους (ανακατανομή λίπους).
Συμπερασματικά, οι TZDs είναι αντιδιαβητικοί παράγοντες με αξιόλογο προφίλ αποτελεσματικότητας που στοχεύουν αξιόπιστα στη βασική παθοφυσιολογική πτυχή του διαβητικού συνδρόμου που είναι η ινσουλινοαντίσταση, με κάποιες ενδεχόμενες ανεπιθύμητες ενέργειες που απαιτούν παρακολούθηση και επιλογή των ατόμων που θα λάβουν την αγωγή αυτή.
Ινκρετινικές αγωγές – Αναστολείς DPP-4
Οι αναστολείς DPP-4 αποτελούν νέα θεραπευτική προσέγγιση στο ΣΔΤ2. Με πρόσδεση τους στην καταλυτική θέση του ενζύμου DPP-4 (ένζυμο που αποδομεί και απενεργοποιεί τις κυκλοφορούσες ινκρετινικές ορμόνες GLP-1 και GIP), οι αναστολείς DPP-4 εκδηλώνουν ιδιαίτερα εκλεκτική και ισχυρή φαρμακευτική δράση, με υψηλή ασφάλεια.
Τα μόρια αυτά:
- Επιτυγχάνουν κλινικά σημαντική μείωση της γλυκόζης πλάσματος (νηστείας και μεταγευματικές τιμές) και μείωση της HbA1c κατά 0,5% έως 0,8%.
- Είναι δραστικά και ασφαλή, χορηγούμενα από το στόμα.
- Παρουσιάζουν μεταξύ τους διαφορές στην κλινική τους εφαρμογή (πχ δοσολογικό σχήμα, χορήγηση επί νεφρικής ή ηπατικής ανεπάρκειας, προσαρμογή δόσης επί συγχορήγησης με άλλους φαρμακευτικούς παράγοντες).
- Γίνονται καλά ανεκτοί από τους ασθενείς και έχουν καλό προφίλ ασφάλειας.
- Ενέχουν ελάχιστο κίνδυνο πρόκλησης υπογλυκαιμίας.
- Ασκούν ουδέτερη επίδραση στο σωματικό βάρος.
- Δεν παρουσιάζουν ιδιαίτερες παρενέργειες (συχνότερες ρινοφαρυγγίτιδα, κεφαλαλγία). Πρόσφατα μεγάλες τυχαιοποιημένες μελέτες με saxagliptin ή alogliptine (SAVOR, EXAMINE) απενοχοποίησαν απόλυτα τους αναστολείς DPP-4 από τον έως τώρα φημολογούμενο κίνδυνο οξείας παγκρεατίτιδας, Ca παγκρέατος, λοιμώξεων ανωτέρου αναπνευστικού, δερματικών εκδηλώσεων.
Αξιοσημείωτα επίσης είναι τα δεδομένα των προοπτικών – τυχαιοποιημένων καρδιαγγειακών μελετών που αφορούν τους περισσότερους των αναστολέων DPP-4. Ήδη έχουν δημοσιευθεί οι μελέτες SAVOR – TIMI (για τη σιταγλιπτίνη), EXAMINE (για την αλογλιπτίνη), TECOS (για τη σιταγλιπτίνη). Και οι τρεις μελέτες τεκμηρίωσαν την καρδιαγγειακή ασφάλεια των αναστολέων αυτών (μη κατωτερότητα σε σχέση με placebo.). Ενδιαφέροντα είναι επίσης και τα δεδομένα που προέκυψαν σχετικά με τη σχέση των αναστολέων DPP-4 με τον αυξημένο κίνδυνο νοσηλείας για καρδιακή ανεπάρκεια (ΚΑ). Έτσι στην SAVOR η σαξαγλιπτίνη σχετίσθηκε με σημαντικά αυξημένο κίνδυνο νοσηλείας για ΚΑ (Hazard Ratio 1,27), γεγονός που δεν επιβεβαιώθηκε με την αλογλιπτίνη (HR=1,07) και σιταγλιπτίνη (HR=1,00) Συμπερασματικά, οι αναστολείς DPP-4, αποτελούν νέα κατηγορία αντιδιαβητικών παραγόντων με ελάχιστες ανεπιθύμητες ενέργειες, που δεν προκαλούν υπογλυκαιμίες, με ουδέτερη επίδραση στο σωματικό βάρος, με αποδεδειγμένη καρδιαγγειακή ασφάλεια και με μοναδικό μειονέκτημα το αυξημένο κόστος.
Αγωνιστές GLP-1
Οι αγωνιστές GLP-1 δρουν στους υποδοχείς GLP-1 και έχουν κατ’αυτό τον τρόπο δράση GLP-1 πολλαπλάσιας ισχύος (έως και 5 φορές) σε σχέση με τη δράση του ενδογενούς GLP-1.
Οι αγωνιστές GLP-1 διακρίνονται σε βραχείας και μακράς διάρκειας δράσης, με διαφορετική, ανάλογα με τη διάρκεια της δράσης τους, δυναμική μείωσης της συγκέντρωσης της γλυκόζης νηστείας και των μεταγευματικών τιμών γλυκόζης. Οι βραχείας δράσης αγωνιστές (εξενατίδη και λιξισενατίδη) μειώνουν κυρίως τα μεταγευματικά σάκχαρα, ενώ οι μακράς δράσης αγωνιστές (λιραγλουτίδη, LAR εξενατίδη) τα νηστείας.
Από τα ανάλογα του GLP-1:
- Η εξενατίδη χορηγείται δύο φορές την ημέρα με υποδόρια ένεση και μειώνει την HbA1c κατά 0,5-1%, κυρίως μειώνοντας τα μεταγευματικά επίπεδα γλυκόζης.
- Η λιξισενατίδη (ανάλογο βραχείας δράσης επίσης) με χρόνο ημίσειας ζωής 3-4 ώρες παρουσιάζει τις δράσεις της εξενατίδης με μείωση της A1c 0,7-1% μείωση του σωματικού βάρους 1-3 kg.
- Η λιραγλουτίδη είναι αποτελεσματική στη μείωση της HbA1c ενώ ταυτόχρονα, στους παχύσαρκους ασθενείς, προκαλεί σημαντική μείωση του σωματικού βάρους. Η λιραγλουτίδη σε δοσολογία 3mg, είναι πλέον αποδεκτή από FDA και ΕΜΑ ως φάρμακο για την αντιμετώπιση της παχυσαρκίας. Στα μειονεκτήματα του φαρμάκου συγκαταλέγονται το κόστος, η μικρή αύξηση της καρδιακής συχνότητας (2-5 σφύξεις) και οι γαστρεντερικές διαταραχές. Ενδιαφέρων είναι ο συνδυασμός IDeglira (συνδυασμός λιραγλουτίδης και βασικής ινσουλίνης deglutec σε σταθερή αναλογία έως 1,8 mg/50 μονάδες) που ήδη κυκλοφορεί και παρουσιάζει εντυπωσιακή αποτελεσματικότητα (μελέτες DUAL, μείωση της HbA1c έως 1,9%).
Η εβδομαδιαία εξενατίδη και η ντουλαγλουτίδη είναι εβδομαδιαίοι αγωνιστές GLP-1 με εξαιρετικά δεδομένα αποτελεσματικότητας (πρόγραμμα μελετών DURATION, AWARD αντίστοιχα), με μείωση A1c από 1,3 έως 1,9% (baseline HbA1c 8-8,5%), μείωση σωματικού βάρους από 2,5 έως 3,7 kg, μείωση συστολικής αρτηριακής πίεσης 4-6 mmHg αλλά και σχετικά καλά δεδομένα ασφάλειας (κυρίως γαστρεντερικές παρενέργειες αλλά πιο ήπιες σχετικά με τις αντίστοιχες των βραχέων αγωνιστών GLP-1).
Αναφορικά με τις καρδιαγγειακές μελέτες των αγωνιστών GLP-1 πρέπει να αναφερθεί η μελέτη ELIXA (μελέτη της Lixisenatide) που τεκμηρίωσε την καρδιαγγειακή ασφάλεια της Lixisenatide (για το πρωτογενές τελικό σημείο HR=1,02 και για τον κίνδυνο νοσηλείας για καρδιακή ανεπάρκεια HR=0,96). Αναφορικά με τη μελέτη LEADER (μελέτη της liraglutide), σημειώνονται εμφαντικά τα ιδιαίτερα ευνοϊκά δεδομένα για την Liraglutide: Σημαντική μείωση 14% του πρωτογενούς τελικού σημείου (Θάνατος + ΑΕΕ + ΟΕΜ), μείωση 22% των καρδιαγγειακών θανάτων, αριθμητική μείωση εμφραγμάτων και αγγειακών εγκεφαλικών επεισοδίων.
Αναστολείς SGLT-2
Οι SGLTs (SGLT-1 και SGLT-2) είναι κυτταρικές πρωτεΐνες, συμμεταφορείς νατρίου και γλυκόζης που συμβάλλουν στην επαναρρόφηση της διηθούμενης γλυκόζης στους νεφρούς.
Οι αναστολείς των SGLT-2 με ποικίλλουσες ειδικότητες (χωρίς μεγάλες διαφορές) για τους μεταφορείς (νταπαγλιφλοζίνη, καναγλιφλοζίνη, εμπαγλιφλοζίνη -οι σε κυκλοφορία αναστολείς-) αναστέλλουν σε μεγάλο βαθμό την επαναρρόφηση της γλυκόζης και αυξάνουν την απέκκριση γλυκόζης στα ούρα. Με τον μηχανισμό αυτό δράσης οι αναστολείς SGLT-2 (γλιφλοζίνες) μειώνουν δραστικά την υπεργλυκαιμία. Υπολογίζεται ότι καθημερινά με τη χορήγηση αναστολέων SGLT-2 αποβάλλονται με τα ούρα 70-80g γλυκόζης. Η αυξημένη αποβολή γλυκόζης συμβάλλει και στην απώλεια βάρους (περίπου 300 θερμίδες ημερησίως) όπως επίσης μερικώς και στη μείωση της αρτηριακής πίεσης.
Οι αναστολείς SGLT-2 είναι σχετικά αποτελεσματικά φάρμακα όσον αφορά τη γλυκαιμική ρύθμιση (μείωση A1C 0.6 έως 1% στη μονοθεραπεία όταν baseline A1C=8%) αλλά κυρίως παρουσιάζουν και πολυπαραγοντικές επιδράσεις (απώλεια βάρους 2-3 kg, μείωση της συστολικής αρτηριακής πίεσης 3-6 mmHg και της διαστολικής 2-4 mmHg).
Οι αναστολείς SGLT-2 θεωρούνται σχετικά ασφαλή φάρμακα. Δεν αυξάνουν τον κίνδυνο υπογλυκαιμίας (μόνο όταν συγχορηγούνται με ινσουλινοεκκριτικά αυξάνει ο κίνδυνος) και δεν παρουσίασαν σοβαρές ανεπιθύμητες ενέργειες στις μελέτες φάσης ΙΙΙ. Καταγράφηκε μόνο (λόγω της αυξημένης απέκκρισης γλυκόζης στα ούρα) αυξημένος κίνδυνος ουρολοιμώξεων (έχει κίνδυνο 1,30 στις μετα-αναλύσεις) και ιδιαίτερα στις γυναίκες αυξημένος κίνδυνος μυκητιάσεων λοιμώξεων των γεννητικών οργάνων (2πλάσια έως 3πλάσια η αυξημένη επίπτωση στους ασθενείς που έλαβαν αναστολείς SGLT-2). Οι λοιμώξεις αυτές όμως ήταν αυτοθεραπευόμενες ή ανταποκρινόμενες καλά στις κλασσικές αντιμυκητιασικές αγωγές.
Κάποιες επισημάνσεις επίσης έχουν αναφερθεί από το FDA για αυξημένο κίνδυνο καταγμάτων ή και ακρωτηριασμών, κυρίως με την καναγλιφλοζίνη, ένας κίνδυνος που μπορεί να σχετίζεται με πτώσεις λόγω μείωσης του ενδαγγειακού όγκου που συνδέεται με τη θεραπεία.
Αναφορικά με τις καρδιαγγειακές μελέτες των αναστολέων SGLT-2 πρέπει να επισημανθούν ιδιαίτερα τα αποτελέσματα της EMPAREG (μελέτη της εμπαγλιφλοζίνης) της πρώτης καρδιαγγειακής μελέτης αναστολέων SGLT-2 που δημοσιεύθηκε. Σύμφωνα έτσι με τα δεδομένα της EMPAREG, η χρήση εμπαγλιφλοζίνης οδήγησε σε εντυπωσιακά σημαντική μείωση κατά 38% των καρδιαγγειακών θανάτων, κατά 32% της ολικής θνησιμότητας, κατά 35% του κινδύνου νοσηλείας για καρδιακή ανεπάρκεια και τελικά σημαντική μείωση κατά 14% του πρωτογενούς τελικού σημείου. Ιδιαίτερα ελπιδοφόρα και πρωτοποριακά αποτελέσματα καθώς σηματοδοτούν σημαντικό καρδιαγγειακό όφελος με τη χρήση μίας αντιδιαβητικής αγωγής όπως η εμπαγλιφλοζίνη.
Φαίνεται πάντως ότι η μελέτη EMPAREG αναμφισβήτητα οριοθετεί τον ορίζοντα μίας νέας εποχής για την αντιδιαβητική αγωγή και την επίδρασή της στη μείωση των καρδιαγγειακών συμβαμάτων.
Δεν εξέπληξε έτσι η σύσταση του ΕΜΑ (Ευρωπαϊκός Οργανισμός Φαρμάκων) αρχές του 2017, σύμφωνα με την οποίαν η εμπαγλιφλοζίνη ενδείκνυται για τη θεραπευτική αντιμετώπιση των ασθενών με διαβήτη και όχι απλά για την αντιμετώπιση της υπεργλυκαιμίας των ασθενών αυτών.
Πρόσφατα δημοσιεύθηκαν και τα αποτελέσματα του προγράμματος CANVAS που είναι η καρδιαγγειακή μελέτη της καναγλιφλοζίνης. Η χορήγηση της καναγλιφλοζίνης οδήγησε σε σημαντική μείωση κατά 14% που πρωτογενούς καταληκτικού σημείου (θάνατος, ΟΕΜ και ΑΕΕ), κατά 33% του κινδύνου νοσηλείας για καρδιακή ανεπάρκεια και κατά 40% του νεφρικού καταληκτικού σημείου. Διαπιστώθηκε όμως πρόβλημα αύξησης κατά 25% του κινδύνου καταγμάτων και αύξηση του κινδύνου ακρωτηριασμών κάτω άκρων (κυρίως στους ασθενείς με ιστορικό ακρωτηριασμού ή περιφερικής αγγειοπάθειας).
Το 2017 δημοσιεύθηκαν επίσης τα δεδομένα μεγάλης μελέτης παρατήρησης (6 χωρών) της CVD REAL (309.056 ασθενείς με ΣΔ2 – 154,528 έλαβαν SGLT-2 inh. – FU=10 μήνες). Η ομάδα των SGLT-2 (στην Ευρώπη κατά 90% ήταν η νταπαγλιφλοζίνη) παρουσίασε μείωση κατά 40% του κινδύνου νοσηλείας για καρδιακή ανεπάρκεια και μείωση κατά 51% του κινδύνου θανατηφόρων συμβαμάτων.
Φαίνεται έτσι ότι υπάρχει μια σταθερή καρδιαγγειακά ωφέλιμη δράση των SGLT-2 αναστολέων, μια ευνοϊκή καρδιαγγειακή επίδραση που αφορά και τους τρείς αναστολείς SGLT-2 (class – effect δράση).
Θεραπευτική στρατηγική στο ΣΔΤ2 – 2ο και 3ο Θεραπευτικό βήμα
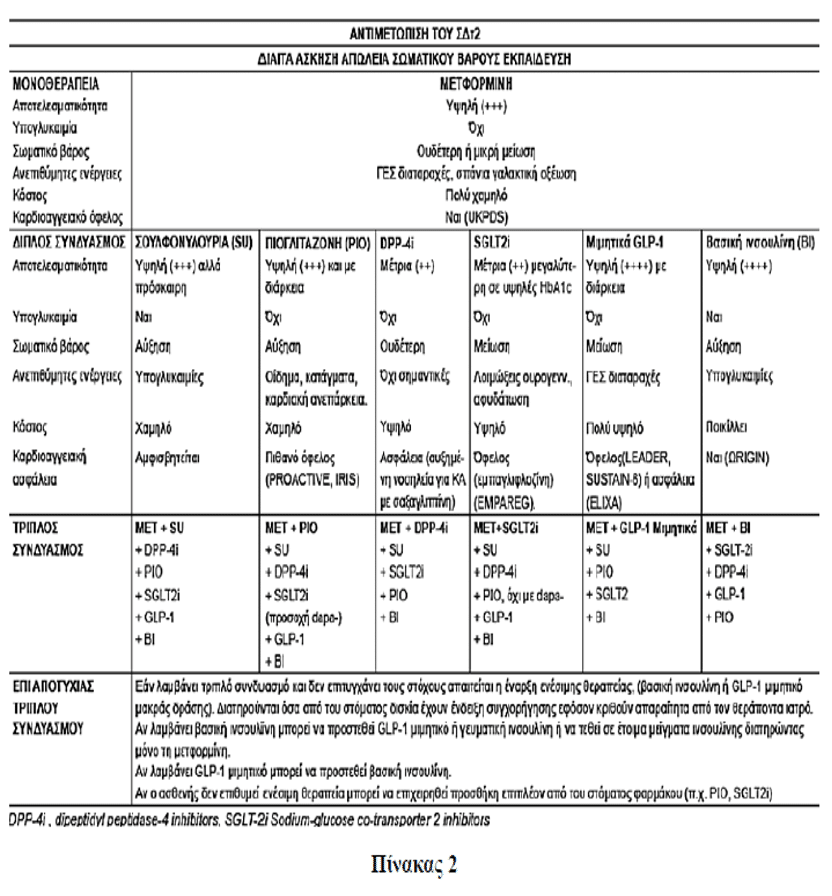
Ενώ είναι αναμφισβήτητη η κυριαρχική θέση της μετφορμίνης (λόγω evidence based medicine και σημαντικής κυριαρχίας του οφέλους έναντι του κόστους των ανεπιθύμητων ενεργειών) στο πρώτο θεραπευτικό βήμα της αντιμετώπισης των ατόμων με ΣΔΤ2, γίνεται πρόβλημα επιλογής μεταξύ πολλαπλών επιλογών η υπόθεση του δεύτερου θεραπευτικού βήματος.
Το ADA και EASD από το 2012 καθόρισαν κριτήρια για την επιλογή κάποιας από τις πτυχές του 2ου θεραπευτικού βήματος ως προσθήκη στη μετφορμίνη. Έτσι, προσδιόρισαν ως κριτήρια επιλογής την αποτελεσματικότητα, την υπογλυκαιμία, την αύξηση ή μη του σωματικού βάρους, τις ανεπιθύμητες ενέργειες και το οικονομικό κόστος. Στα κριτήρια αυτά η Ελληνική Διαβητολογική Εταιρεία στις κατευθυντήριες οδηγίες 2017 προσέθεσε και τα εξής κριτήρια:
- Μηχανισμοί Δράσης.
- Οι ενδεχόμενες ευεργετικές επιδράσεις πέρα της αντιϋπεργλυκαιμικής, ιδίως στο καρδιοαγγειακό σύστημα.
- Η ευκολία χορήγησης.
- Η νεφρική λειτουργία.
- Η τυχόν ύπαρξη καρδιακής ανεπάρκειας.
- Η τυχόν ύπαρξη ηπατικής ανεπάρκειας.
- Το κόστος, τόσο για τον ασθενή όσο και για το σύστημα υγείας (άμεσο και έμμεσο από τις ενδεχόμενες ανεπιθύμητες ενέργειες του φαρμάκου).
Πρυτανεύει ως εκ τούτου ανάλυση του μεταβολικού και όχι μόνο προβλήματος του ασθενούς για την επιλογή της πλέον κατάλληλης για τον ασθενή θεραπευτικής επιλογής.
• Εάν το κυρίαρχο είναι η αποτελεσματικότητα της επιλογής, η μείωση δηλαδή της HbA1c, τότε μετά την ινσουλίνη οι αγωνιστές GLP-1, η πιογλιταζόνη και οι σουλφονυλουρίες έχουν τα καλύτερα (βάσει δεδομένων) εχέγγυα.
• Εάν το κύριο είναι η αποφυγή των υπογλυκαιμιών τότε οι ινκρετινικές αγωγές (αναστολείς DPP-4, αγωνιστές GLP-1), η πιογλιταζόνη και οι αναστολείς SGLT – 2 έχουν πρόκριμα επιλογής.
• Εάν η επιλογή της μη πρόσκτησης σωματικού βάρους είναι σημαντική (π.χ. επί παχύσαρκων διαβητικών), τότε η λύση των αγωνιστών GLP-1 φαίνεται ως απολύτως ειδική με εναλλακτική λύση μικρότερης απόδοσης τους αναστολείς SGLT-2.
• Εάν η επιλογή της αποφυγής των παρενεργειών είναι κυρίαρχη για ένα ασθενή με πολλές συννοσηρότητες τότε η επιλογή των αναστολέων DPP-4 έχει πρόκριμα.
• Εάν η υπόθεση του (βραχύχρονου) κόστους είναι απαγορευτική για την επιλογή των νέων ινκρετινικών αγωγών τότε η θεραπευτική λύση της σουλφονυλουρίας (και ιδιαίτερα της μη καρδιοτοξικής γλικλαζίδης) φαντάζει ως θεραπευτικός μονόδρομος.
Μετά πάντως τα εξαιρετικά δεδομένα καρδιαγγειακού οφέλους που προέκυψαν από τις μεγάλες καρδιαγγειακές μελέτες (EMPAREG, LEADER, CANVAS), η Αμερικανική Διαβητολογική Εταιρεία το 2018, αλλά και η ΕΔΕ, επαναπροσδιορίζουν τις κατευθυντήριες οδηγίες τους για τους διαβητικούς ασθενείς με ιστορικό καρδιαγγειακής νόσου (Στεφανιαία νόσος, Καρδιακή ανεπάρκεια). Έτσι, επί παρουσίας στεφανιαίας νόσου, η ADA το 2018 προκρίνει μετά τη μετφορμίνη την επιλογή της εμπαγλιφλοζίνης ή της λιραγλουτίδης (ένδειξη Α) ή της καναγλιφλοζίνης (ένδειξη C) ή της νταπαγλιφλοζίνης (ΕΔΕ 2018) και κατά δεύτερο λόγο την επιλογή της σιταγλιπτίνης και μετά της αλογλιπτίνης και της γλικλαζίδης.
Επί παρουσίας καρδιακής ανεπάρκειας η ADA προκρίνει, μετά τη μετφορμίνη, την επιλογή της εμπαγλιφλοζίνης ή της καναγλιφλοζίνης ενώ ακολουθεί η επιλογή της νταπαγλιφλοζίνης, της σιταγλιπτίνης, της αλογλιπτίνης και της βιλνταγλιπτίνης (ΕΔΕ 2018).
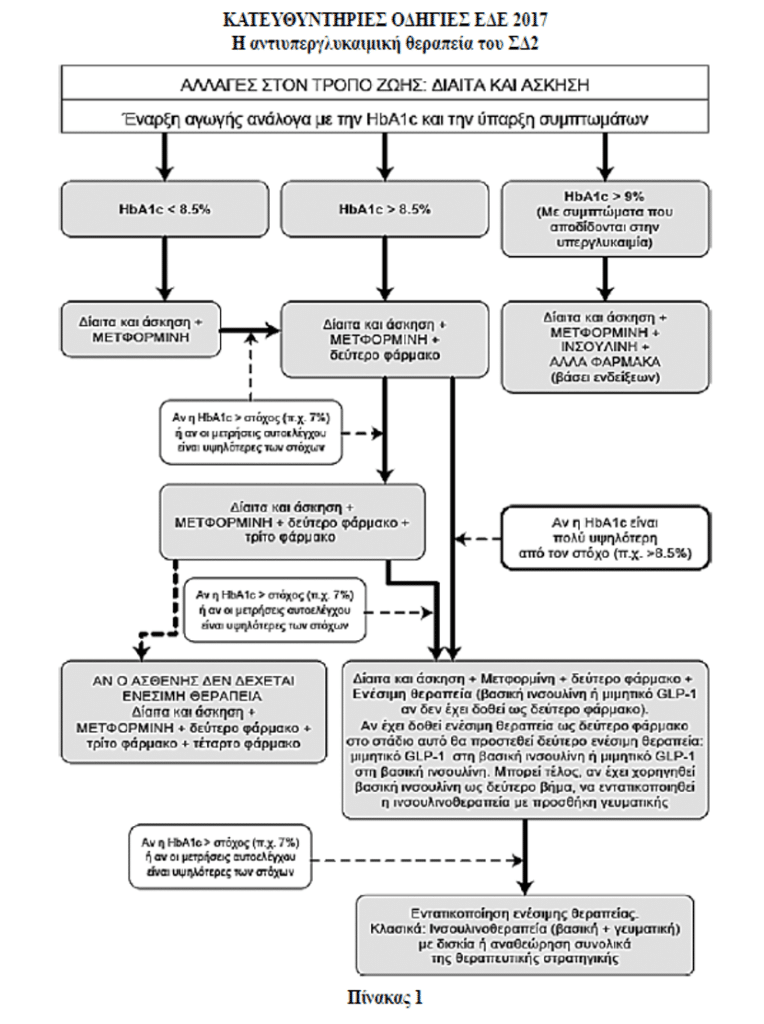
Επί παρουσίας χρόνιας νεφρικής νόσου σταδίου 3 ή 4 χορηγείται κατά προτίμηση πιογλιταζόνη ή και λιναγλιπτίνη (εναλλακτικά προσαρμοσμένη δόση από τους άλλους αναστολείς DPP-4, Βιλνταγλιπτίνη 50mg ή αλογλιπτίνη 6,25mg).
Εάν δεν επιτευχθεί ο στόχος με την προσθήκη δευτέρου φαρμάκου εκ των εχόντων έγκριση για προσθήκη στη μετφορμίνη στα πλαίσια του 2ου θεραπευτικού βήματος (βλ. Πίνακα 2) ή προστίθεται τρίτο φάρμακο ή μπορεί το δεύτερο φάρμακο να αντικατασταθεί με άλλο άλλης κατηγορίας και επί αποτυχίας να προστεθεί και τρίτο φάρμακο από όσα έχουν έγκριση για τρίτο συνδυασμό. Η επιλογή δευτέρου ή τρίτου θεραπευτικού παράγοντα περιλαμβάνει και ενέσιμους παράγοντες: Βασική ινσουλίνη ή μιμητικά GLP-1 μακράς δράσης. Ενδιαφέρον έχει ότι στα πλαίσια του τρίτου θεραπευτικού βήματος συστήνεται και ο συνδυασμός μετφορμίνης με GLP-1 αγωνιστή και SGLT-2 αναστολέα και από την ADA το 2017 και από την ΕΔΕ 2017, βάσει των θετικών δεδομένων της μελέτης DURATION 8 για το συνδυασμό αυτό.
Επί αποτυχίας τριπλού συνδυασμού φαρμάκων, σύμφωνα με την ΕΔΕ 2017, συνδυασμός που δεν περιλαμβάνει ενέσιμη αγωγή, αντικαθιστάται με νέο συνδυασμό αγωγών που περιλαμβάνει ινσουλίνη ή και αγωνιστή GLP-1 (βλ. Πίνακα 1).
Συμπερασματικά πάντως δεν υπάρχει, βάσει δεδομένων, θεραπευτικός συνδυασμός που να υπερέχει ιδιαίτερα έναντι των άλλων γενικά και απόλυτα στα πλαίσια του 2ου αλλά και του 3ου θεραπευτικού βήματος.
Σε αυτό το ερώτημα, του καλύτερου θεραπευτικού συνδυασμού, θα απαντήσει το 2017 τεκμηριωμένα η μελέτη GRADE (προοπτική τυχαιοποιημένη μελέτη 6000 διαβητικών τύπου 2 όπου συγκρίνονται οι συνδυαστικές αντιδιαβητικές εκδοχές του συνδυασμού μετφορμίνης με κάθε θεραπευτική πτυχή του 2ου θεραπευτικού βήματος).
Μέχρι τότε η εξατομίκευση με βάση τις προτεραιότητες της θεραπείας, η επιδίωξη της καλύτερης δυνατής συμμόρφωσης του ασθενούς σε συνδυασμό με την ικανοποιητική αυτοπαρακολούθησή του και η αποτελεσματική συνεργασία ασθενούς-ιατρού για την επιλογή θεραπείας φαίνονται κυριαρχικοί στόχοι και ικανά προσδιοριστικά πλαίσια για την επιτυχή θεραπευτική αντιμετώπιση του διαβητικού ασθενούς.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Ceriello A, Ihnat MA, Thorpe JE. Clinical review 2: The “metabolic memory”: is more than just tight glucose control necessary to prevent diabetic complications? J Clin Endocrinol Metab 2009; 94: 410-415.
- ΕΔΕ 2017: Κατευθυντήριες οδηγίες για τη διαχείριση του διαβητικού ασθενούς. Σελ. 31-39.
- Α. Μελιδώνης: Σακχ. Διαβήτης 2011: Σύγχρονες προσεγγίσεις σε θέματα αιχμής. Εκδ. Παριζιάνου, σελ. 71-141.
- Yuanhui Zhang et al. Second-Line Agents for Glycemic Control for Type 2 Diabetes: Are Newer Agents Better? Diabetes Care 2014; 37: 1338-1345.
- Α. Παπαζαφειροπούλου, Α. Μελιδώνης: Εβδομαδιαίοι αγωνιστές GLP-1. Αρχεία Ελληνικής Ιατρικής Εταιρείας, 2015.
- A. Tahtani, A. Banett, C. Baily: SGLT-2 inhibitors in management of Diabetes. Lancet Diab. End. 2013; 1: 140-151.
- B. Zinman., C. Wanner, J. Lachin et al Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. NEJM 2015; 373: 2117-2128.
- American Diabetes Association. Standards of Medical Care in Diabetes 2017. Diabetes Care 2017; 40 (Supplement 1): S48-S56.
- Lund, A., Knop, F.K., Vilsboll, T. Glucagon-like peptide-1 receptor agonists for the treatment of type 2 diabetes: differences and similarities. Eur J Intern Med. 2014; 25: 407-414.
- S. Marso, G. Daniels., K. Brown-Frandsen. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes N Engl J Med 2016; 375: 311-22.
- Z. Z. Htike, F. Zaccardi, D. Papamargaritis et al Efficacy and safety of glucagon-like peptide-1 receptor agonists in type 2 diabetes: A systematic review and mixed-treatment comparison analysis. Diab Obes Metab 2017; 19: 524-536.
- S. Madsbad Review of head-to-head comparisons of glucagon-like peptide-1 receptor agonists. Diabetes, Obesity and Metabolism 2016; 18: 317-332.
- Meng Lee, Jeffrey L. Saver, Hung-Wei Liao Pioglitazone for Secondary Stroke Prevention Stroke. 2017; 48: 388-393.
- American Diabetes Association. Standards of Medical Care in Diabetes 2018. Diabetes Care 2018; (Supplement 1): 15-56.










Άφησε σχόλιο