Περίληψη
Η ουρική αρθρίτις είναι η πλέον συχνή φλεγμονώδης αρθρίτιδα, η καλύτερα κατανοητή και περισσότερο αντιμετωπίσιμη. Περίπου 1,4% του πληθυσμού έχει ουρική αρθρίτιδα, η δε επίπτωσή της αυξάνεται με την ηλικία τόσο στις γυναίκες (3%) όσο και στους άνδρες (7%). Μέχρι το 2008 για την θεραπεία της χρονίας ουρικής αρθρίτιδας υπήρχαν η αλλοπουρινόλη, αναστολέας της οξείδωσης της ξανθίνης και η ομάδα των ουρικοδιουρητικών φαρμάκων τα οποία διεγείρουν την νεφρική απέκκριση του ουρικού οξέος. Η φεβουξοστάτη προτείνεται ως εναλλακτικά της αλλοπουρινόλης. Η φεβουξοστάτη είναι αναστολέας της οξειδάσης της ξανθίνης και της δενδογενάσης της ξανθίνης. Από τις διάφορες συγκριτικές μελέτες σε ασθενείς με ουρική αρθρίτιδα βρέθηκε ότι η φεβουξοστάτη πέτυχε μεγαλύτερη επί τοις εκατόν ελάττωση του ουρικού οξέος του ορού συγκριτικά με την αλλοπουρινόλη. Από φαρμακοκινητικής και φαρμακοδυναμικής απόψεως δεν προκαλείται σημαντική απόκλιση σε ασθενείς με μετρία νεφρική ή ηπατική ανεπάρκεια. Η ανοχή του φαρμάκου είναι καλή. Η συνιστώμενη δόση είναι 80 μέχρι 120 mg άπαξ ημερησίως από το στόμα χωρίς η απορρόφησή της να επηρεάζεται από την τροπή ή αντιόξινα. Η φεβουξοστάτη είναι ένας σημαντικός υποσχόμενος παράγοντας σε ασθενείς που δεν ανέχονται την αλλοπουρινόλη, αυτοί με πολύ υψηλό ουρικό οξύ του αίματος ή με παρουσία ανθεκτικών τόφων.
Febuxostat: New Drug for Gout
Kataxaki Ε.
Abstract
Gout is a common and disabling cause of arthritis in middle -aged and elderlr populations, with its main predisposing factor being hyperuricemia (serum urate >6,8 mg/dl). Options for treatment of chronic gout until 2008 were allopurinol, a xanthine oxidase inhibiter, and gthre gruoup of drugs know us uricosurics that stimalate the renal excretion of uric acid. Febuxostat, a new xanthine oxidase inhibiter, is analternative for allopurinol. It head-to- head comparative studies on the management of gout, a greater percentage of patients achieved targer serum uric acid levels with febucostat compared with allopurinol. Its pharmaco kinetics and pharmacodynamics are not significauter altered in patients with moderate renal function or hepatic impairment. The drug is safe. Its antinyperuricemic efficacy at 80 to 120 mg/ day greater than “standard dose” of allopurinol 300 mg/day. Febuxostate may provide an important option in patients una bee to allopurinol, those with very high serum urate level or the presence of refractory tophi.
Εισαγωγή
Η υπερουριχαιμία – μπορεί να προκαλέσει ουρική αρθρίτιδα – είναι μία από τις παλαιότερες αναγνωρισθείσες νόσους. Αυτή για πρώτη φορά περιγράφηκε από τους Αρχαίους Αιγυπτίους το 2.640 π.χ. και μυθολογικώς συνδυαζόταν με κατανάλωση πλούσιας τροφής και υπερβολικού οινοπνεύματος και είχαν λάβει το όνομα «Νόσος των Βασιλέων» ή «Νόσος των Πλουσίων Ανθρώπων»1. Είναι μία από τις πλέον γνωστές μορφές της φλεγμονώδους αρθρίτιδας και προσβάλλει περίπου το 1% του γενικού πληθυσμού του Δυτικού κόσμου2. Στις ΜΠΑ έχει υπολογιστεί ότι το 2,4% του πληθυσμού μεταξύ της ηλικίας των 45-64 ετών και 3,17% της ηλικίας των 65-74 ετών πάσχουν από ουρική αρθρίτιδα3. Υπολογίζεται περίπου 2 μέχρι 6 εκατομμύρια έχουν διαγνωσμένη ουρική αρθρίτιδα4. Η συχνότητα της νόσου βαίνει αυξανόμενη και αυτή μπορεί να είναι το αποτέλεσμα σημαντικού αριθμού παραγόντων στους οποίους περιλαμβάνοντα: διαιτητικοί παράγοντες, αυξημένη μακροζωία, αυξημένος αριθμός μεταμοσχεύσεων, αυξημένη επίπτωση της υπερτάσεως, τελικό στάδιο της νεφρικής νόσου και μεταβολικό σύνδρομο και θεραπεία με ορισμένα φάρμακα, όπως είναι τα θειαζιδικά διουρητικά της αγκύλης και χαμηλό δόση ασπιρίνης5 . Στις ΗΠΑ, εντός των τελευταίων δύο δεκαετιών, η ετησία συχνότητα αυξήθηκε από 45/100.000 το 1977-1978 στο 62,3/100.000 το 1995- 19966. Η ίδια, περίπ9υ, αύξηση παρατηρείται παγκοσμίως5. Η κατάσταση αυτή σπανίως παρατηρείται στα παιδιά, αλλά προσβάλλει ενηλίκους αμφοτέρων των φύλων. Η επίπτωση της νόσου είναι τρεις φορές υψηλότερη στους άνδρες παρά τις γυναίκες προ της εμμηνοπαύσεως, αν και έχει υψηλότερη σχέση της τάξης του 8:17. Η υψηλότερη επίπτωση παρατηρείται στους μεσήλικες άρρενες και στις γυναίκες μετά την εμμηνόπαυση3-7. Υπάρχει άμεση συσχέτιση μεταξύ του κινδύνου ουρικής αρθρίτιδας και προχωρημένης ηλικίας σε αμφότερα τα φύλα.
Στοιχεία για την Νόσο
Η ουρική αρθρίτις είναι χρονία φλεγμονώδης πάθηση των αρθρώσεων, σχετιζομένη αμέσως με την παρουσία υπερουριχαιμίας. Προκαλείται από διαταραχή του μεταβολισμού του ουρικού οξέος, η οποία κλινικώς χαρακτηρίζεται από την κατακρήμνηση και εναπόθεση του ουρικού οξέος στους χώρους του αρθρικού υγρού, άλλα ανατομικά μόρια της άρθρωσης και σε άλλους ιστούς8. Αποτέλεσμα της καθίζησης αυτής είναι η πρόκληση φλεγμονής.
Η υπερουριχαιμία ορίζεται ως επίπεδο ουρικού οξέος του ορού >6,8mg/dl, είναι δε μεταβολική διαταραχή προκαλούμενη από την διαταραχή του ισοζυγίου της παραγωγής και απεκκρίσεως του ουρικού οξέος. Η διαταραχή αυτή μπορεί να έχει ως αποτέλεσμα την υπερπαραγωγή, ελαττωμένη απέκκριση ή αμφοτέρων2-9. Η ανεπαρκής νεφρική απέκκριση είναι υπεύθυνη σε ποσοστό 80-90% της υπερουριχαιμίας 2, 10.
Το ουρικό οξύ είναι το άχρηστο προϊόν του καταβολισμού του πουρικού και του λευκώματος της τροφής, είναι διαλυτό στο αίμα και η συγκέντρωσή του είναι περίπου 7 mg/dl στα φυσιολογικά άτομα. Σε υψηλές συγκεντρώσεις, αυτό κατακρημνίζεται με αποτέλεσμα τον σχηματικό μονονατριοούχων ουρικών κρυστάλλων. Οι εν λόγω τυπικώς ομοιάζοντες με βελόνη κρύσταλλοι πυροδοτούν την φαζοκυτταρική εξεργασία με αποτέλεσμα την ανάπτυξη υψηλού βαθμού φλεγμονώδους αρθρίτιδας, γνωστής ως ουρική αρθρίτις. Παράγοντες που ευνοούν στην ενδοαρθρική εναπόθεση κρυστάλλων στους οποίους περιλαμβάνονται η χαμηλή θερμοκρασία, αφυδάτωση, παρουσία της χονδροϊτίνης, μη διαλυτά κολλαγόνα και πρωτεογλυκάνες8. Ο κίνδυνος σχηματισμού κρυστάλλων επίσης αυξάνεται με την αύξηση της συγκεντρώσεως του ουρικού οξέος του αίματος.
Η συχνότητα του σχηματισμού κρυστάλλων σε υγιή άρρενα άτομα με το επίπεδο του ουρικού οξέος <7 mg/dl είναι χαμηλή (0,1%) συγκριτικά με το 4,9% σε άτομα με επίπεδο ουρικού οξέος του αίματος >9 mg/dl7.
Όπως ήδη αναφέρθηκε, η υπερουριχαιμία ορίζεται ως επίπεδο ουρικού οξέος του αίματος >7 mg/dl στους άνδρες και γυναίκες μετά την εμμηνόπαυση και >6 mg/dl για γυναίκες προ της εμμήνου παύσεως. Πλέον του 90% του ουρικού οξέος απεκκρίνεται από τους νεφρούς και η ελαττωμένη νεφρική απέκκριση ευθύνεται για το 80-90% της συχνότητας της υπερουριχαιμίας. Νεφροπάθεια οφειλόμενη στην έκθεση χαμηλής περιβαντολλογικής μολύβδου και κυκλοσπορίνης έχει βρεθεί ότι ελαττώνει την απέκκριση του ουρικού οξέος και δια τούτο αυξάνει την συχνότητα της υπέρουριχαιμίας και ουρικής αρθρίτιδας. Η ασπιρίνη σε υψηλές δόσεις (>3 g ημερησίως) είναι ουρικοζουρική αλλά το σχήμα χαμηλής δόσης (75mg ημερησίως) έχει βρεθεί ότι ελαττώνει την απέκκριση του ουρικού οξέος κατά 15%, προκαλούσα την αύξηση του επιπέδου του ουρικού οξέος του ορού και της συχνότητας ουρικής αρθρίτιδας. Η μακράς διαρκείας χρήση των διουρητικών ελαττώνει την απέκκριση και αυξάνει την επαναπορρόφηση του ουρικού οξέος, με αποτέλεσμα τον αυξημένο κίνδυνο της ουρικής αρθρίτιδας, παρ* όλον ότι σε μία πρόσφατη μελέτη δεν διαπιστώθηκαν στοιχεία ότι αυξάνει ο κίνδυνος της ουρικής αρθρίτιδος με τα διουρητικά8,11. Άλλα πιθανώς φάρμακα συνδεόμενα με την πρόκληση υπερουριχαιμίας είναι η λεβουτόπα, πυραζιναμίδη, εθαμπουτόλη και νιασίνη. Υπερπαραγωγή ουρικού οξέος, προκαλούσα αυξημένο κίνδυνο ουρικής αρθρίτιδας, έχει παρατηρηθεί σε ασθενείς με λέμφωμα ή άλλες λεμφοϋπερπλαστικές διαταραχές και σε ασθενείς με ψωρίαση. Υπερπαραγωγή ουρικού οξέος μπορεί επίσης να παρατηρηθεί σε άτομα με υπερβολική κατανάλωση οινοπνεύματος, κυρίως μπύρας, μεγάλη λήψη φρουκτόζης ή υψηλής καταναλώσεως ζωικών τροφών πλούσιες σε πουρίνες 12,13. Πέραν των γενετικών ανωμαλιών αυξημένης ηλικίας και άρρενος φύλου, άλλοι σημαντικοί παράγοντες για την ανάπτυξη της υπερουριχαιμίας και ουρικής αρθρίτιδας περιλαμβάνουν την υπέρταση, αυξημένο δείκτη μάζας σώματος, παχυσαρκία. μεταβολικό σύνδρομο, υπερχοληστεριναιμία, νεφρική ανεπάρκεια και υποθυρεοειδισμό 2,3,5.
Σύγχρονες Θεραπευτικές Απόψεις επί της Υπερουριχαιμίας και Ουρικής Αρθρίτιδας
Η ιδεώδης αντιμετώπιση της ουρικής αρθρίτιδας συμπεριλαμβάνει την εφαρμογή φροντίδας για την ταχεία και ασφαλή εξάλειψη της φλεγμονής και του άλγους, την πρόληψη των υποτροπιαζουσών κρίσεων και την πρόληψη του σχηματισμού τόφων, οι οποίοι πιθανώς προκαλούν καταστροφική αρθροπάθεια και νεφρική βλάβη. Πρέπει, επίσης, να εξετάζεται η θεραπεία των υποκειμένων συνυπαρχόντων παθολογικών καταστάσεων και τροποποιήσεις της διαίτης και του τρόπου ζωής14.
Για τους ασθενείς με συμπτώματα οξείας ουρικής αρθρίτιδας έχει βρεθεί ότι είναι αποτελεσματικά για την ταχεία ανακούφιση τα ακόλουθα φάρμακα : κολχικίνη από το στόμα, μη στεροειδή αντιφλεγμονώδη φάρμακα (ινδομεθασίνη, ναπροξένη, σουλινδάκη) και τα γλυκοκορτικοειδή (χορηγούμενα από το στόμα, ενδοαρθρικώς, ενδομυϊκώς ή ενδοφλεβίως – για ασθενείς μη ανεχόμενοι ή μη ανταποκρινόμενοι στην κολλικίνη ή μη στεροειδή αντιφλεγμονώδη φάρμακα) 15.
Η χρονία ουρική αρθρίτιδα χαρακτηρίζεται από την ανάπτυξη τόφων. Πρόκειται συνήθως για ασθενείς με μακρό ιστορικό ουρικής αρθρίτιδας διαρκείας άνω των 10 ετών, με συχνές κρίσεις, που έχουν σταθερά υψηλά επίπεδα ουρικού οξέος και δεν υποβλήθηκαν σε κατάλληλη θεραπευτική αγωγή. Η επιδίωξη της εφαρμοζόμενης αγωγής συνίσταται στην ελάττωση και διατήρηση της συγκεντρώσεως του ουρικού οξέος χαμηλοτέρα του σημείου κορεσμού δια της αυξήσεως της διαλυτότητας των σχηματισθέντων κρυστάλλων και προλήψεως περαιτέρω σχηματισμού τόφου. Η συνήθης σύσταση είναι η επίτευξη συγκεντρώσεως του ουρικού οξέος του αίματος μικρότερης των 6 mg/dl15. Αυτό επιτυγχάνεται με την αποφυγή παραγόντων που ευνοούν την υπερουριχαιμία, διατήρηση της διουρήσεως και φαρμακευτική αγωγή. Μέχρι σήμερα υπήρχε διαθέσιμη φαρμακευτική αγωγή με την γνωστή αλλοπουρινόλη. Η αλλοπουρινόλη, είναι αναστολέας της οξειδάσης της ξανθίνης και χρησιμοποιείται ως αντιϋπερουριχαιμικός παράγοντας για τα τελευταία 40 χρόνια. Η αλλοπουρινόλη, τυπικώς χορηγείται από το στόμα σε δόση 300-400mg ημερησίως (μεγίστη δόση 800mg/ημερησίως), είναι δε αποτελεσματική στους περισσότερους ασθενείς με υπερουριχαιμία που προκαλείται είτε λόγω υπερπαραγωγής ή ελαττωμένης απεκκρίσεως του ουρικού οξέος. Η αλλοπουρινόλη είναι καλώς ανεκτή. Γενικότερα, πλέον του 20% των ασθενών έχουν αναφέρει ανεπιθύμητες ενέργειες και η απόσυρση από την θεραπεία είναι υψηλή (15%). Μεταξύ των ανεπιθύμητων ενεργειών είναι πιθανώς το σύνδρομο σοβαρής υπερευαισθησίας και εξάνθημα, νεφροτοξικότητα και ηπατοτοξικότητα. καταστάσεις που περιορίζουν την χρήση της αλλοπουρινόλης. Η δόση της αλλοπουρινόλης πρέπει να εξατομικεύεται στους ηλικωμένους ασθενείς και σε ασθενείς με νεφρική ανεπάρκεια16.
Κλινική Φαρμακολογία
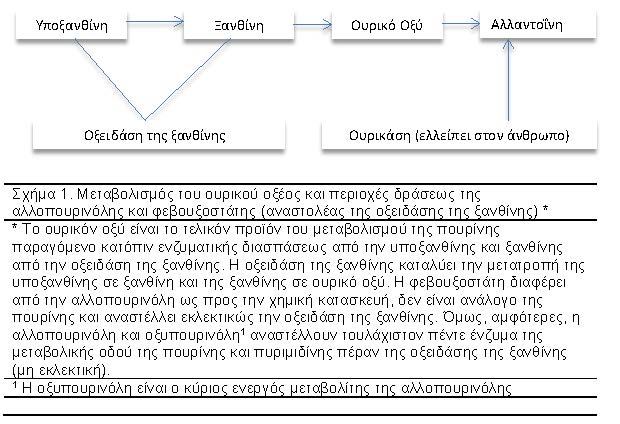
Η φεβουξοστάτη είναι ένας πουρινικός, ισχυρός και εκλεκτικός αναστολέας της οξειδάσης της ξανθίνης και της δεϋδρογενάσης της ξανθίνης. Η μετατροπή της υποξανθίνης σε ξανθίνη και ουρικό οξύ καταλύεται από την οξειδάση της ξανθίνης (ξανθίνης δεϋδρογενάσης). Όπως η αλλπουρινόλη, η φεβουξοστάτη ελαττώνει τα επίπεδα του ουρικού του ορού μέσω αναστολής του ανωτέρω ευζυμικού συστήματος, αλλά η φεβουξοστάτη είναι πλέον ισχυρός αναστολέας παρά η αλλοπουρινόλη17. Σε αντιθέσει με την αλλοπουρινόλη, η φεβουξοστάτη αναστέλλει αμφότερα τα οξειδωτικά συστήματα και ελαττώνει τις μορφές της οξειδάσης της ξανθίνης, αλλά δεν αναστέλλει ένζυμα που συμμετέχουν στον μεταβολισμό της πουρίνης και πυριμιδίνης ειδικότερα, η φεβουξοστάτη.
Σε υγιείς εθελοντές οι αναλογικές ελαττώσεις των μέσων συγκεντρώσεων του ουρικού οξέος του ορού με δόσεις φεβουξοστάτης 10 μέχρι 120 mg ήταν 25% μέχρι 75%18. Οι συγκεντρώσεις του ουρικού οξέος του ορού ήταν ελαττωμένες κατά 40% με ημερησία δόση 40 mg και 55% με ημερησία δόση 80 mg.
Φαρμακοκινητική
Η φεβουξοστάτη χορηγείται από το στόμα και απορροφάται ταχέως και σε υψηλό
βαθμό (84%). Ο χρόνος ημισείας ζωής είναι 0.5 μέχρι 1,5 ώρα μετά την χορήγηση από το στόμα19. Η συγκέντρωση της φεβουξοστάτης στο πλάσμα και η περιοχή κάτω από την καμπύλη συγκεντρώσεως – χρόνου (HVC) αυξήθηκαν με τρόπο ανάλογο της χορηγηθείσας δόσης από 10 μέχρι 120 mg 18, 20, 21. Για δόσεις 120 μέχρις 240 mg οι μέγιστες συγκεντρώσεις στο πλάσμα παρέμειναν αναλογικές της δόσεως 21. Συνδέεται σε λίαν υψηλό βαθμό με την λευκωματίνη (περίπου 99%) και ο όγκος κατανομής είναι περίπου 0,7 L/Kg22.
Η φεβουξοστάτη μεταβολίζεται στο ήπαρ σε ακετυλ-γλυκουρινιδικούς μεταβολίτες μέσω συζεύξεως διαμέσου συστήματος του ενζύμου διφωσφορική ουριδίνη γλυκουρονοσυλ-τανσφεράση (UGT) και οξειδώσεως δια μέσου των ενζύμων του κυττοχρώματος Ρ450 (CYP1A2, CYP2C8 και CYP2C9)17,20,23. Η απέκκριση της φεβουξοστάτης γίνεται τόσο από την ηπατική όσο και από την νεφρική οδό. Ποσοστό μικρότερο του 6% της χορηγηθείσας δόσης απεκκρίνεται στα ούρα ως αμετάβλητο φάρμακο 19, 20, 23. Ο μέσος χρόνος ημισείας ζωής του φαρμάκου είναι 4 μέχρι 9 ώρες 19,20, 24 πέραν της απεκκρίσεως στα ούρα, ποσοστό της τάξης του 12% απεκκρίνετια στα κόπρανα ως αμετάβλητο φάρμακο 24.
Η φαρμακοκινητική ή φαρμακοδυναμική της φεβουξοστάτης δεν επηρεάζεται από την ηλικία, φυλή και φύλο 25, 26. Η χορήγηση της φεβουξοστάτης μαζί με αντιόξινα προκαλεί επιβράδυνση στον χρόνο της μεγίστης συγκεντρώσεως αλλά δεν μεταβάλλει την έκταση της απορροφήσεως. Η χορήγηση με τροφή έχει ως αποτέλεσμα την επιβράδυνση του χρόνου της μεγίστης συγκεντρώσεως και ελαφρά ελάττωση στην έκταση της απορροφήσεως, παρά ταύτα, δεν παρατηρήθηκε ελάττωση της φαρμακοδυναμικής.
Οι συγκεντρώσεις της φεβουξοστάτης και των μεταβολιτών της ήταν ελαφρώς αυξημένες σε ασθενείς με διαταραχή της νεφρικής λειτουργίας. Με βάση τα υπάρχοντα δεδομένα δεν είναι απαραίτητα η τροποποίηση της δοσολογίας σε ασθενείς με ηπία μέχρι σοβαρή νεφρική ανεπάρκεια 21,27. Οι συγκεντρώσεις της φεβουξοστάτης και των μεταβολιτών της αυξάνουν ελαφρώς και το ουρικόν οξύ του ορού ελαττώνεται ελαφρώς σε ασθενείς με ήπια ή μετρία ηπατική ανεπάρκεια. Εν τούτοις, οι διαφορές δεν ήταν κλινικώς σημαντικές και δεν φαίνεται να προκύπτει ότι είναι απαραίτητη η τροποποίηση της δοσολογίας 23, 28.
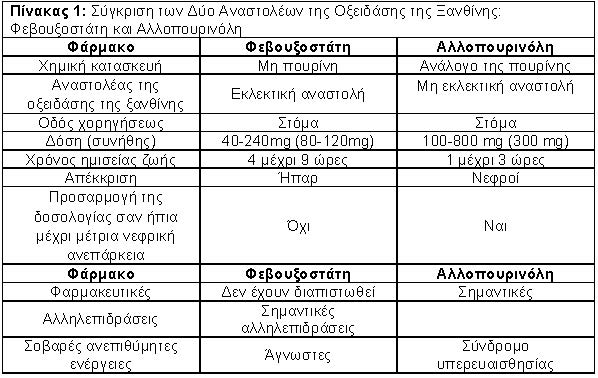
Στο σχήμα 1 και Πίνακα 1 φαίνονται ορισμένα φαρμακοδυναμικά και φαρμακοκινητικά χαρακτηριστικά της φεβουξοστάτης και αλλοπουρινόλης.
Κλινική Αποτελεσματικότητα
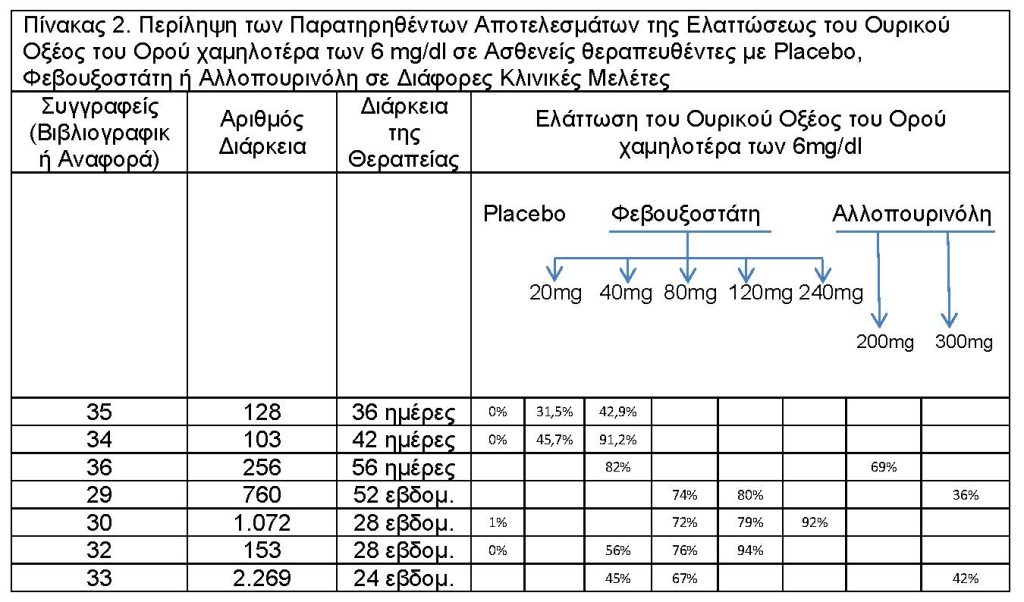
Η κλινική αποτελεσματικότητα της φεβουξοστάτης καταδέιχθηκε σε μία σειρά κλινικών μελετών, οι οποίες περιελάμβαναν σημαντικό αριθμό ασθενών με ουρική αρθρίτιδα και υπερουριχαιμία.
Ο Becker και συν29 συνέκριναν την αποτελεσματικότητα της φεβουξοστάτης και της αλλοπουρινόλης σε 760 ασθενείς με ουρική αρθρίτιδα θεραπευθέντες με φεβουξοστάτη 80 mg ημερησίως (256 ασθενείς), φεβουξοστάτης 120 mg ημερησίως (251 ασθενείς) ή αλλοπουρινόλη 300 mg ημερησίως (253 ασθενείς) για 52 εβδομάδες (the Febuxostat vs Allopurinol Controlled Trial {FACT}). Οι συμμετέχοντες ασθενείς είχαν επίπεδα ουρικού οξέος του ορού 8 mg/dl ή περισσότερα κατά την είσοδο στην μελέτη και εκπληρούσαν τα κριτήρια American College of Pheumatology για την οξεία ουρική αρθρίτιδα. Η μέση ηλικία των ασθενών ήταν 51,8 έτη, 96% ήταν άρρενες, 77% λευκοί, 24% είχαν ιστορικό ή παρουσία τόφου και 44% είχαν λάβει στον παρελθόν θεραπεία ελαττώσεως του ουρικού οξέος. Συνήθεις συνοδές παθολογικές καταστάσεις περιλαμβάνουν την παχυσαρκία(62%), υπέρταση (44%), υπερλιπιδαιμία (34%), νεφρική ανεπάρκεια (κάθαρση κρεατινίνης (CrCl) μεγαλύτερη των 50 ml/min και μικρότερη των 80 ml/min, 35%) και χρήση οινοπνεύματος (66%). Οι μέσες οριακές συγκεντρώσεις του ουρικού οξέος του ορού εκυμαίνοντο από 9.8 μέχρι 9,9 mg/dl με το 51 % των ασθενών να έχουν οριακή συγκέντρωση του ουρικού οξέος του ορού τουλάχιστον 10 mg/dl. Η προφύλαξη εναντίον των κρίσεων ουρικής αρθρίτιδας εγένετο με την χορήγηση ναπροξένης ή κολλικίνης με πρόβλεψη κατά την διάρκεια των πρώτων 8 εβδομάδων. Ο πρωταρχικός τελικός στόχος της μελέτης ήταν η επίτευξη του επιπέδου του ουρικού οξέος του ορού να ήταν της τάξεως μικροτέρας των 6mg/dl κατά τις τελευταίες 3 επακόλουθες μηνιαίες μετρήσεις. Αυτό επετεύχθη στο 53% των ασθενών θεραπευθέντων με φεβουξοστάτη 80 mg και 62% θεραπευθέντων με φεβουξοστάτη συγκριτικά με 21% θεραπευθέντων με αλλοπουρινόλη (Ρ<0,001 για κάθε ομάδα φεβουξοστάτης έναντι της αλλοπουρινόλης). Η συνολική επίπτωση των κρίσεων της ουρικής αρθρίτιδας από την 9η μέχρι την 52η εβδομάδα δεν διέφερε μεταξύ των δύο εβδομάδων. Κρίσεις της ουρικής αρθρίτιδας κατά την διάρκεια της θεραπευτικής περιόδου παρατηρήθηκαν στο 64% των ασθενών με φεβουξοστάτη 80 mg, 70% των ασθενών με φεβουξοστάτη 120 mg και 64% των ασθενών της ομάδας με αλλοπουρινόλη. Η μέση ελάττωση της τοφώδους περιοχής δεν διέφερε μεταξύ των δύο ομάδων (83% στην ομάδα των ασθενών που έλαβαν φεβουξοστάτη, 80 mg. 66% σε αυτούς που έλαβαν φεβουξοστάτη 120 mg και 50% σε αυτούς που έλαβαν αλλοπουρινόλη). Ως συμπέρασμα, η μελέτη FACT έδειξε ότι η φεβουξάτη σε ημερησία δόση 80 mg ή 120 mg ήταν πλέον δραστική της αλλοπουρινόλης χρησιμοποιουμένη σε δόση 300 mg ημερησίως στην ελάττωση του ουρικού οξέος του ορού. Παρόμοιες ελαττώσεις παρατηρήθηκαν στις κρίσεις της ουρικής αρθρίτιδας και τις τοφώδεις περιοχές.
Η μελέτη APEX (Allopurinol and Placedo-Controlled Effidor Study of Feduxostat) ήταν μία τυχαιοποιημένη, διπλή-τυφλή πολυκεντρική μελέτη αποτελεσματικότητας της φεβουξοστάτης με αλλοπουρινόλη, της φάσεως 3 και ήταν τυχαιοποιημένη, διπλή τυφλή, πολυκεντρική μελέτη διαρκείας 28 εβδομάδων 30. Η μελέτη περιελάμβανε 1072 ασθενείς με υπερουριχαιμία (επίπεδο ουρικού οξέος αίματος τουλάχιστον 8mg/dl), ουρική αρθρίτιδα και υγιείς ή με διαταραχή της νεφρικής λειτουργίας. Η μέση ηλικία ήταν 51 μέχρι 54 έτη, 94% των ασθενών ήταν άρρενες και 7% αυτών λευκοί. Το μέσον επίπεδο του ουρικού οξέος του ορού ήταν 9,85 mg/dl 24% μέχρι 33% των ασθενών είχαν ιστορικό ή παρουσία τόφου και 20% μέχρι 3% είχαν λάβει αλλοπουρινόλη. Συνυπάρχουσες, συχνές παθολογικές καταστάσεις περιελάμβαναν την παχυσαρκία 62%, υπέρταση 47% και υπερλιπιδαιμία 33% των ασθενών, ενώ 66% είχαν πρόσφατο ιστορικό χρήσεως οινοπνεύματος. Οι ασθενείς έλαβαν φεβουξοστάτη 80 mg (267 ασθενείς), 120 mg (269 ασθενείς) ή 240 mg (134 ασθενείς), όλοι τυχαιοποιημένοι, άπαξ ημερησίως για 28 ημέρες.
Η δόση της αλλοπουρινόλης καθορίστηκε με βάση το φυσιολογικό ή όχι της νεφρικής λειτουργίας, με την δόση των 300 mg να χορηγείται σε ασθενείς με νεφρική δυσλειτουργία (κρεατινίνη του ορού μεγαλύτερη του 1,5 και υψηλότερη των 2 mg/dl). Προφυλακτικώς για την αποφυγή ουρικών κρίσεων χορηγήθηκαν κολλικίνη ή ναπροξένη τις πρώτες 8 εβδομάδες. Ο πρωταρχικός τελικός στόχος ήταν η επίτευξη επιπέδων ουρικού οξέος του ορού χαμηλότερα των 6 mg/dl τουλάχιστον σε τριμηνιαίες μετρήσεις, γεγονός που επετεύχθη στο 48% θεραπευθέντων με φεβουξοστάτη 80mg, 65% με φεβουξοστάτη 120mg και 69% με φεβουξοστάτη 240mg συγκριτικά με 22% θεραπευθέντων με αλλοπουρινόλη (Ρ<0,005) και 0 θεραπευθέντων με placedo (Ρ<0,005). Μεταξύ των ασθενών με διαταραχή της νεφρικής λειτουργία, περισσότεροι ασθενείς θεραπεύτηκαν με φεβουξοστάτη 80mg (4 από 9, 44%), φεβουξοστάτη 120 mg (5 από 11, 45%) και φεβουξοστάτη 240 mg (3 από 5, 60%) επέτυχαν τον πρωταρχικό τελικό σκοπό συγκριτικά με τους θεραπευθέντες με αλλοπουρινόλη 100 mg (0 από 10. 0%, Ρ<0,05). Οι ελαττώσεις των επιπέδων του ουρικού οξέος του ορού από το οριακό στις 28 εβδομάδες ήταν οι ακόλουθες: -48% με φεβουξοστάτη 80 mg , -55% με φεβουξοστάτη 120 mg , -68% με φεβουξοστάτη 240 mg ,-34% με αλλοπουρινόλη και – 4% με placebo. Οι διαφορές αυτές μεταξύ της φεβουξοστάτης και αλλοπουρινόλης, ήταν στατιστικώς σημαντικές σε όλες τις ομάδες (Ρ<0,()5). Οι ελαττώσεις του ουρικού οξέος του ορού παρατηρήθηκαν κατά την δεύτερη εβδομάδα και παρέμειναν καθ* όλη την διάρκεια της μελέτης. Κατά την 28η εβδομάδα, δεν υπήρξαν διαφορές μεταξύ των ομάδων όσον αφορά την ελάττωση του τόφου και της τοφώδους επιφανείας μεταξύ των ομάδων των ασθενών. Τα αποτελέσματα της μελέτης APEX έδειξαν ότι η φεβουξοστάτη χορηγούμενη σε ημερησίες δόσεις των 80 mg , 120 mg και 240 mg είναι πλέον αποτελεσματική έναντι της αλλοπουρινόλης και placebo στην ελάττωση του ουρικού οξέος του ορού σε ασθενείς με υπερουριχαιμία και ουρική αρθρίτιδα” .
Οι φεβουξοστάτη και αλλοπουρινόλη επίσης συγκρίθηκαν σε μία διαρκείας 6 μηνών τυχαιοποιημένη, διπλή τυφλή μελέτη, η οποία περιελάμβανε 2.269 ασθενείς με ουρική αρθρίτιδα. Η μέση ηλικίας 52,8 έτη, 94% από τους ασθενείς ήταν άρρενες και 82% ήταν λευκοί.31. Συνυπάρχουσες, συχνές παθολογικές εξετάσεις περιελάμβαναν ασθενείς με χρονία νεφρική νόσο ηπίας μέχρις βαρύτητας (63%), παχυσαρκία (64%), υπέρταση (53%) και υπερλιπιδαιμία (42%). Η μέση τιμή του ουρικού οξέος του αίματος ήταν 9,6mg/dl με 32,3% των ασθενών να έχουν τιμή μεγαλύτερη των 10mg/dl. Οι ασθενείς έλαβαν φεβουξοστάτη 40 mg, φεβουξοστάτή 80 mg ή αλλοπουρινόλη 300 mg άπαξ ημερησίως. Οι ασθενείς της ομάδας της αλλοπουρινόλης με CrCl ήταν 30 μέχρι 59 Ml/min έλαβαν αλλοπουρινόλη. Χορηγήθηκε προφυλακτική θεραπεία. Ο πρωταρχικός τελικός σκοπός ήταν η επίτευξη τελικής τιμής χαμηλοτέρας των 6mg/dl, επιτευχθείσα στο 45% των ασθενούν που έλαβαν φεβουξοστάτη 40 mg και 67% που έλαβαν φεβουξοστάτη 80 mg και 42% που έλαβαν αλλοπουρινόλη (Ρ<0.001 για φεβουξοστάτη 80 mg έναντι φεβοξοστάτης 40 mg and placebo). Στους ασθενείς με ήπια μέχρι μέτρια νεφρική νόσο, τιμή ουρικού οξέος αίματος χαμηλότερη των 6mg/dl επιτεύχθηκε στο 50% των ασθενών θεραπευθέντες με φεβουξοστάτη 40 mg, 72% των θεραπευθέντων με φεγουξοστάτη 80 mg και 42% των θεραπευθέντων με αλλοπουρινόλη (ΡΟ,ΟΟΙ για φεβουξοστάτη 80 mg έναντι φεβουξουστάτης 4g and placebo, Ρ<0,02 για φεβουξοστάτη 40mg έναντι placebo)31.
Η φεβουξοστάτη εκτιμήθηκε περαιτέρω σε μία τυχαιοποιημένη, διπλή τυφλή placebo ελεγχόμενη, δόσο-ανταποκρινόμενη, διαρκείας 28 ημερών μελέτη, που περιελάμβανε 153 ασθενείς (23 μέχρι 80 έτη) με ουρική αρθρίτιδα και υπερουριχαιμία (ουρικόν οξύ του ορού 8 mg/dl ή μεγαλύτερο- Μελέτη Focus). Οι ασθενείς έλαβαν 40, 80 ή 120 mg φεβουξοστάτη ή placebo άπαξ ημερησίως για 28 ημέρες με προφυλακτική χορήγηση κολχικίνης 0,6 mg δύο φορές ημερησίως για 14 ημέρες προ και 14 ημέρες μετά την τυχαιοποίηση. Ο πρωταρχικός τελικός στόχος ήταν η ρύθμιση ώστε το ουρικό οξύ του ορού να ήταν χαμηλότερο των 6mg/dl κατά την 28η ημέρα. Η μέση ελάττωση του ουρικού οξέος του ορού από το οριακό ήταν 2% στην ομάδα με placebo, 37% στην ομάδα των 40 mg, 44% στην ομάδα των 80 mg και 5,9% στην ομάδα των 120 mg φεβουξοστάτη. Ο πρωταρχικός τελικός σκοπός ήταν επιτυχής στο 56% των ασθενών θεραπευθέντων με 40 mg, 76% στην ομάδα 80 mg και 94% στην ομάδα 120 mg φεβουξοστάτη συγκριτικά με κανέναν των ασθενών θεραπευθέντων με placebo (Ρ0.001 για κάθε δόση συγκριτικά με placebo)32. Με την συμπλήρωση 28 ημερών μελέτης, 116 ασθενείς κατετάγησαν σε μία ανοικτή εκτεταμένη μελέτη, κατά την οποία έλαβαν φεβουξοστάτη 40 mg (8 ασθενείς), 80 mg (79 ασθενείς) ή 120 mg (29 ασθενείς ως ημερησία δόση συντηρήσεως). Τιμή ουρικού οξέος αίματος χαμηλότερη των 6 mg/dl μεταξύ των ασθενών που συνέχισαν την θεραπεία με φεβουξοστάτη επιτεύχθηκε σε 63 από 80 (79%) ασθενείς τον πρώτο χρόνο, 54 από 70 (77%) στα δύο χρόνια, 54 από 64 (84%) στα 3 χρόνια και 54 από 58 (95%) στα πέντε χρόνια. Συνολικά 55 από 116 (47%) ασθενείς ανέφεραν κρίση ουρικής αρθρίτιδας κατά τη διάρκεια της φάσεως συντηρήσεως, ενώ, ουδείς ανέφερε κρίση κατά τη διάρκεια του πέμπτου έτους33.
Η φεβουξοστάτη επίσης αξιολογήθηκε σε μία πολυκεντρική, διπλή – τυφλή, placebo- ελεγχόμενη μελέτη σε 103 ιάπωνες ασθενείς με ουρική αρθρίτιδα ή υπερουριχαιμία34. Οι ασθενείς έλαβαν placebo, φεβουξοστάτη 20 mg ημερησίως ή 40 mg ημερησίως για 6 εβδομάδες μετά την εισαγωγή θεραπείας είτε με placebo ή φεβουξοστάτη 10 mg ημερησίως για 2 εβδομάδες. Τιμή ουρικού οξέος του ορού χαμηλότερη των 6mg/dl δεν επιτεύχθηκε σε ουδένα ασθενή στην ομάδα με placebo 45,7% στην ομάδα με φεβουξοστάτη 20 mg (Ρ,0,001 έναντι placebo) και 91,2% στην ομάδα με φεβουξοστάτη 40 mg (Ρ=0,006 έναντι placebo)34.
Η φεβουξοστάτη αξιολογήθηκε περαιτέρω σε μία placebo-ελεγχόμενη δόσοανταποκρινόμενη σε 128 ασθενείς με ουρική αρθρίτιδα ή υπερουριχαιμία35. Οι ασθενείς έλαβαν placebo ή φεβουξοστάτη 10, 20 ή 40 mg ημερησίως για 6 εβδομάδες μετά την έναρξη θεραπείας είτε με placebo είτε με φεβουξοστάτη 10 mg για 2 εβδομάδες. Τα μέσα επίπεδα του ουρικού οξέος του ορού ελαττώθηκαν 0,1% από το οριακό στην ομάδα με placebo, 20,1% στην ομάδα με φεβουξοστάτη 10 mg, 31,5% στην ομάδα με 20 mg και 41,5% στην ομάδα με 40 mg. Επίπεδα ουρικού οξέος του ορού χαμηλότερα των 6 mg/dl δεν επιτεύχθηκαν σε ουδένα ασθενή με placebo, αλλά επιτεύχθηκαν στο 22% με 10 mg, 63% με 40 mg και 78% με 40 mg φεβουξοστάτης35.
Η φεβουξοστάτη συγκρίθηκε με την αλλοπουρινόλη σε μία πολυκεντρική, τυχαιοποιημένη, διπλή τυφλή μελέτη περιλαμβάνουσα 256 Ιάπωνες ασθενείς με ουρική αρθρίτιδα ή υπερουριχαιμία (ουρικόν οξύ ορού 8mg/dl ή μεγαλύτερο)36. Οι ασθενείς έλαβαν φεβουξοστάτη (128 ασθενείς) ή αλλοπουρινόλη (128 ασθενείς). Η θεραπεία άρχισε με φεβουξοστάτη 10 mg άπαξ ημερησίως για 12 ημέρες και συνεχίστηκε με 40 mg άπαξ ημερησίως ή αλλοπουρινόλη 100 mg δύο φορές ημερησίως για 44 ημέρες. Το ουρικό οξύ του ορού κατά το τέλος της μελέτης ήταν ελαττωμένο 40,5% από το οριακό με την φεβουξοστάτη και 33% από το οριακό με την αλλοπουρινόλη (Ρ<0,001 για την φεβουξοστάτη έναντι της αλλοπουρινόλης). Επίπεδα ουρικού οξέος του ορού 6mg/dl ή χαμηλότερα επιτεύχθηκαν στο 82% των ασθενών θεραπευθέντων με φεβουξοστάτη συγκριτικά με 69% των ασθενών θεραπευθέντων με αλλοπουρινόλη (Ρ=0,019)36.
Στον Πίνακα 2 αναφέρονται επιγραμματικά αποτελέσματα της ελάττωσης του ουρικού οξέος του ορού χαμηλότερα των 6mg/dl σε ασθενείς που υπεβλήθηκαν σε θεραπεία με placebo, φεβουξοστάτη ή αλλοπουρινόλη σε διάφορες κλινικές ημέρες.
Ανεπιθύμητες Ενέργειες
Γενικότερα, η φεβουξοστάτη είναι καλώς ανεκτό φάρμακο κατά την διάρκεια της μακροχρόνιας θεραπείας (έως 5 χρόνια). Η επίπτωση των ανεπιθύμητων ενεργειών δεν αυξήθηκε με την πάροδο του χρόνου και παρόμοιοι τύποι ανεπιθύμητων συμβάντων εμφανίστηκαν με την μακροχρόνια χρήση.
Η συχνότητα των ανεπιθύμητων ενεργειών στις διάφορες μελέτες ήταν παρόμοια στις θεραπευτικές ομάδες και μεγαλύτερες σε συχνότητα έναντι της placebo. Αυτές περιελάμβαναν ανωμαλίες της ηπατικής λειτουργίας, ναυτία, διάρροια, κεφαλαλγίες, αρθραλγία, αρθρική ακαμψία ή οίδημα και εξάνθημα. Κατά την διάρκεια της θεραπείας αναφέρθηκαν και άλλες ανεπιθύμητες ενέργειες στις οποίες περιελαμβάνοντο μυϊκές κράμπες, δυσκοιλιότητα, γαστροοισοφαγική παλινδρόμηση, ξηροστομία, ερύθημα, ζάλη και σπανίως αίσθημα παλμών, κνησμός και κόπωση 27-36. Η ταυτόχρονη χρήση της κολχικίνης για τις κρίσεις της οξείας ουρικής αρθρίτιδας μπορεί να έχει επίδραση επί της συνολικής φύσεως των ανεπιθύμητων ενεργειών σε ορισμένες μελέτες. Ο κίνδυνος καρδιαγγειακών συμβαμάτων με την φεβουξοστάτη είναι εξαιρετικά σπάνιος, αλλά πρέπει να λαμβάνεται σοβαρώς υπ’ όψη όταν το φάρμακο χορηγείται σε ασθενείς με ιστορικό αθηρωματικής ή καρδιαγγειακής νόσου 27-36.
Φαρμακευτικές Αλληλεπιδράσεις
Μελέτες φαρμακευτικών αλληλεπιδράσεων συμπεριλαμβάνουσες την φεβουξοστάτη με άλλα φάρμακα τα οποία μεταβολίζονται μέσω της ξανθοξειδάσης της ξανθίνης, δεν έχουν πραγματοποιηθεί. Εν τούτοις, η αναστολή του ενζύμου αυτού από την φεβουξοστάτη μπορεί να προκαλέσει αυξημένες συγκεντρώσεις στο πλάσμα αυτών των φαρμάκων, προκαλουμένης έτσι τοξικότητας. Η φεβουξοστάτη, ως εκ τούτου, αντενδείκνυται σε ασθενείς που λαμβάνουν θεοφυλλίνη, αζαθειοπρίνη ή μερκαντοπουρίνη. Με βάση τις μελέτες φαρμακευτικών αλληλεπιδράσεων, η φεβουξοστάτη δεν έχει κλινικώς σημαντικές αλληλεπιδράσεις με την κολχικίνη, ναπροξένη, ινδομεθασίνη, υδροχλωροθειαζίδη, βαρφαρίνη ή δεσιπραμίνη. Μελέτες αλληλεπιδράσεως της φεβουξοστάτης με κυτταροστατικά φάρμακα δεν έχουν γίνει 36,37.
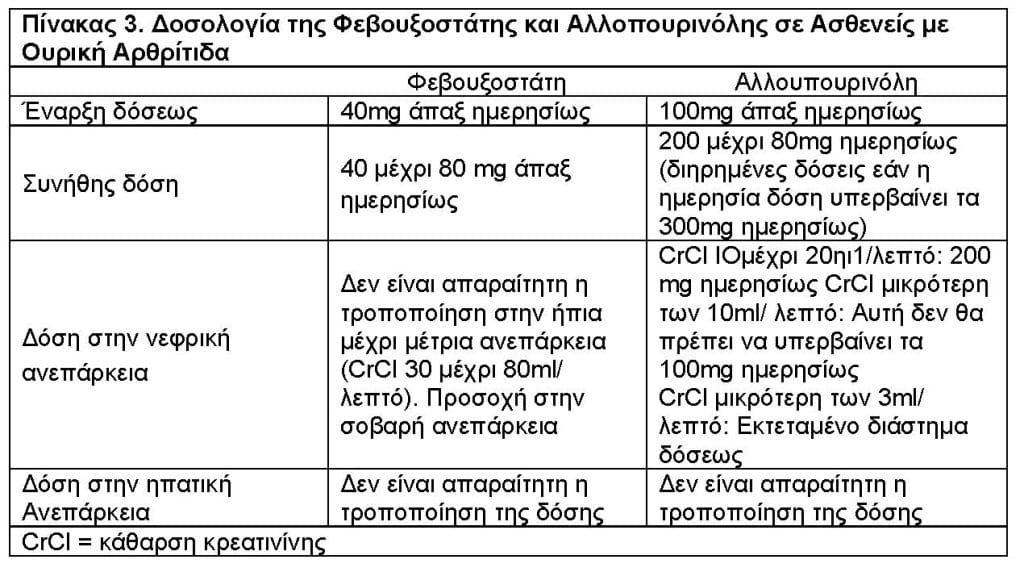
Δοσολογία της Φεβουξοστάτης
Η συνιστώμενη έναρξη της δοσολογίας της φεβοξοστάτης είναι 40mg άπαξ ημερησίως. Στις περιπτώσεις των ασθενών που δεν επιτυγχάνεται ελάττωση της συγκεντρώσεως του ουρικού οξέος του ορού μικρότερη των 6mg/dl μετά 2 εβδομάδες με την δόση των 40mg, τότε συνιστάται η χορήγηση ημερησίας δόσης των 80mg 24,39,40.
Η φεβουξοστάτη μπορεί να χορηγηθεί ανεξαρτήτως της λήψης τροφής ή αντιοξίνων φαρμάκων.
Δεν είναι απαραίτητη η τροποποίηση της δοσολογίας για τους ασθενείς με ήπια μέχρι μέτρια νεφρική ή ηπατική ανεπάρκεια.
Οι συνιστώμενες δόσεις της φεβουξοστάτης και αλλοπουρινόλης στην αντιμετώπιση της ουρικής αρθρίτιδας αναφέρονται στον Πίνακα 3.
Προειδοποιήσεις και Προφυλάξεις
Η φεβουξοστάτη δεν είναι αποτελεσματική για την θεραπεία της οξείας ουρικής
αρθρίτιδας. Όπως είναι γνωστόν, διάφορα φάρμακα που ελαττώνουν το ουρικό οξύ του ορού είναι δυνατόν κατά την έναρξη της θεραπείας και λόγω μεταβολής των επιπέδων του ουρικού οξέος του ορού συνεπεία κινητοποιήσεως αυτού από τις εναποθέσεις στους ιστούς να προκληθεί οξεία κρίση ουρικής αρθρίτιδας. Πράγματι, οξείες κρίσεις ουρικής αρθρίτιδας μπορεί να παρατηρηθεί κατά την έναρξη της θεραπείας με φεβουξοστάτη σε νέους ασθενείς και αυτοί μπορεί να συνεχίζουν ακόμη μετά αφότου αρχίσει η ελάττωση των συγκεντρώσεων του ουρικού οξέος του ορού συνήθως για τους πρώτους 6 μέχρι 12 μήνες. Η χορήγηση προφυλακτικής θεραπείας με κολλικίνη ή μη στεροειδές αντιφλεγμονώδες μπορεί να είναι ωφέλιμη κατά τη διάρκεια των πρώτων έξι μηνών της θεραπείας. Εάν παρατηρηθεί κρίση ουρικής αρθρίτιδας κατά την διάρκεια της θεραπείας με φεβουξοστάτη, δεν είναι απαραίτητη η διακοπή της θεραπείας με την φεβουξοστάτη.
Στους ασθενείς που λαμβάνουν φεβουξοστάτη συνιστάται ο περιοδικός έλεγχος της ηπατικής λειτουργίας. Η παρατηρηθείσα τρανσαμιναιμία παρατηρείται σε ποσοστό περίπου 3% των ασθενών με φεβουξοστάτη, ενώ το αντίστοιχο με την αλλοπουρινόλη είναι 2%. Δεν έχει παρατηρηθεί συσχέτιση της τρανσαμιναιμίας με την δόση της φεβουξοστάτης.
Προσοχή απαιτείται σε ασθενείς με σοβαρή νεφρική ανεπάρκεια (CrCl < 30mL/min) επειδή δεν υπάρχουν δεδομένα επ’ αυτού. Τουναντίον, δεν χρειάζεται τροποποίηση της δοσολογίας σε ασθενείς με ήπια ή μέτρια νεφρική ανεπάρκεια (CrCl 30 μέχρι 89 mL/min).
Σε ασθενείς με σοβαρή ηπατική ανεπάρκεια (Child-Pugh class C) συνιστάται μεγάλη προσοχή με την χρήση της φεβουξοστάτης, ενώ δεν απαιτείται τροποποίηση της δόσεως σε ασθενείς με ήπια ή μέτρια ηπατική ανπεάρκεια.
Συμπεράσματα
Από την μελέτη των διαφόρων προκύπτουν τα ακόλουθα όσον αφορά την φεβουξοστάτη
- Η φεβουξοστάτη είναι σημαντικά αποτελεσματική στην αντιμετώπιση των ασθενών με υπερουριχαιμία και ουρική αρθρίτιδα,
- Η θεραπεάι με φεβουξοστάτη επιτυγχάνει και διατηρεί επίπεδα ουρικού οξέος του αίματος < 6mg/dl,
- Η διατήρηση τιμών ουρικού οξέος του αίματος <6mg/dl συνοδεύεται και από ελάττωση των κρίσεων οξείας ουρικής αρθρίτιδας, εξάλειψη των τόφων και των κλινικών εκδηλώσεως της χρονίας ουρικής αρθρίτιδας,
- Δεν απαιτείται προσαρμογή της δοσολογίας της φεβουξοστάτης σε ασθενείς με μετρία νεφρική ή ηπατική ανεπάρκεια,
- Η φεβουξοσγτάτη είναι σχετικά ασφαλές φάρμακο,
- Η λήψη τροφής και αντιοξίνων δεν επηρεάζουν την απορρόφησή της,
- Η φεβουξοστάτη είναι ένας σημαντικός παράγοντας στην αντιμετώπιση της ουρικής αρθρίτιδας και ειδικότερα σε αυτούς που δεν ανέχονται την αλλοπουρινόλη, αυτούς με πολύ υψηλό οξύ του αίματος ή με παρουσία ανθεκτικών τόφων.
ΒΙΒΛΙΟΓΡΑΦΙΑ
- Wortmann RL. Gout and hyperuricemia. In: Firestein GS, et al. Kelley’s Textbook of Pheumatology, 8th ed. pp. 1481-1506. Philadelphia: Saunders Elsevier, 2009.
- Luk AJ, Simkin PA Epidemiology of hyperuricemia and gout. Am J Manag Care 2005; 11 (15 SuppI): 5432-5442.
- Weaver AL. Epidemiology of gout. Clev Clin J Med 2008; 7 (Suppl 5): 59-512.
- Lawrence RC, Felson DT, Helmick CG, et al Estimates of the prevalence of arthritis and other rheumatic conditions in the United States. Part II. Arthritis Rheu 2008; 58: 26-35.
- Mikuls TR, Saag KG New insights into gout epidemiology. Curr Opin Rheumatol 2006; 18: 199-203.
- Arromdee E. Michet CJ, Crowson CS, et al. Epidemiology of gout: Is the incidence rising? J Rheumatol 2002; 29: 2403-2406.
- Kim KY, Ralph Schumacher H, Hunsche E. et al Literature review of the epidemiology and treatment of acute gout. Clin Ther 2003; 25: 1593-1617.
- Choi HK, Mount DB. Reginato AM, et al. Pathogenesis of the gout. Ann Intern Med 2005; 143: 499-516.
- Becker MA, Schumacher MR, Mac Donald PA, et al. Clinical efficacy and safety of successful longterm urate lowering with febuxostat or allopourinol is a subject with gout. J Rheumatal 2009; 36: 1273-1282.
- Eggebeen AT. Gout: an update. Am Fam Phys 2007; 6 (6): 801-808.
- Janssens HJ, van de Lisdok EE, Janssen M, et al. Gout, not induced by diuretics? A case-control study from primary care. Ann Rheum Dis 2006; 65:1080-1083.
- Choi HK. Atkinson K. Karlson EW, et al. Alcohol intake and risk of incident gout in men: A prospective study. Lancet 2004; 363: 1277-1281.
- Choi HK, Atkinson K. Karslon EW. et al. Purine-rich foods, dairy and protein intake, and risks of gout in men. Ν Engl J Med 2004; 350: 1093-1103.
- Laroque PL, Esherick J, Blount W. Gout and hyperuricemia. CME Bulletin 2009; 8 (2): 1-6.
- Dore RK. Gout: What primary care physician wants to know. J Clin Rheumatol 2008; 14(5 suppl): 547-554.
- Stamp L, Gow P, Sharpies K, Raili B. The optimal use of allopurinol: an audit of allopurinol use in South Aucland. Intern Med J 2000; 30: 567-572.
- Takano Y, Hase-Aokik, Horiuchik, et al. Selectivity of febuxostat, a novel non-purine inhibitor of xanthine oxidase (xanthine dehydrogenase). Life Sci 2005; 76: 1835-1847.
- Becker MA. Kisicki I. Khosravan R, et al. Febuxostat (TMX – 67), a novel, non-purine, selective inhibitor of xanthine oxidase, is safe and decrease serum urate level in healthy volunteers. Nucleosides Nucleotides Nucleic Acids 2004; 23: 1111-1116.
- Komoriya K. Hoshides, Jakeda K, et al. Pharmacokinetics and pharmacodynamic of febuxostat (TMX-67), a non-purine selective inhibitor of xanthine oxidase /xanthine dehydrogenase (NPSIXO) in patients with gout and/or hyperuricemia. Nuclesides Nucleotidew Nucleic Acids 2004; 23: 1119-1122.
- Grabowski B, Khosravan r, Vernillet J, et al. Pharmacokinetics, pharmacodynamics, and safety of febuxostat (TM-67), a non- purine selective inhibitor of xanthine oxidase, in heathy subjects. J Clin Pharmacol 2004; 44: 1196.
- Khosravan R, Grabowski BA, Wu JT, et al. Pharmacokinetics, pharmacodynamics and safety of febuxostat, non-selective inhibiters of xanthine oxidase in a dose escalation study in healthy subjects. Clin Pharmacokinet 2006; 45: 821-841.
- Mayer MD Khosravan R, Vernillet L, et al. Pharmacokinetics and pharmacodynamics and safety of febuxostat, a new non purine selective inhibitor of xanthine in subjects with renal impairment. Am J Ther 2005; 12: 22-34.
- Khosravan R. Grabowski BA, Mayer MD. et al. The effect ol mild and moderate hepatic impairment on pharmacokinetics, pharmacodynamics and safety of febuxostat, a novel non purine selective inhibitor of xanthine oxidase. J Clin Pharmacol 2006; 46: 88-102.
- Hair PI, Mc Cormack PI, Keating GM. Febuxostat. Drugs 2008; 68: 1865-1874.
- Khosravan R, Kukulka Μ J, Wu JT, et al. The effect of age and gender on pharmacokinetics, pharmacodynamics, and safety of febuxostat, a novel nonpurine selective inhibitor of xanthine oxidase. J Clin Pharmacol 2008; 1014-1024.
- Khosravan R, Grabowski B. Wu JT, et al. Effect of food or autacid on pharmacokinetics and pharmacodynamics of febuxostat in healthy subjects. Br J Clin Pharmacol 2008; 65: 355-363.
- Hoshides, Takahishi Y. Ishikawa T, et al. PK/PD and safety of a single dose of TMX- 67 (febuxostat) in subjects with mild and moderate renal impairment. Nucleotides Nucleosides Nucleic Acids 2004; 23: 1117-1118.
- Macdonald WA, Zhao L, Hunt B, Gunawardhana L. Renal function in gout: Long-term treatment effects of febuxostat J Clin Rheumatol 2011; 17: 7-13.
- Becker MA, Schumacher IIR Jr, Wortmann RL, et al. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. Ν Engl J Med 2005 ; 353: 2450-2461.
- Schumacher MR J. Becker MA, Wortmann RL, et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28 -week, phase III, randomized, double- blind, parallel- group trial. Arthritis Rheum 2008; 59: 1540-1548.
- Becker M, Schumacher HR Jr, Espinoza L, et al. A phose 3 randomized, controlled, multicentre, double-blind trial (RCT) comparing efficacy and safety of daily febuxostat (FEB) and allopurinol (ALLO) in subjects with gout (abstract). Arthritis Rheumat 2008; 58: 4029.
- Becker M, Schumacher HR Jr, Wotmann RL, et al. Febuxostat, a novel nonpurine selective inhibiter of xanthine oxidase: a twenty-eight-day, multicenter, phase II, randomized, douple-blind, placebo-controlled, dose response clinical trial examining safety and efficacy in patients with gout. Arthritis Rheum 2005; 52: 916-923.
- Schumacher, HR Jr, Becker MA, Lloyd E, et al. Febuxostat in the treatment of gout: 5- yr findings of the focus efficacy and safety study. Rheumatology 2009; 48: 188-194.
- Kamatani N, Fujimori S, Hada T, et al. Febuxostat, a novel non-purine selective inhibitor of xanthine oxidase, in a phase III placebo-controlled double-blind clinical trial in Japanese subjects with gout or hyperuricemia (abstract). American college of Rheumatology 2004 Annual Scientific Meeting. Arthritis Rheum. 2004; 50 (suppl 9): S 337.
- Kamatani N, Fujimori S, Hada T, et al. Phase II dose-response clinical trial using febuxostat (TMX-67), a novel-type xanthine oxidase/xanthine dehydrogenase inhibitor, for gout and hyperuricemia (abstract). American College of Rheumatology 2003. Annual Scientific Meeting. Arthritis Rheum 2003; 48 (Suppl 9): 1349.
- Kamatani N, Fujimori S, Hada T, et al. Febuxostat, is a novel non-purine selective inhibitor of xanthine oxidase, in an allopurinol-contiOlled phase III clinical trial in Japanese subjects with gout or hyperucenia (abstract). American College of Rheumatology 2004. Annual Scientific Meeting. Arthritis Rheum 2004; 50 (Suppl 9): S 336-S 337.
- Khosravan R, Wu JT Joseph-Ridge N, Vernillet L. Pharmacokinetic interactions of concomitant administration of febuxostat and NSAID. J Clin Pharmacol 2006; 46: 855- 866.
- Mucoyoshi M, Nishimura H, Hoshide S, et al. In vitro drug-drug interaction studies with febuoxostat, a novel non-purine selective inhibitor of xanthine oxidase: plasma protein binding, identification of metabolic enzymes and a cytochrome P450 inhibition. Xenobiotica 2008; 38: 496-510.
- Hu Μ. Tomlinson Β. Febuxostat in the management of hyperuricemia and chronic gout: a review. Ther Clin Risk manag 2008; 4: 1209-1220.
- Keenan RT; Pillinger MH. Febuxostat: a new agent for lowering serum urate. Drugs Today 2008; 45: 247-260.